Содержание
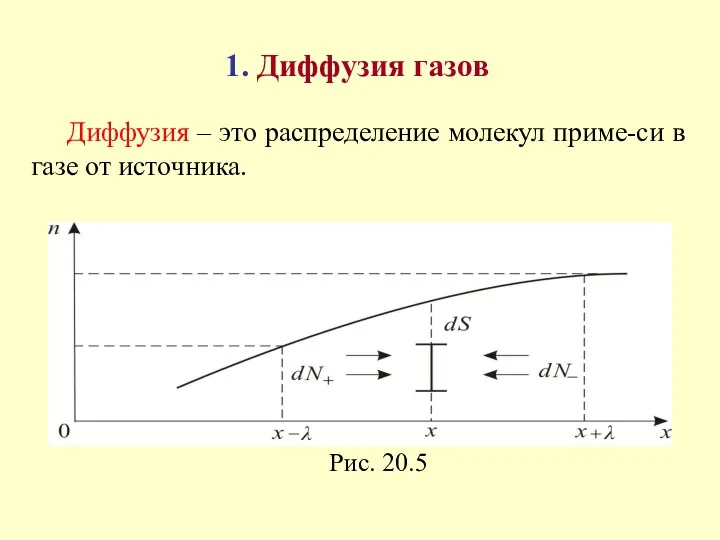
- 2. 1. Диффузия газов Диффузия – это распределение молекул приме-си в газе от источника.
- 3. Попытаемся получить уравнение диффузии, исходя из молекулярно-кинетических представлений. Чтобы упростить задачу, будем считать, что молекулы обеих
- 4. Решаем одномерную задачу. Пусть в газе присутствует примесь с концентрацией n в точке с координатой х.
- 5. Приступим к вычислениям. Допустим, что изменение концентрации первой компоненты вдоль оси х описывается функцией n1 =
- 6. (20.12) где - «эффективная» концентрация молекул первой компоненты слева от площадки, - «эффективная» концентрация молекул первой
- 7. Пусть в плоскости с координатой х находится единичная площадка S перпендикулярная оси х. Подсчитаем число молекул,
- 8. Поскольку λ очень мала, разность значений функций n1(x), стоящую в квадратных скобках, можно представить в виде
- 9. Сравнение выражения (20.15) с формулой (20.1) показывает, что исходя из молекулярно-кинетических представлений, удается не только прийти
- 10. Более строгий расчет приводит к такой же формуле, но с несколько отличным числовым коэффициентом. (20.17) или
- 11. Вывод, приведший нас к формуле (20.15), в равной степени применим к обеим компонентам смеси. Следовательно, коэффициент
- 12. Лекция окончена!
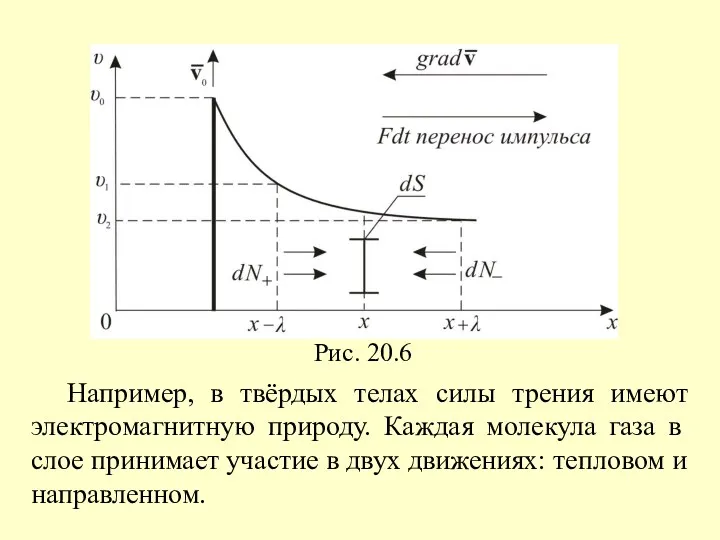
- 13. 2. Внутреннее трение. Вязкость газов Рассмотрим ещё одну систему координат (рис. 20.6) υ от х. Пусть
- 14. Например, в твёрдых телах силы трения имеют электромагнитную природу. Каждая молекула газа в слое принимает участие
- 15. Но так как направление теплового движения хаотически меняется, то в среднем вектор тепловой скорости равен нулю.
- 16. Вернёмся к рис. 20.6 и рассмотрим элементарную площадку dS перпендикулярно оси х. Через эту площадку за
- 17. Подстановка этих значений в (20.19) дает для потока импульса в направлении оси z выражение (20.20) Приняв
- 18. Уравнение (20.22) называют уравнением Ньютона, где D – коэффициент диффузии; ρ – плотность. Физический смысл η
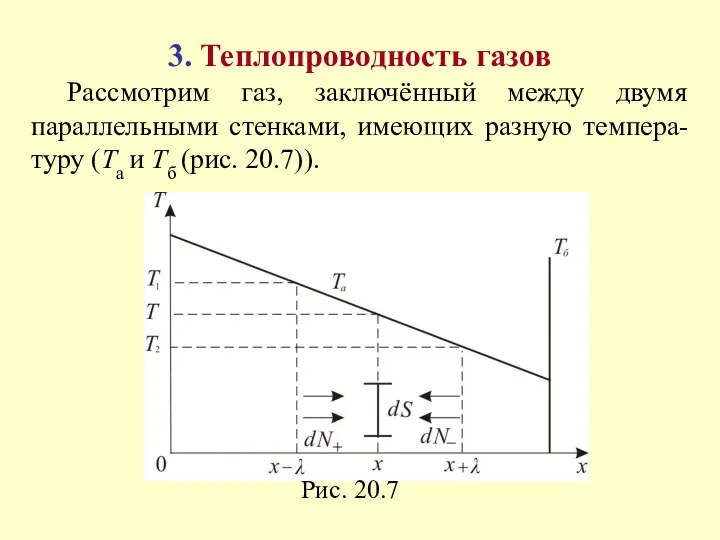
- 19. 3. Теплопроводность газов Рассмотрим газ, заключённый между двумя параллельными стенками, имеющих разную темпера-туру (Та и Тб
- 20. Итак, у нас имеется градиент температуры тогда через газ в направлении оси х будет идти поток
- 21. Снова вернёмся к рисунку: через площадку S за единицу времени проходит молекул: (20.23) Средняя энергия этих
- 22. В соответствии со сказанным для потока тепла через площадку S в положительном направлении оси x получается
- 23. Сопоставление этой формулы с формулой (20.3) дает для коэффициента теплопроводности следующее выражение (20.28) Вспомним, что выражение
- 25. Скачать презентацию



















 Урок на тему Механик тибәнешләр һәм дулкыннар
Урок на тему Механик тибәнешләр һәм дулкыннар Трансформаторы. Трансформатор Теслы
Трансформаторы. Трансформатор Теслы Открытие и применение закона всемирного тяготения
Открытие и применение закона всемирного тяготения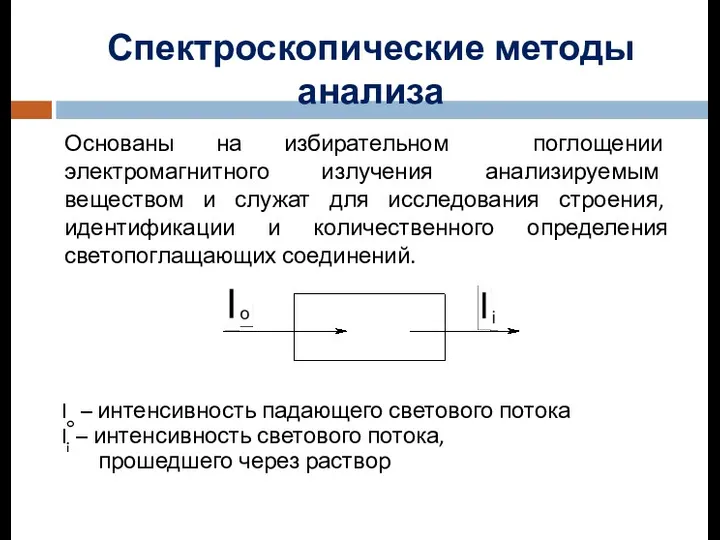 Спектроскопические методы анализа
Спектроскопические методы анализа Термическое окисление и свойства диоксида кремния. Практическое занятие №6
Термическое окисление и свойства диоксида кремния. Практическое занятие №6 презентация на тему последовательное и параллельное соединение проводников
презентация на тему последовательное и параллельное соединение проводников Энтропия. Второй закон термодинамики. Прямой и обратный циклы Карно. (Занятие 3)
Энтропия. Второй закон термодинамики. Прямой и обратный циклы Карно. (Занятие 3) Сила Лоренца
Сила Лоренца Electric field lines
Electric field lines Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров
Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров Фрезерные станки. (Тема 6)
Фрезерные станки. (Тема 6) Способы изменения внутренней энергии
Способы изменения внутренней энергии Резерфорд тәжірбесі. Атомның планетарлық моделі
Резерфорд тәжірбесі. Атомның планетарлық моделі Основы гидравлики
Основы гидравлики Методика обучения физике как педагогическая наука и учебная дисциплина
Методика обучения физике как педагогическая наука и учебная дисциплина Кампания ядерного реактора
Кампания ядерного реактора Основной закон электростатики
Основной закон электростатики Теплоёмкость идеального газа. Уравнение Майера
Теплоёмкость идеального газа. Уравнение Майера Турбомашиналардың паралель жұмыс істеуі бір
Турбомашиналардың паралель жұмыс істеуі бір Валы и оси. Общие сведения
Валы и оси. Общие сведения ISF3.8 CM2220 F103 Engine. Основные данные
ISF3.8 CM2220 F103 Engine. Основные данные Точность деталей сборочных единиц изделий
Точность деталей сборочных единиц изделий Атмосферное давление
Атмосферное давление Цикл уроков по кинематике
Цикл уроков по кинематике Воздействие радиации на человека
Воздействие радиации на человека Основные понятия в светотехнике. Источники света. Прожекторы и светильники
Основные понятия в светотехнике. Источники света. Прожекторы и светильники Презентация к уроку Архимедова сила
Презентация к уроку Архимедова сила Посудомоечная машина
Посудомоечная машина