Содержание
- 2. Основные положения молекулярно-кинетической теории, основные характеристики 1. Все материальные тела представляют собой огромную совокупность частиц (атомов
- 3. Количество вещества. Количество вещества характеризуется числом его структурных элементов. В СИ оно выражается в молях. Моль
- 4. Агрегатные состояния вещества Наличие разных агрегатных состояний вещества объясняется различием во взаимодействии молекул. На больших расстояниях
- 5. Модель идеального газа 1. Это газ, состоящий из точечных материальных частиц, упруго сталкивающихся между собой, силами
- 6. Основное уравнение молекулярно-кинетической теории идеального газа. Давление газа Основное уравнение молекулярно-кинетической теории идеального газа связывает важный
- 7. За это же время слой покидает, двигаясь, справа налево, такое же число молекул с таким же
- 8. Окончательно получаем: Полученное уравнение связывает макроскопический параметр – давление – и микроскопические параметры – массу и
- 9. Для идеального газа внутренняя энергия определяется только кинетической энергией его молекул. Средняя кинетическая энергия поступательного движения
- 10. Обоснование уравнения Клапейрона-Менделеева Уравнение состояния идеального газа или уравнение Клапейрона–Менделеева является опытным обобщением законов идеального газа,
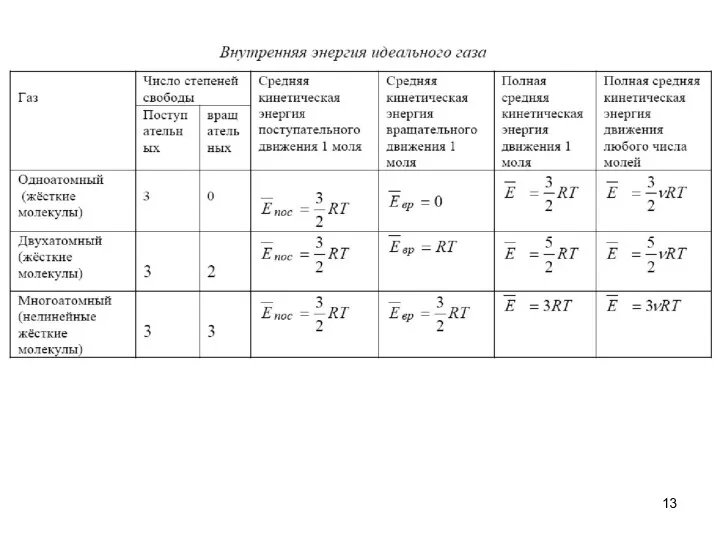
- 11. Средняя кинетическая энергия частицы. Распределение тепловой энергии по степеням свободы Среднюю кинетическую энергию движения молекул идеального
- 12. Энергия – величина аддитивная. Поэтому среднюю кинетическую энергию одного моля молекул можно определить, усреднив энергии всех
- 14. Статистическое описание свойств идеального газа. Основные понятия теории вероятностей Случайным событием называют такое событие, которое при
- 15. Пример. Пусть в некотором сосуде находится газ. При различных актах наблюдения молекула оказывается в различных точках
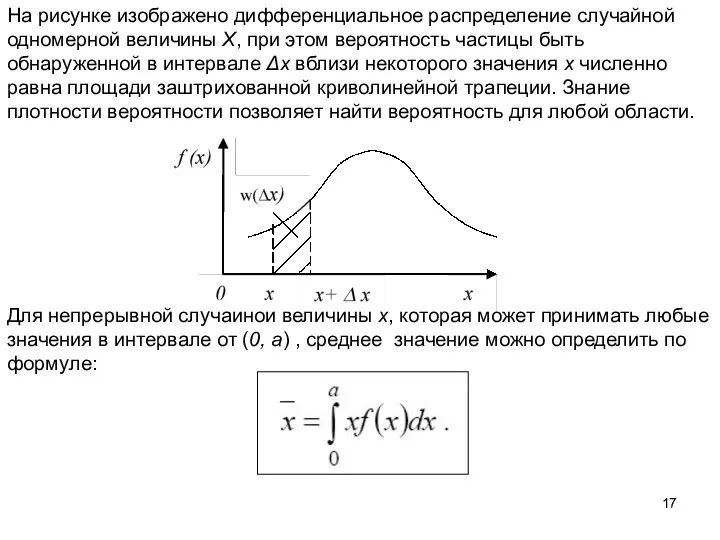
- 16. Таким образом, плотность вероятности – это вероятность нахождения молекулы в бесконечно малом объёме вблизи некоторой точки,
- 17. На рисунке изображено дифференциальное распределение случайной одномерной величины Х, при этом вероятность частицы быть обнаруженной в
- 18. Подобные усреднения можно проводить как по ансамблю частиц, так и по времени. Возьмём очень большое число
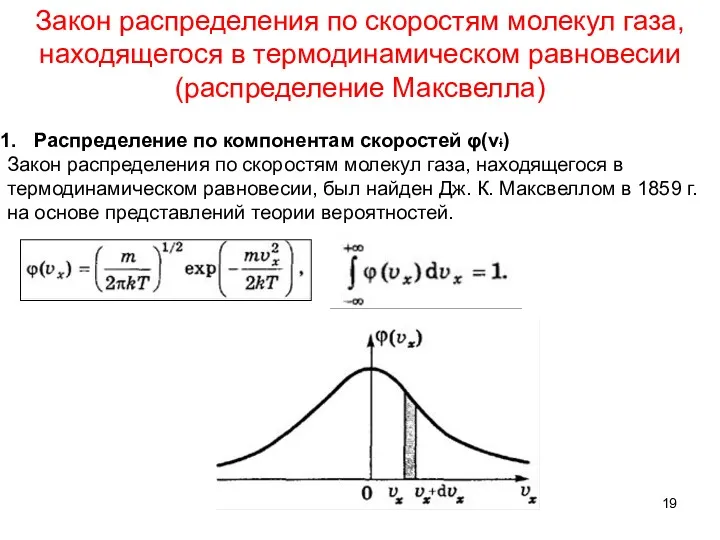
- 19. Закон распределения по скоростям молекул газа, находящегося в термодинамическом равновесии (распределение Максвелла) Распределение по компонентам скоростей
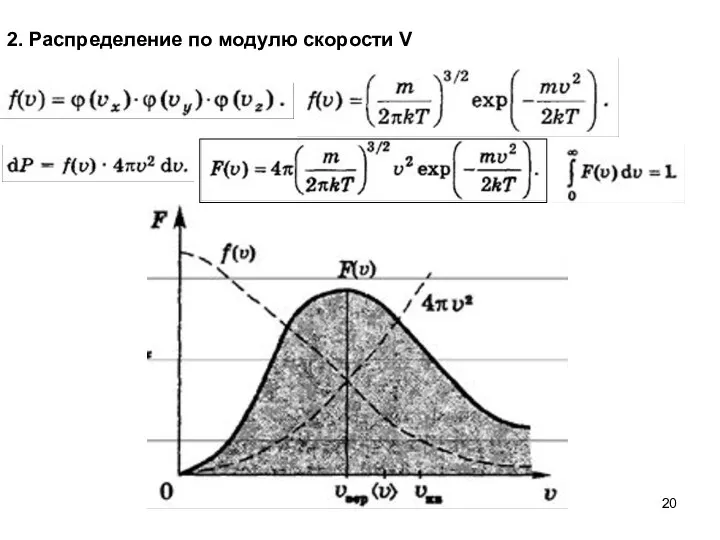
- 20. 2. Распределение по модулю скорости V
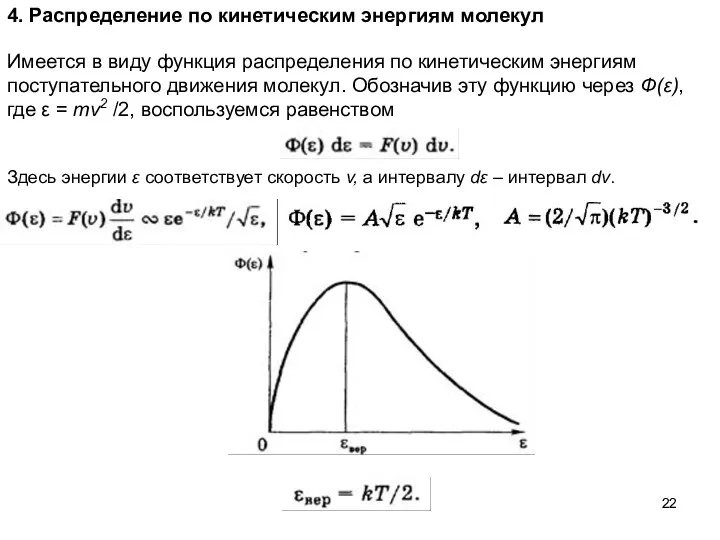
- 22. 4. Распределение по кинетическим энергиям молекул Имеется в виду функция распределения по кинетическим энергиям поступательного движения
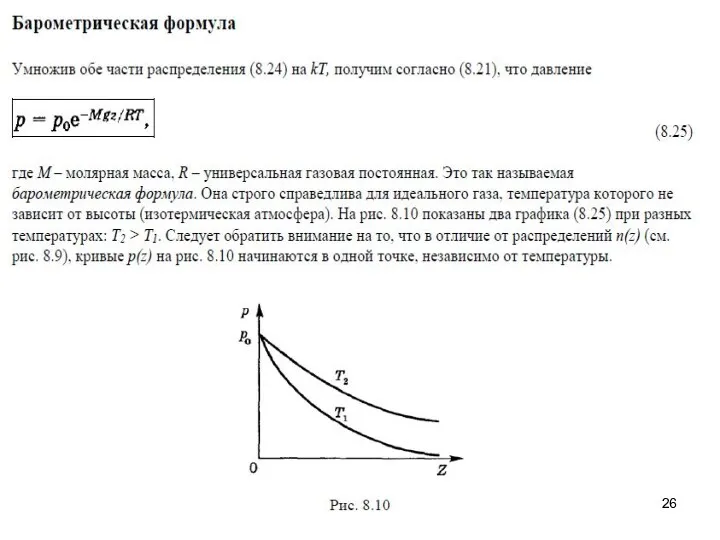
- 23. Распределение Больцмана
- 27. Статистический смысл энтропии Ключевыми понятиями в статистической теории макроскопических систем являются понятия микроскопического и макроскопического состояния
- 28. Назовем статистическим весом макроскопического состояния системы Ω число различных микроскопических состояний, которые соответствуют (доступны) данному макроскопическому
- 30. Можно показать, что с точки зрения статистической механики равновесное состояние макроскопической системы при фиксированных внешних условиях
- 31. Статистический вес не может быть просто пропорционален энтропии, так как энтропия – величина аддитивная, и энтропия
- 33. Скачать презентацию
























 Статистическое описание системы частиц
Статистическое описание системы частиц Урок решение задач по теме: Сила
Урок решение задач по теме: Сила Конспект урока по теме Плотность вещества
Конспект урока по теме Плотность вещества Godfrin Cryocoolers
Godfrin Cryocoolers Физика – это интересно! Внеклассное мероприятие по физике. 7 класс
Физика – это интересно! Внеклассное мероприятие по физике. 7 класс Давление. Атмосфернео давление. Закон паскаля. Закон архимеда
Давление. Атмосфернео давление. Закон паскаля. Закон архимеда Презентация к уроку физики в 8 классе. Лампа накаливания.
Презентация к уроку физики в 8 классе. Лампа накаливания.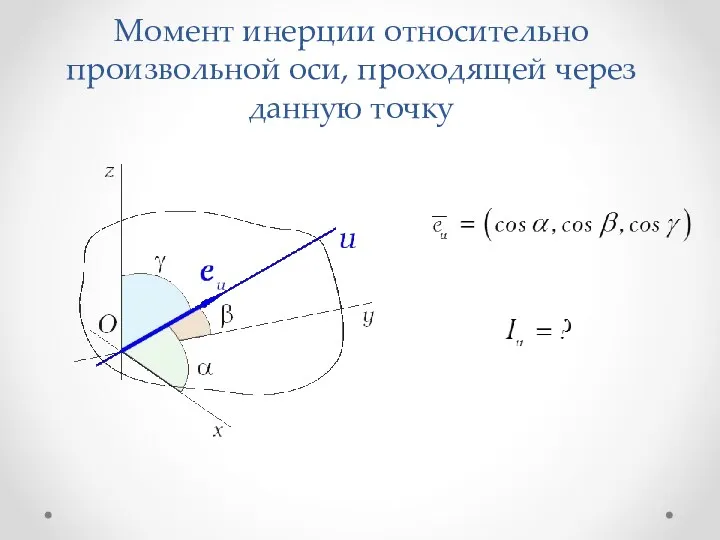 Момент инерции относительно произвольной оси, проходящей через данную точку. (Лекция 5)
Момент инерции относительно произвольной оси, проходящей через данную точку. (Лекция 5) 7 класс.Задания по физике на чтение и понимание учебного и научно-популярного текста по темам: Строение атома,Давление твёрдых тел, жидкостей и газов,Атмосферное давление,Энергия.
7 класс.Задания по физике на чтение и понимание учебного и научно-популярного текста по темам: Строение атома,Давление твёрдых тел, жидкостей и газов,Атмосферное давление,Энергия.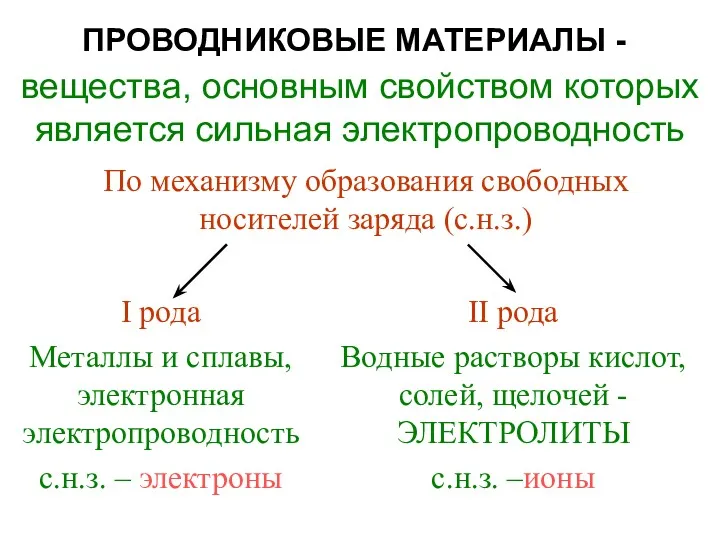 Проводниковые материалы
Проводниковые материалы 濽á ÒÓÒúßÔ¿ ºá¬¡ âÒ¬á
濽á ÒÓÒúßÔ¿ ºá¬¡ âÒ¬á Основы электродинамики. Электростатика
Основы электродинамики. Электростатика Действие физических и химических факторов окружающей среды на микроорганизмы
Действие физических и химических факторов окружающей среды на микроорганизмы Электрический ток в полупроводниках
Электрический ток в полупроводниках Дефекты поршневой группы, оценка состояния и влияние на надежность
Дефекты поршневой группы, оценка состояния и влияние на надежность Проекционный аппарат
Проекционный аппарат Генератор переменного тока. Виды генераторов
Генератор переменного тока. Виды генераторов Теплообмен излучением между телами, разделённой прозрачной средой. Коэффициент облучённости. Теплообмен между телами
Теплообмен излучением между телами, разделённой прозрачной средой. Коэффициент облучённости. Теплообмен между телами Дыбыс, кең мағынасында
Дыбыс, кең мағынасында Тепловые явления. Температура
Тепловые явления. Температура Содержание курса физики основной школы наше время
Содержание курса физики основной школы наше время Давление. Действие силы (7 класс)
Давление. Действие силы (7 класс) Использование информационно – коммуникационных технологий в процессе обучения физике
Использование информационно – коммуникационных технологий в процессе обучения физике ”Равноускоренное движение”
”Равноускоренное движение” Попов Александр Степанович
Попов Александр Степанович Получение и передача переменного электрического тока
Получение и передача переменного электрического тока Электроемкость. Конденсаторы. Энергия заряженного конденсатора
Электроемкость. Конденсаторы. Энергия заряженного конденсатора Топологические изоляторы и смежные вопросы
Топологические изоляторы и смежные вопросы