Содержание
- 2. Статистический характер необратимых процессов. При переходе в состояние термодинамического равновесия энтропия системы растет, достигая max при
- 3. молекула. Она участвует в беспорядочном движении вместе с другими молекулами. Она покидает этот объем и может
- 4. = 1/25 А если N молекул : - и процесс движения стано-вится все менее обратимым. Это
- 5. В связи со сказанным возникает необходимость определить вероятность состояния. Статистический вес макросостояния Рассмотрим закрытый сосуд с
- 6. б) указанием одного лишь количества молекул в ячейке; состояние, описанное таким образом, называется макросостоянием. Если все
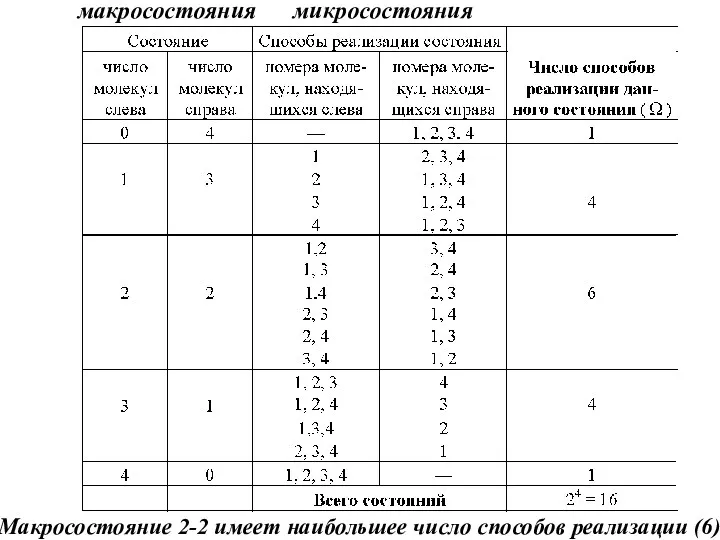
- 7. макросостояния микросостояния Макросостояние 2-2 имеет наибольшее число способов реализации (6)
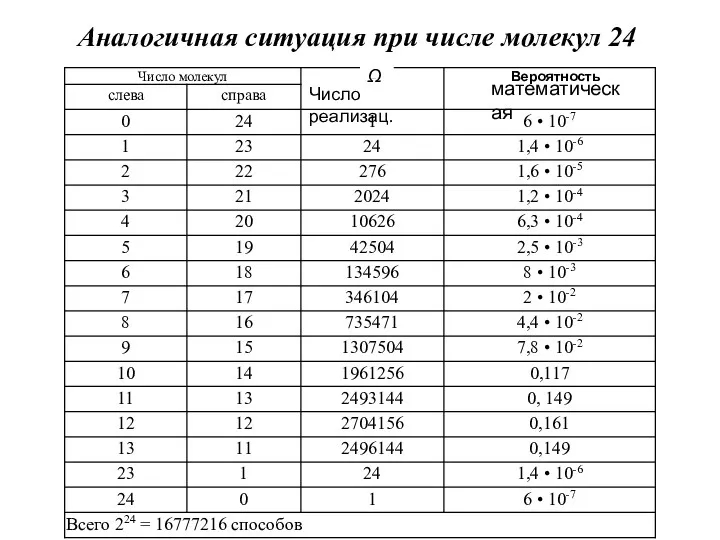
- 8. Аналогичная ситуация при числе молекул 24 математическая Ω Число реализац.
- 9. Из таблиц видно, что наибольшее число способов размещения соответствует состоянию, где слева и справа одинаковое число
- 10. Легко убедиться, что при любом N: при , когда система находится в равновесном состоянии. Термодинамическая вероятность
- 11. Формула Больцмана для энтропии Посмотрим на энтропию с другой стороны. Оказывается, более глубокий смысл энтропии вскрывается
- 12. Использовать статистический вес в качестве величины, определяющей вероятность состояния, неудобно, так как он неаддитивен. Но оказывается
- 13. Согласно Больцману, энтропия системы и термодинамическая вероятность связаны между собой следующим образом (формула Больцмана): где постоянная
- 14. С подавляющей вероятностью всякая изолированная система переходит в состояние с большей энтропией, то есть наиболее вероятным
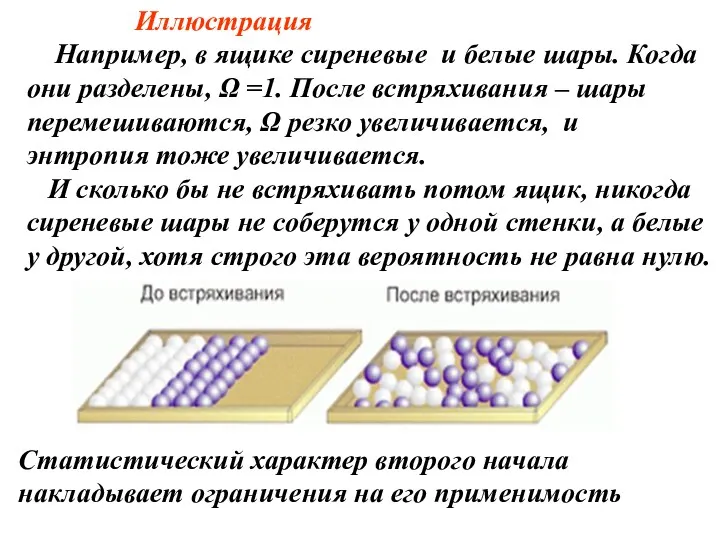
- 15. Иллюстрация Например, в ящике сиреневые и белые шары. Когда они разделены, Ω =1. После встряхивания –
- 16. Флуктуации. Всякие случайные явления сопровождаются флуктуациями. Флуктуациями называют случайные отклонения значений какой-либо физической величины x от
- 17. Клаузиус применил второе начало ко всей Вселенной и выдвинул гипотезу о тепловой смерти Вселенной. Эта гипотеза
- 18. При стремлении температуры к абсолютному нулю ( Т= 0 К ) уменьшается хаотичность системы. На основе
- 19. Принцип Нернста был развит Планком, предположившим, что при абсолютном нуле температуры энергия системы минимальна (но не
- 20. Основные свойства энтропии: 1. Энтропия является функцией состояния. Для вычисления энтропии системы в данном состоянии относительно
- 21. 5. Максимальное значение энтропии соответвует равновесному состоянию. 6. Энтропия непосредственно связана с вероятностью. Возрастание энтропии системы
- 22. Процессы релаксации Если система не находится в термодинамическом равновесии, то она стремится к нему и в
- 23. Раздел физики, изучающий эти процессы, называется физической кинетикой. В общем случае рассмотрение таких процессов – дело
- 24. Роль столкновений. Газокинетический диаметр молекул. Средняя длина свободного пробега. Средняя скорость теплового движения молекул при норм.усл.
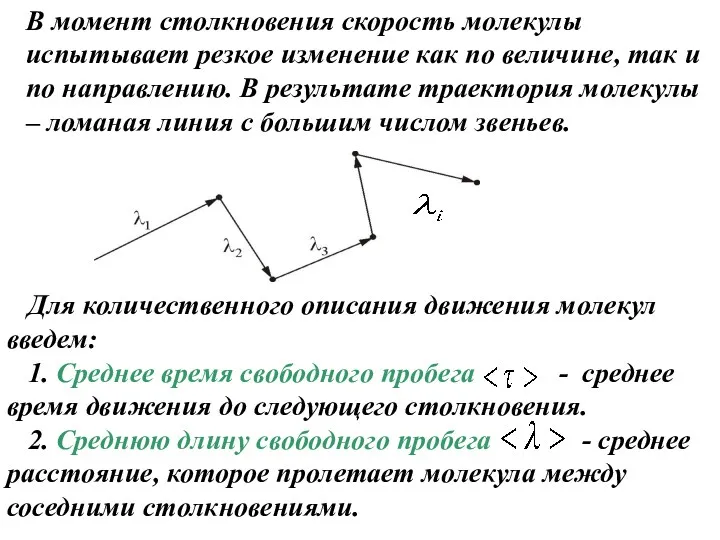
- 25. В момент столкновения скорость молекулы испытывает резкое изменение как по величине, так и по направлению. В
- 26. В данном рассмотрении не будем учитывать распределение молекул по скоростям, считая, что они движутся с одинаковой
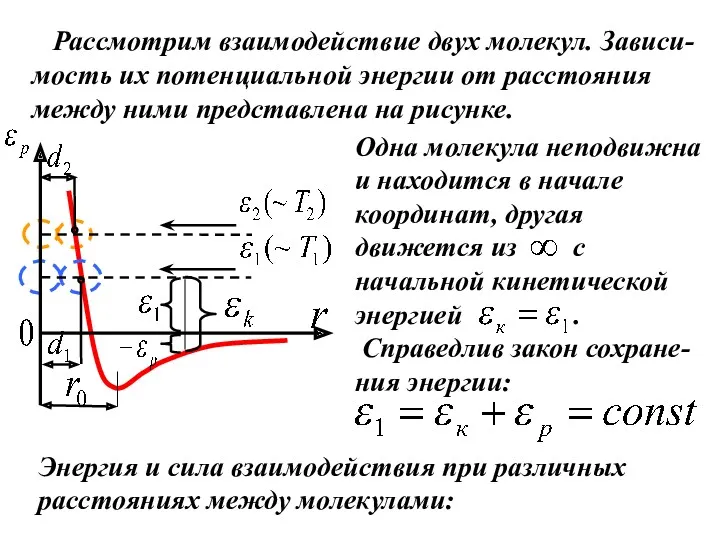
- 27. Рассмотрим взаимодействие двух молекул. Зависи-мость их потенциальной энергии от расстояния между ними представлена на рисунке. Одна
- 28. Минимальное расстояние, на которое сближаются центры двух молекул, называется эффективным (или газокинетическим) диаметром молекулы . При
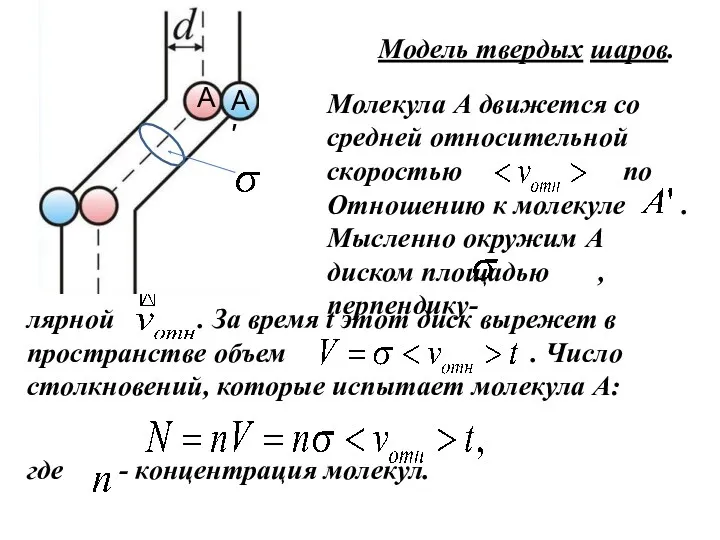
- 29. Модель твердых шаров. Молекула А движется со средней относительной скоростью по Отношению к молекуле . Мысленно
- 30. Можно показать, что . Тогда Если происходит одно столкновение (N=1 и ) Средняя длина свободного пробега
- 31. Из основного уравнения МКТ: , подставим в Число столкновений одной молекулы за 1 секунду: Полное число
- 33. Скачать презентацию
























 26e1e5eed06e9616d6b0b1a82d75cb58
26e1e5eed06e9616d6b0b1a82d75cb58 Вечный двигатель
Вечный двигатель Презентация Вселенная
Презентация Вселенная Презентация к статье: Способы совершенствования качества физического образования
Презентация к статье: Способы совершенствования качества физического образования Леонардо да Винчи
Леонардо да Винчи презентация к уроку физика-технология
презентация к уроку физика-технология Движение и взаимодействие тел. Подготовка к контрольной работе. 9 класс
Движение и взаимодействие тел. Подготовка к контрольной работе. 9 класс Работа по перемещению проводника с током в магнитном поле
Работа по перемещению проводника с током в магнитном поле Концепции современного естествознания. Фундаментальные неклассические модели (лекция 6)
Концепции современного естествознания. Фундаментальные неклассические модели (лекция 6) Система сил, моменты. Геометрический метод сложения сил, приложенных в одной точке
Система сил, моменты. Геометрический метод сложения сил, приложенных в одной точке Автоматтық жүйелер: негізгі анықтамалар, функционалдық схемалар. Ақпарат ұғымы, саны. Хабарлама
Автоматтық жүйелер: негізгі анықтамалар, функционалдық схемалар. Ақпарат ұғымы, саны. Хабарлама Виды спектров и спектральный анализ. Тема №48
Виды спектров и спектральный анализ. Тема №48 Вес тела. Связь между массой тела и силой тяжести
Вес тела. Связь между массой тела и силой тяжести Нагревание. Нагревание водяным паром
Нагревание. Нагревание водяным паром Курс лекций по теоретической механике. Динамика (I часть)
Курс лекций по теоретической механике. Динамика (I часть) Система сходящихся сил. Основные понятия статики
Система сходящихся сил. Основные понятия статики Методы определения скорости света
Методы определения скорости света Атомные спектры
Атомные спектры Агрегатные состояния вещества
Агрегатные состояния вещества Эксперимент на уроках физики в основной школе как средство формирования УУД
Эксперимент на уроках физики в основной школе как средство формирования УУД Разработка внеклассного мероприятия Физический КВН (8 класс)
Разработка внеклассного мероприятия Физический КВН (8 класс) Kosmicheskoe-izluchenie
Kosmicheskoe-izluchenie Квантовая физика
Квантовая физика Основы молекулярно-кинетической теории
Основы молекулярно-кинетической теории Агрегатные состояния вещества
Агрегатные состояния вещества Вечный двигатель
Вечный двигатель Структура и принципы интеграции МС
Структура и принципы интеграции МС Слесарь по КИП и А. Лекция 1
Слесарь по КИП и А. Лекция 1