Содержание
- 2. План Классификация физических и физико-химических методов анализа Классификация оптических методов анализа Законы светооглощения Рефрактометрия Электрохимия Потенциометрия
- 3. Классификация физических и физико-химических методов анализа: Оптические методы. Хроматографические методы. Электрохимические методы. Радиометрические методы. Термические методы.
- 4. Классификация оптических методов анализа: По изучаемым объектам: атомный и молекулярный спектральный анализ. По характеру взаимодействия электромагнитного
- 5. По области электромагнитного спектра. Спектроскопия (спектрофотометрия) в УВИ области спектра, т.е. в ближней ультрафиолетовой (УФ) области
- 6. Общие положения Длина волны λ - расстояние, проходимое волной за время одного полного колебания. Чаще измеряют
- 7. Закон Бугера-Ламберта (в 1729 г. - Бугер, в 1760 г. - Ламберт): однородные слои одного и
- 8. Закон Бера (1852 г.): оптическая плотность раствора прямопропорциональна концентрации растворенного вещества при постоянной толщине слоя ,
- 9. Объединенный закон Бугера-Ламберта-Бера: оптическая плотность прямопропорциональна концентрации растворенного вещества и толщине поглощающего слоя раствора. k -
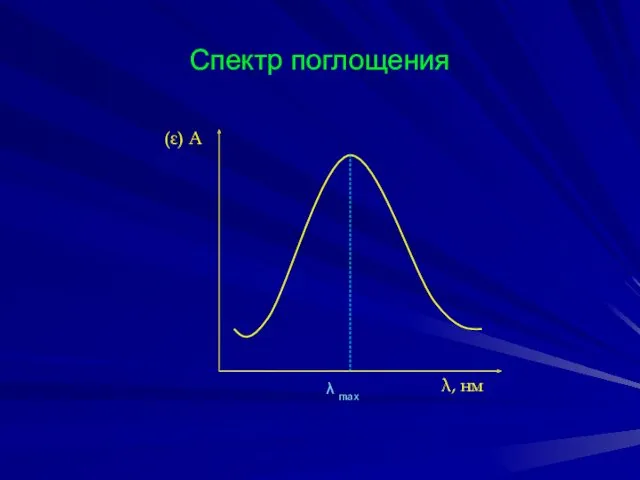
- 10. Спектр поглощения (ε) А λ, нм λ max
- 11. РЕФРАКТОМЕТРИЯ
- 12. При переходе света из оптически менее плотной среды (I) в среду с оптически большей плотностью (2)
- 13. Закон преломления Снеллиуса: отношение синусов углов падения sin α и преломления sin β – есть величина
- 14. Электрохимические методы анализа. Классификация методов. Потенциометрический анализ. Хроматографические методы анализа. Ионообменная хроматография.
- 15. Электрохимические методы анализа основаны на измерении электрохимичеких параметров электрохимических явлений, возникающих в исследуемом растворе.
- 16. Классификация электрохимических методов анализа Классификация, основанная на учете природы источника электрической энергии в системе. Методы без
- 17. Потенциометрия Потенциометрический анализ (потенциометрия) – основан на использовании зависимости разности электродных потенциалов от концентрации (активности) определяемого
- 18. Хроматография динамический сорбционный способ разделения смесей, основанный на распределении вещества между двумя фазами, одна из которых
- 19. Отличительной особенностью хроматографических методов является их универсальность, то есть возможность использования: — для очистки веществ; —
- 20. Хроматография позволяет одновременно производить идентификацию и количественное определение разделяемых компонентов смеси.
- 21. Ионообменная хроматография Основана на обратимом обмене содержащихся в растворе ионов на ионы, входящие в состав сорбента
- 22. Применение ионообменной хроматографии разделения электролитов очистки от примесей извлечения и концентрирования получения кислот, оснований, солей выделения
- 23. Литература Ю.А. Харитонов Аналитическая химия. Книга 2 Количественный анализ Ю.С. Ляликов Физико-химические методы анализа Основы аналитической
- 25. Скачать презентацию





















 Применение методов флуоресцентных зондов для исследования белковых комплексов
Применение методов флуоресцентных зондов для исследования белковых комплексов Уравнения теории упругости. Закон Гука для изотропного тела. Упругие постоянные. Объемная деформация. (Лекция 4)
Уравнения теории упругости. Закон Гука для изотропного тела. Упругие постоянные. Объемная деформация. (Лекция 4) Трение. Силы трения
Трение. Силы трения Бұрандалы конвейерлер. Түрлері және қолдану аймағы
Бұрандалы конвейерлер. Түрлері және қолдану аймағы Течение вязких жидкостей
Течение вязких жидкостей Презентация к уроку Ученые-физики
Презентация к уроку Ученые-физики Магнетизм. Характеристики магнитных полей
Магнетизм. Характеристики магнитных полей Дизельна електростанція
Дизельна електростанція Сборка неподвижных и неразъемных соединений деталей
Сборка неподвижных и неразъемных соединений деталей Stress analysis versus modes of fracture in composites
Stress analysis versus modes of fracture in composites Энергия. Закон сохранения энергии
Энергия. Закон сохранения энергии Атмосферное давление. Измерение атмосферного давления. 7 класс
Атмосферное давление. Измерение атмосферного давления. 7 класс Переоценка безопасности атомной энергетики
Переоценка безопасности атомной энергетики Организация технического обслуживания и ремонта автомобиля: MERCEDES-BENZ ACTROS 3332
Организация технического обслуживания и ремонта автомобиля: MERCEDES-BENZ ACTROS 3332 Methods of taper turning
Methods of taper turning Сварные соединения
Сварные соединения Принцип работы гибридной силовой установки
Принцип работы гибридной силовой установки Давление. Единицы давления. 7 класс
Давление. Единицы давления. 7 класс Машины постоянного тока. Устройство, материалы и принцип действия. Карточка 16
Машины постоянного тока. Устройство, материалы и принцип действия. Карточка 16 Презентация к уроку решения задач по физике Построение изображений в линзах 8 класс
Презентация к уроку решения задач по физике Построение изображений в линзах 8 класс Элементарные частицы
Элементарные частицы Взаємодія тіл. Імпульс. Розв'язування задач
Взаємодія тіл. Імпульс. Розв'язування задач ИК-спектроскопия. История возникновения
ИК-спектроскопия. История возникновения Радиационная безопасность. Взаимодействие ионизирующих излучений с веществом
Радиационная безопасность. Взаимодействие ионизирующих излучений с веществом Три состояния вещества
Три состояния вещества Физика в загадках и пословицах
Физика в загадках и пословицах Закон сохранения момента импульса системы материальных точек
Закон сохранения момента импульса системы материальных точек Аналитическая механика. Связи
Аналитическая механика. Связи