Содержание
- 2. Кирилл Игоревич Лохов СПбГУ, ИЦ ВСЕГЕИ Ольга Валентиновна Якубович СПбГУ, ИГГД РАН Валерий Михайлович Саватенков СПбГУ,
- 3. Приблизительный план занятий. 11 февр - введение. В.М. Саватенков. 18 февр - изотопная масспектрия К.И. Лохов
- 4. Литература 2006 1989 1986
- 5. Литература 2001 1993 2007
- 6. Литература 2010 2005
- 7. Литература 2008 2005
- 8. Литература 2015 2013
- 9. Литература 1987 1984
- 10. Литература 2006 2010
- 11. Литература 1983 2007
- 12. «лекции on-line» К.Куллеруда (перевод на русский) http://ansatte.uit.no/webgeology/
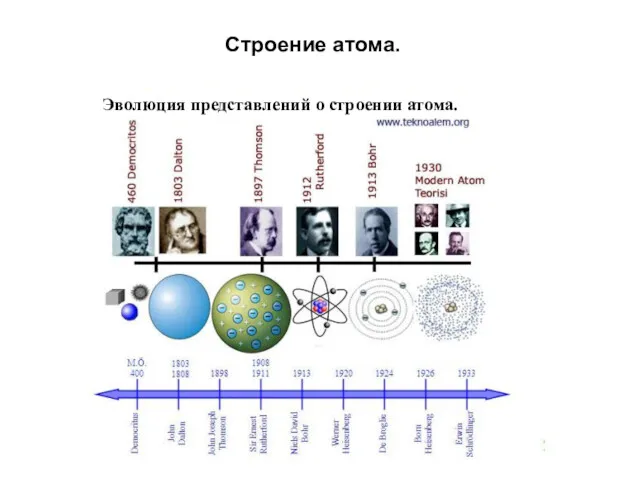
- 18. Строение атома. Эволюция представлений о строении атома.
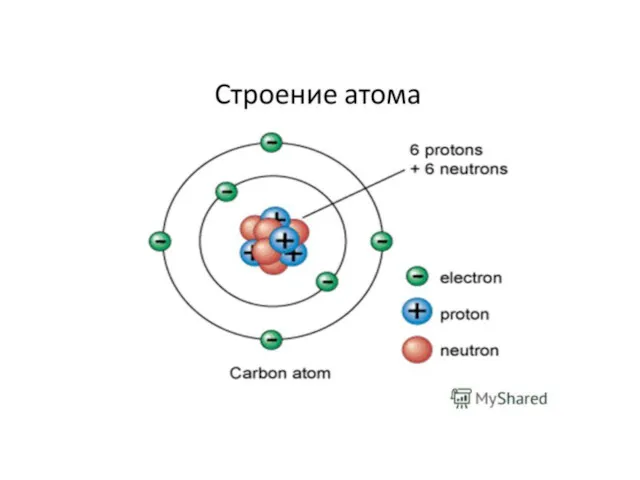
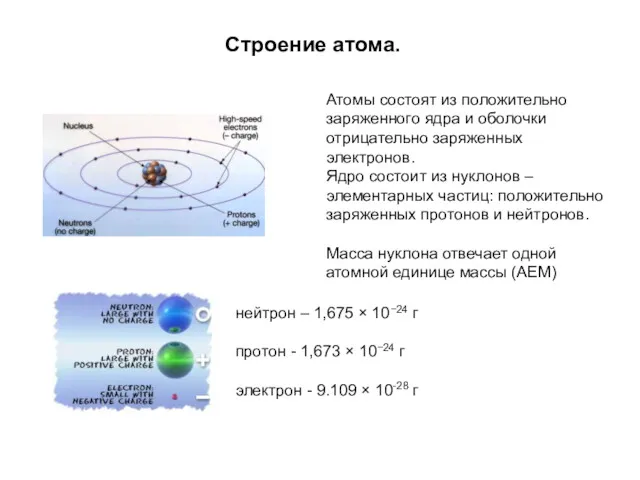
- 19. Строение атома. Атомы состоят из положительно заряженного ядра и оболочки отрицательно заряженных электронов. Ядро состоит из
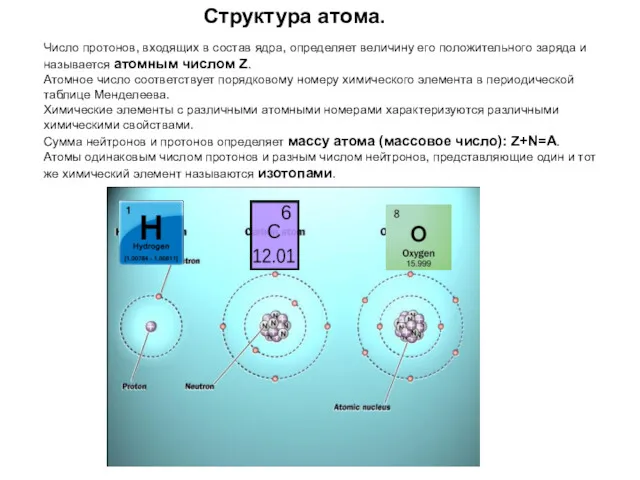
- 20. Структура атома. Число протонов, входящих в состав ядра, определяет величину его положительного заряда и называется атомным
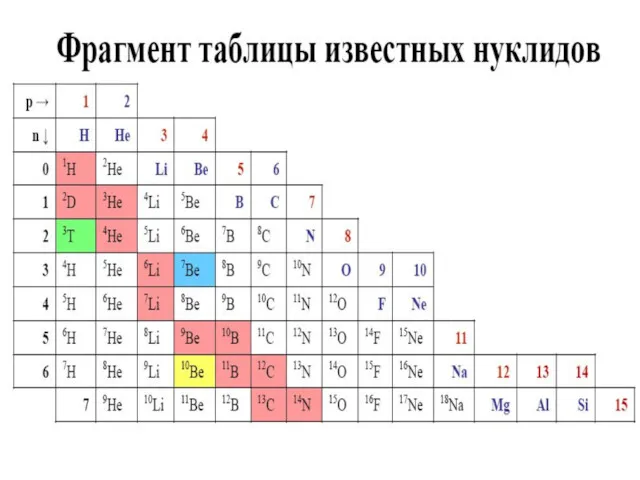
- 22. Изотопы – атомы с одним и тем же числом протонов Z, но с разным числом нейтронов
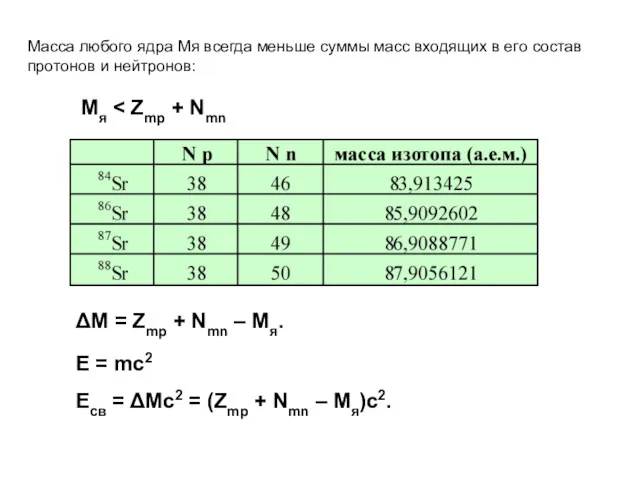
- 23. Масса любого ядра Mя всегда меньше суммы масс входящих в его состав протонов и нейтронов: Mя
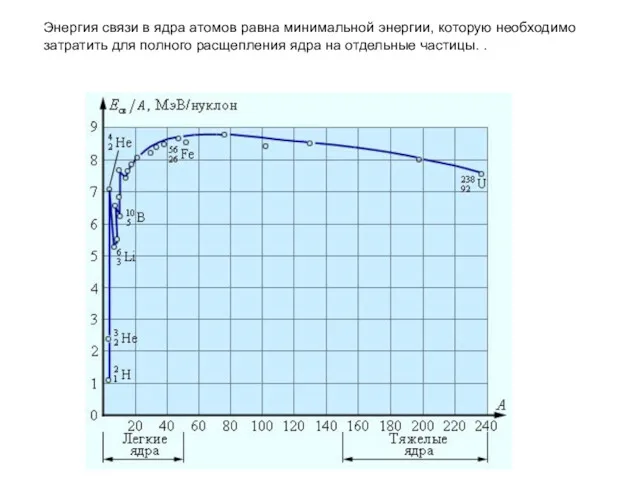
- 24. Энергия связи в ядра атомов равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на
- 25. Сейчас известно 276 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z
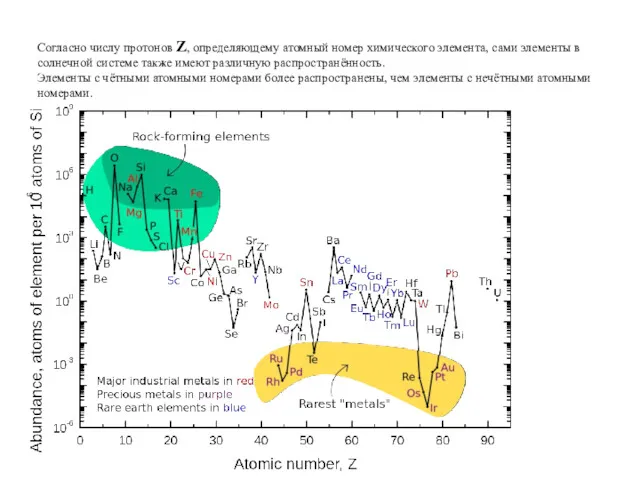
- 27. Согласно числу протонов Z, определяющему атомный номер химического элемента, сами элементы в солнечной системе также имеют
- 28. Вещество во Вселенной в основном состоит из водорода H – ~ 90% всех атомов. По распространенности
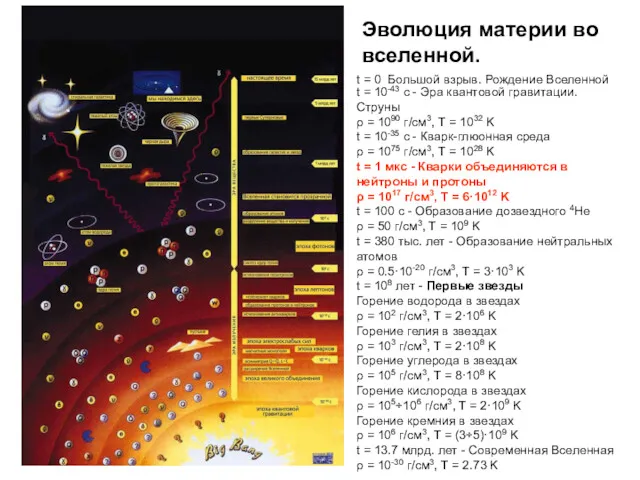
- 29. Эволюция материи во вселенной. t = 0 Большой взрыв. Рождение Вселенной t = 10-43 с -
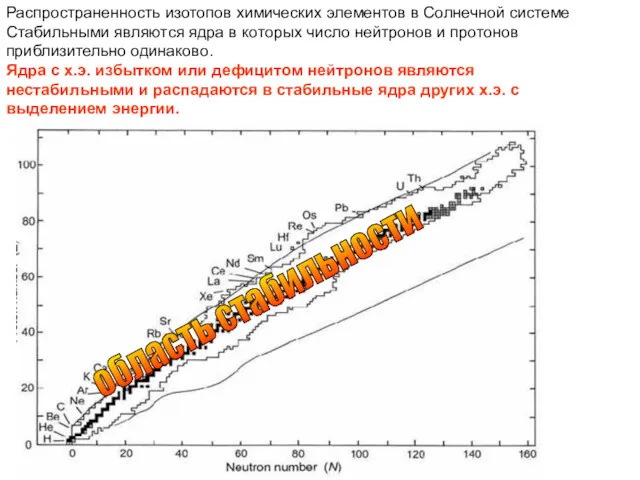
- 31. Распространенность изотопов химических элементов в Солнечной системе Стабильными являются ядра в которых число нейтронов и протонов
- 32. Стабильность ядер определяется балансом притягивающих ядерных сил между нуклонами: нейтронами (n) и протонами (р), и отталкивающих
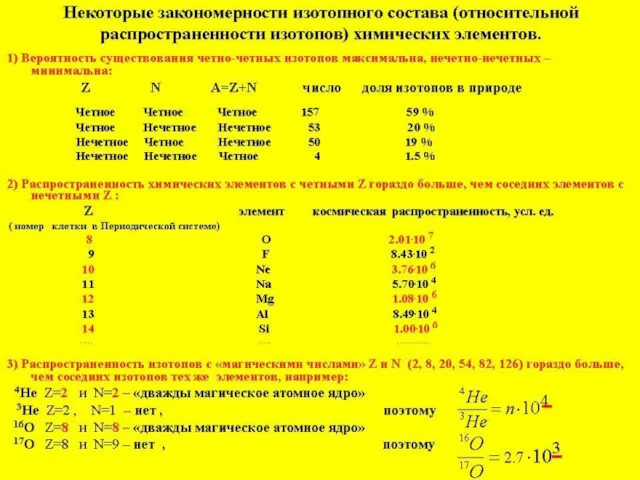
- 33. Наиболее стабильными и распространёнными являются атомы с чётным числом протонов и нейтронов, а также равным числом
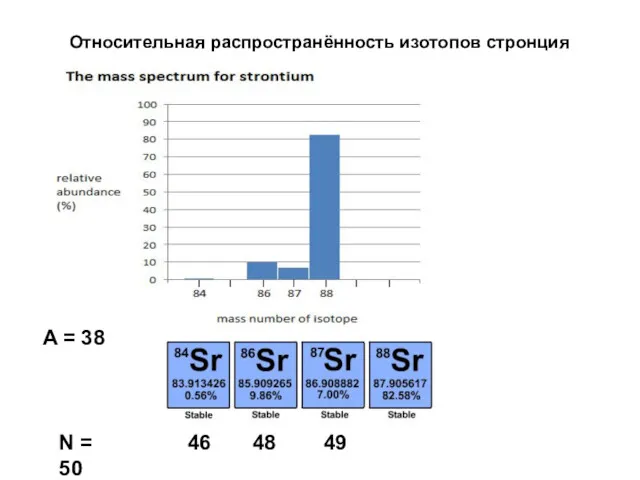
- 34. Относительная распространённость изотопов стронция A = 38 N = 46 48 49 50
- 35. Атомарная масса химического элемента MA Масса изотопа Mi Относительная распространённость изотопа Abi – доля количества изотопа
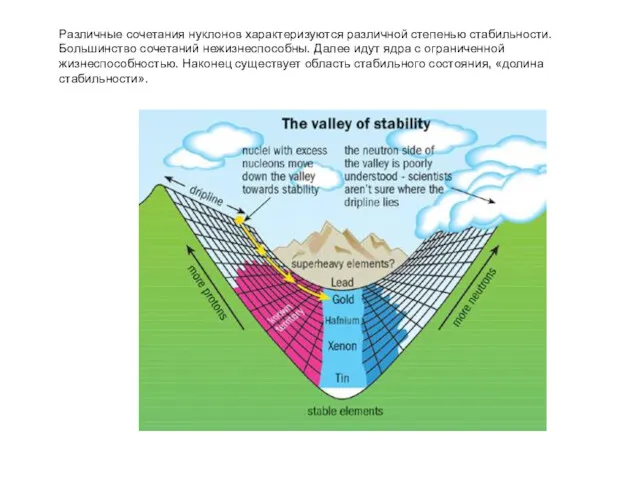
- 36. Различные сочетания нуклонов характеризуются различной степенью стабильности. Большинство сочетаний нежизнеспособны. Далее идут ядра с ограниченной жизнеспособностью.
- 37. Радиоактивный распад. дефицит нейтронов Захват электрона Позитронный распад избыток нейтронов Бета-минус распад Большие массы Альфа распад
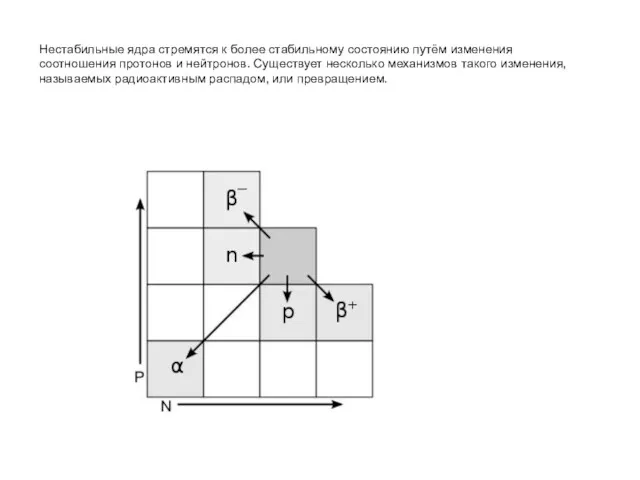
- 38. Нестабильные ядра стремятся к более стабильному состоянию путём изменения соотношения протонов и нейтронов. Существует несколько механизмов
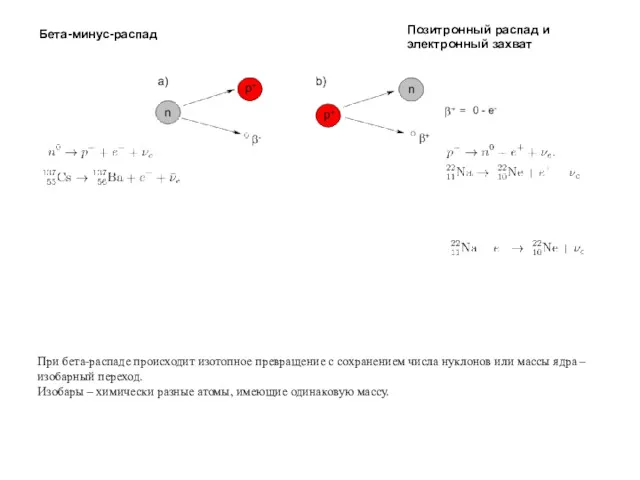
- 39. Бета-минус-распад Позитронный распад и электронный захват При бета-распаде происходит изотопное превращение с сохранением числа нуклонов или
- 40. Радиоактивный распад. дефицит нейтронов Захват электрона Позитронный распад избыток нейтронов Бета-минус распад Большие массы Альфа распад
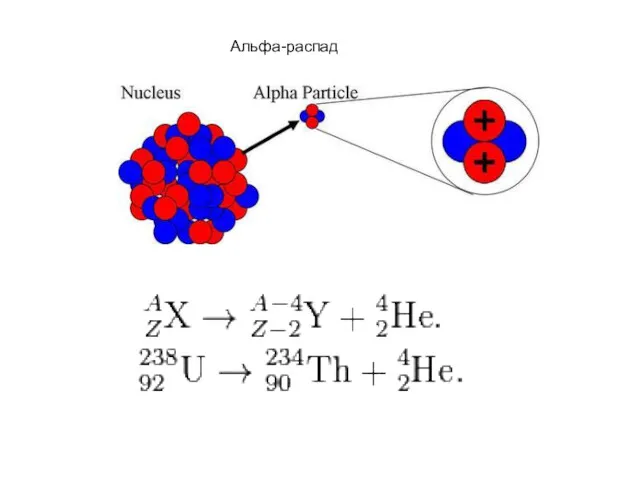
- 41. Альфа-распад
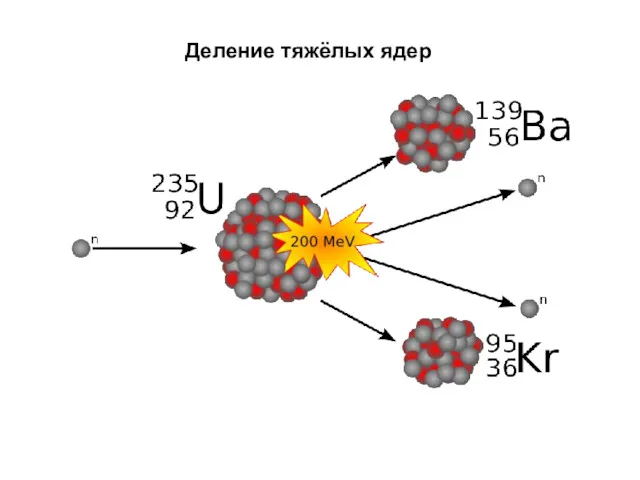
- 42. Деление тяжёлых ядер
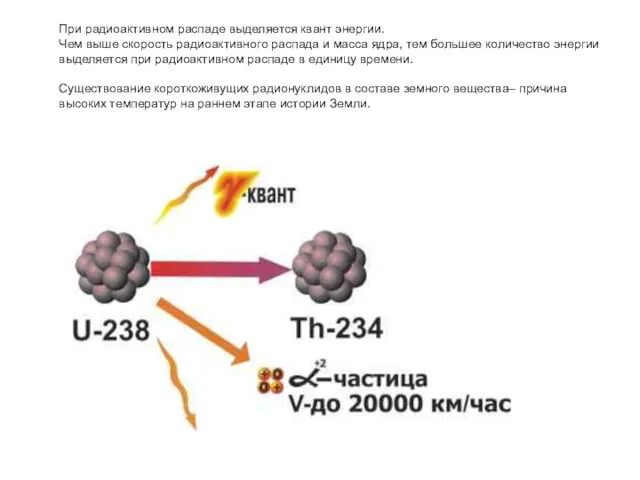
- 43. При радиоактивном распаде выделяется квант энергии. Чем выше скорость радиоактивного распада и масса ядра, тем большее
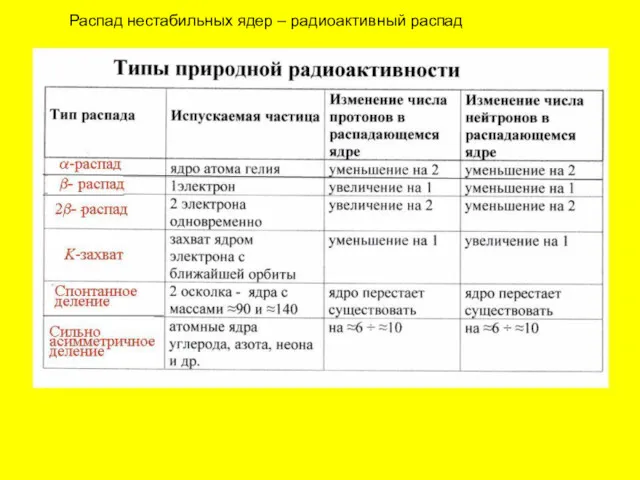
- 44. Распад нестабильных ядер – радиоактивный распад
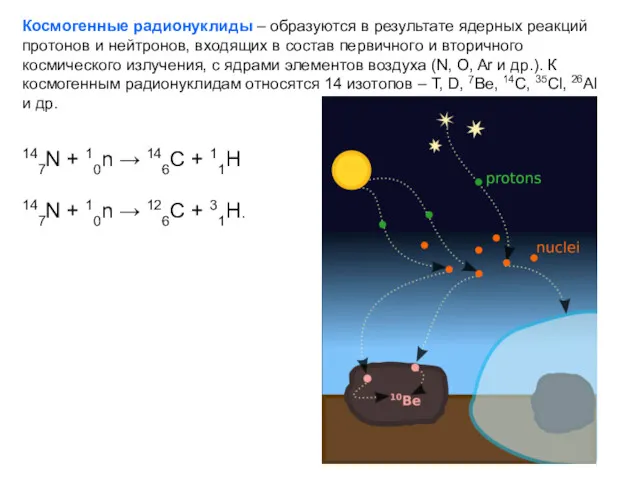
- 48. Космогенные радионуклиды – образуются в результате ядерных реакций протонов и нейтронов, входящих в состав первичного и
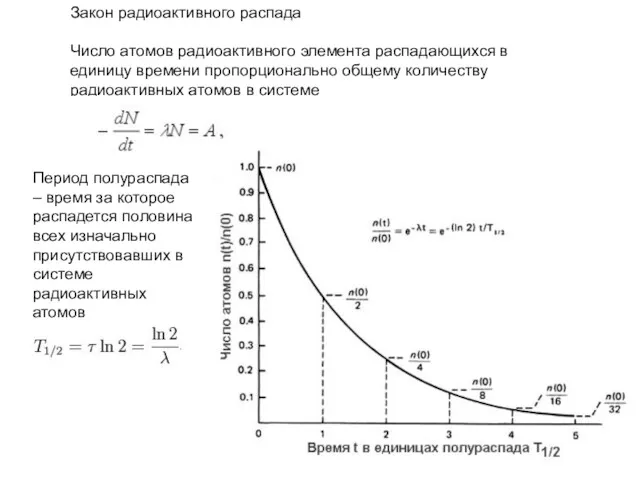
- 49. Закон радиоактивного распада Число атомов радиоактивного элемента распадающихся в единицу времени пропорционально общему количеству радиоактивных атомов
- 50. Период полураспада
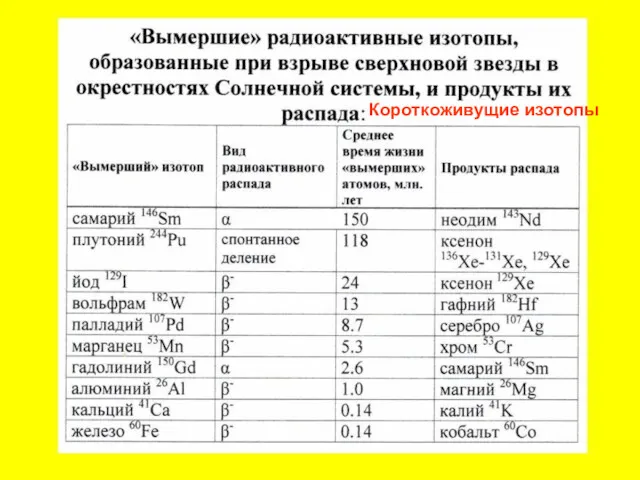
- 52. Короткоживущие изотопы
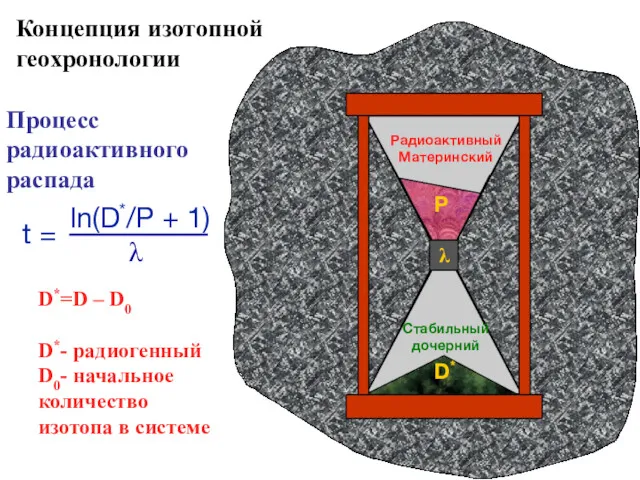
- 54. D*=D – D0 D*- радиогенный D0- начальное количество изотопа в системе Процесс радиоактивного распада Концепция изотопной
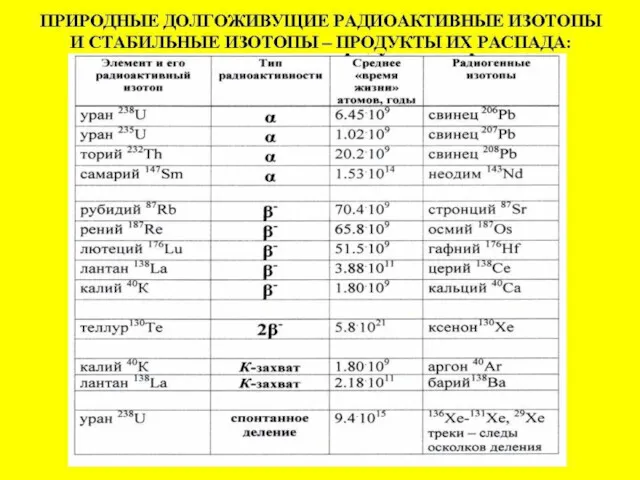
- 55. T ½ *109 лет 40K ? 40Ar 1.25 87Rb ? 87Sr 48.8 238U ? 206Pb 4.47
- 56. T 1/2 лет 3H ? 3He 12.43 10Be ? 10B 1.51 млн. 14C ? 14N 5730
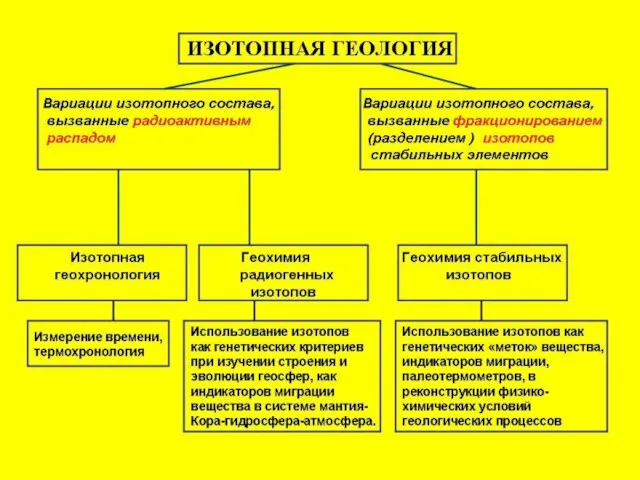
- 58. Изотопная система – физическая среда, имеющая реальные или условные границы, в пределах которых изотопный состав того
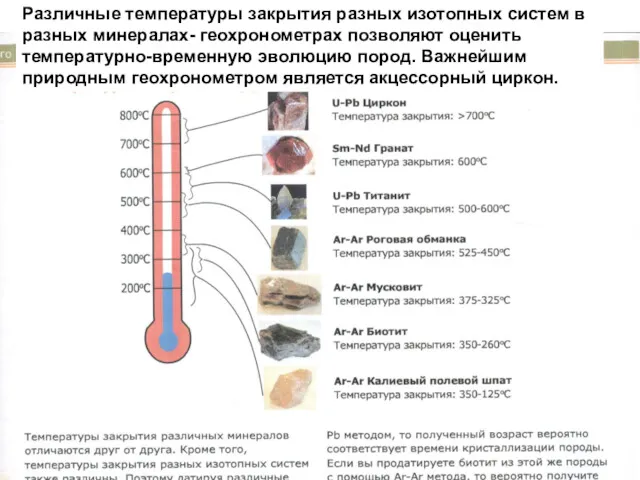
- 59. Различные температуры закрытия разных изотопных систем в разных минералах- геохронометрах позволяют оценить температурно-временную эволюцию пород. Важнейшим
- 61. Время в геологии - основные результаты изотопного датирования: образование Солнечной системы - 4600 млн.лет образование планет
- 63. Скачать презентацию


































 Альтернативные источники энергии
Альтернативные источники энергии Первый закон термодинамики
Первый закон термодинамики Элементы машиноведения. Машины
Элементы машиноведения. Машины Елементи теорії поля. (Лекція 10)
Елементи теорії поля. (Лекція 10) Графические физические задачи. Основные виды, этапы, решения
Графические физические задачи. Основные виды, этапы, решения Зубчатая передача
Зубчатая передача Простые механизмы в технике, в быту и в природе
Простые механизмы в технике, в быту и в природе Аспекти розвитку ядерної енергетики. Сучасний стан радіаційної безпеки України
Аспекти розвитку ядерної енергетики. Сучасний стан радіаційної безпеки України Соединения с натягом
Соединения с натягом Звуковая волна
Звуковая волна Обертальний рух в природі
Обертальний рух в природі Как был открыт закон Архимеда
Как был открыт закон Архимеда Техническое обслуживание и ремонт подвижного состава как определяющий фактор его технического состояния
Техническое обслуживание и ремонт подвижного состава как определяющий фактор его технического состояния Синтез нанокомпозитных материалов на основе субоксида кремния и наноструктур благородных металлов
Синтез нанокомпозитных материалов на основе субоксида кремния и наноструктур благородных металлов Электрическая цепь и ее составные части
Электрическая цепь и ее составные части Явления переноса в газах. (Лекция 3)
Явления переноса в газах. (Лекция 3) Законы Ньютона. Применение приёма переработки текста - пятистрочие.
Законы Ньютона. Применение приёма переработки текста - пятистрочие. Просечное железо
Просечное железо Техническое устройство в машиностроении или приборостроении
Техническое устройство в машиностроении или приборостроении Плоские электромагнитные волны. Устройство и параметры однородных линий передач
Плоские электромагнитные волны. Устройство и параметры однородных линий передач Исаак Ньютон
Исаак Ньютон Термометры сопротивления
Термометры сопротивления Компрессор холодильника
Компрессор холодильника Система охолодження TATA LPT EURO III
Система охолодження TATA LPT EURO III Ультразвуковой контроль
Ультразвуковой контроль Урок на тему: Звук ( 9 класс)
Урок на тему: Звук ( 9 класс)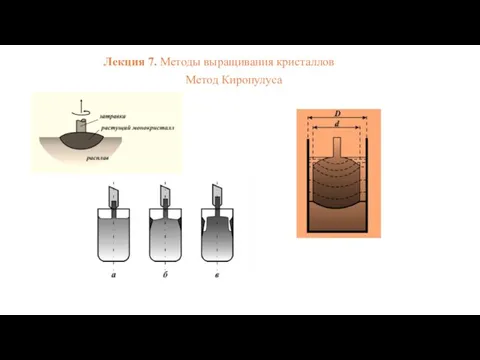 Методы выращивания кристаллов. Метод Киропулуса
Методы выращивания кристаллов. Метод Киропулуса Механика. Тема 1. Кинематика
Механика. Тема 1. Кинематика