Содержание
- 2. Вопросы к экзамену Механизмы диффузии. Основные уравнения модели связанной диффузии. Уравнения диффузии примесей, макроскопическое и микроскопическое
- 3. Теоретические основы процесса диффузии примесей Диффузия – физический процесс, обуславливающий миграцию атомов легирующих примесей в кристаллической
- 4. В кристаллической решетке кремния в растворенном состоянии могут находиться многие химические элементы. Растворенный элемент называется замещающим,
- 5. Многие химические элементы растворяются в кремнии как в междоузельном, так и в замещающем виде. Однако отношение
- 6. Механизмы диффузии Диффузия примесей нарушает упорядоченность решетки и представляет собой процесс, скоординированный с движением дефектов кристаллической
- 7. Механизмы диффузии В настоящее время считается, что точные представления о диффузии примеси в кристаллической решетке полупроводника
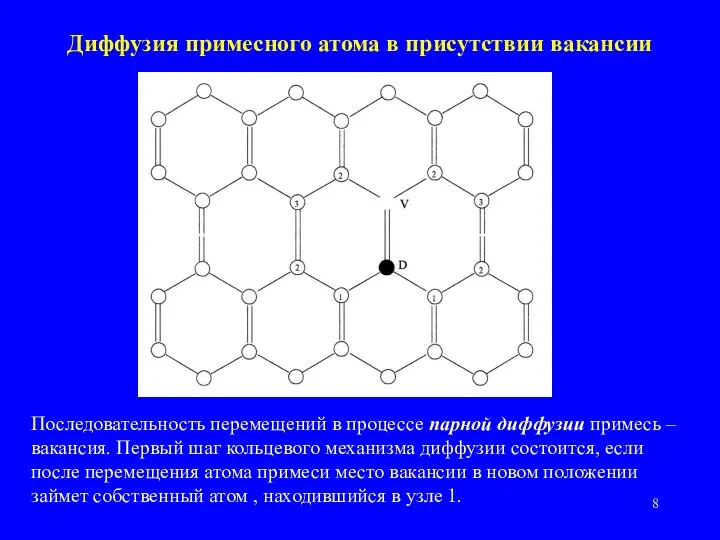
- 8. Диффузия примесного атома в присутствии вакансии Последовательность перемещений в процессе парной диффузии примесь – вакансия. Первый
- 9. Основные уравнения модели связанной диффузии Считается, что в процессе диффузии участвуют не только атомы примеси, но
- 10. Моделирование процесса диффузии с участием одной примеси Обозначим A – атом примеси, находящийся в узле решетки,
- 11. - образование/распад пар дефект – примесь с высвобождением/связыванием электронов 1) Ai + I j ↔ (AI)i+k
- 12. - взаимодействие пар дефект – примесь противоположного типа 6) (AI)i+j + (AV)l+k ↔ Ai + Al
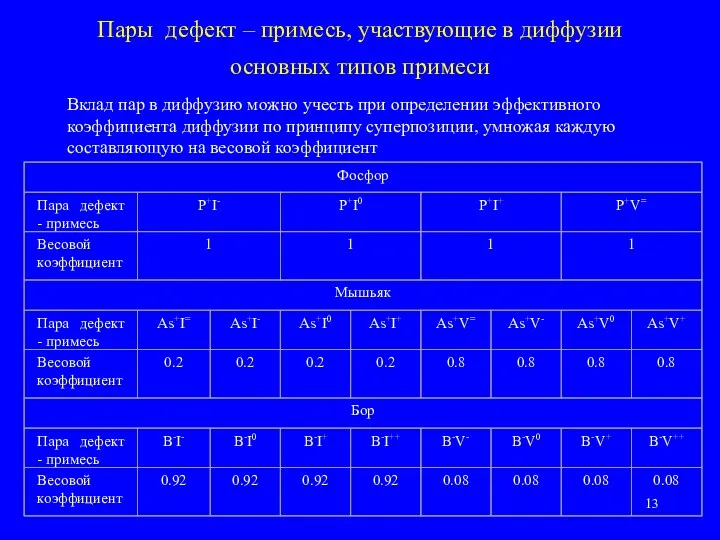
- 13. Пары дефект – примесь, участвующие в диффузии основных типов примеси Вклад пар в диффузию можно учесть
- 14. Уравнения диффузии Первый закон Фика поток примеси, D – коэффициент диффузии (в макроскопичесеком определении), N –
- 15. Уравнение непрерывности для процесса переноса примеси с учетом электрических полей имеет вид Учитывая, что Второй закон
- 16. Коэффициент диффузии В уравнения Фика коэффициент диффузии входит в макроскопическом определении. Для теоретического анализа микроскопических процессов
- 17. Температурная зависимость коэффициента диффузии описывается законом Аррениуса D = D0exp[-EA/kT], где EA- энергия активации, D0 –
- 18. Расчет коэффициента диффузии для моновакансионного механизма Микроскопическое определение служит основой для теоретической интерпретации коэффициента диффузии и
- 19. Равновесная концентрация нейтральных моновакансий в кристаллической решетке как термически равновесная концентрация собственных точечных дефектов, соответствующая минимуму
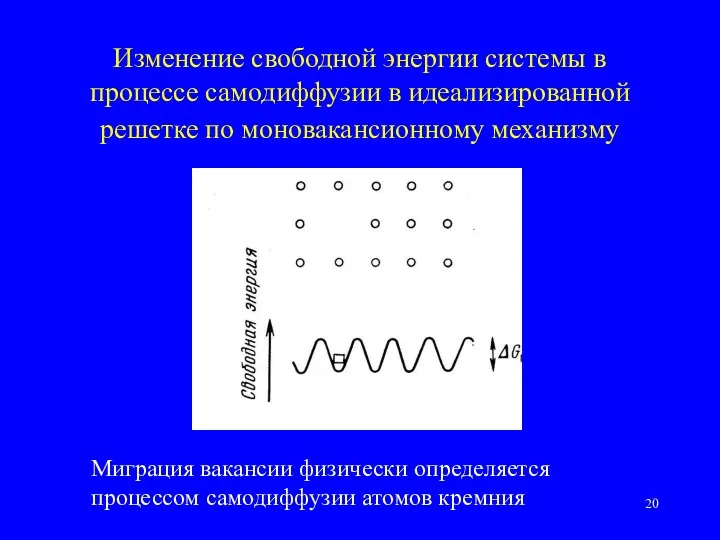
- 20. Изменение свободной энергии системы в процессе самодиффузии в идеализированной решетке по моновакансионному механизму Миграция вакансии физически
- 21. Расчет коэффициента самодиффузии Коэффициент самодиффузии зависит от вероятности успешных перескоков атома в вакансию через барьер ΔGm.
- 22. В решетке типа алмаза где m – масса диффундирующего атома, a – постоянная решетки Согласно микроскопическому
- 23. Коэффициент самодиффузии для рассматриваемого механизма равен Если использовать теоретические оценки для энтропии и энтальпии образования вакансии
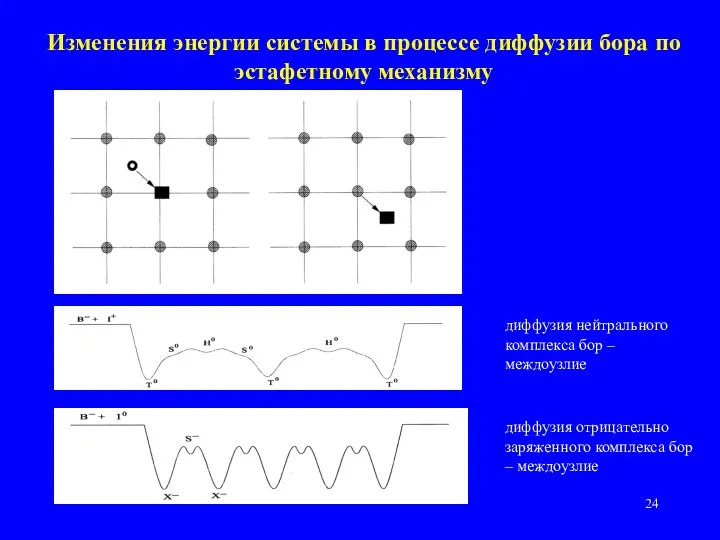
- 24. Изменения энергии системы в процессе диффузии бора по эстафетному механизму диффузия нейтрального комплекса бор – междоузлие
- 25. Коэффициент диффузии с учетом различных зарядовых состояний Экспериментальные исследования позволили идентифицировать в кремнии кроме нейтральных вакансий
- 26. В невырожденном кремнии энергия Ферми связана с концентрацией носителей соотношением n/ni = exp[(EF – Ei)/kT], где
- 27. В предположении независимой диффузии по вакансиям четырех типов коэффициент самодиффузии можно выразить в виде суперпозиции коэффициентов
- 28. Реакции, используемые при моделировании, можно представить в общем виде как aA+ bB ↔ pP+ qQ; стехеометрические
- 29. Каждое из 12 рассмотренных уравнений должно быть дополнено кинетическим уравнением. Например, для уравнений образования/распада пар дефект
- 30. Кинетическое уравнение для пар вакансия - примесь 2) Ai + V j ↔ (AV)i+k + (k
- 31. Для составления модели необходимо записать уравнение непрерывности для каждой составляющей процесса диффузии, а именно: 1) атомов
- 32. Пример: уравнение непрерывности для междоузлий, находящихся в зарядовом состоянии j - I j Междоузлия участвуют в
- 33. В модель необходимо включить также уравнение диффузии для каждой составляющей диффузионного процесса. Также необходимо добавить уравнение
- 35. Скачать презентацию













![Температурная зависимость коэффициента диффузии описывается законом Аррениуса D = D0exp[-EA/kT],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/320029/slide-16.jpg)














 Вес тела. Связь между массой тела и силой тяжести
Вес тела. Связь между массой тела и силой тяжести Спектральные характеристики одномерных и трехмерных жидкокристаллических фотонных кристаллов
Спектральные характеристики одномерных и трехмерных жидкокристаллических фотонных кристаллов Солнечные батареи
Солнечные батареи Раздел Электричество
Раздел Электричество Трехфазные цепи переменного синусоидального тока, практика
Трехфазные цепи переменного синусоидального тока, практика Виды ракетных двигателей и их использование при движении самолётов и запуске искусственных спутников земли
Виды ракетных двигателей и их использование при движении самолётов и запуске искусственных спутников земли Mechanics subline route location introduction
Mechanics subline route location introduction Формирование познавательного интереса на уроках физики ,с помощью современных образовательных технологий
Формирование познавательного интереса на уроках физики ,с помощью современных образовательных технологий Производственная практика. Техническое обслуживание и ремонт автомобильного транспорта
Производственная практика. Техническое обслуживание и ремонт автомобильного транспорта Конспект урока на тему: Плотность вещества 7 класс
Конспект урока на тему: Плотность вещества 7 класс Электрстанцияларының негізгі жабдығы. Жалпы мәліметтер
Электрстанцияларының негізгі жабдығы. Жалпы мәліметтер Дослідження оптичного волокнистого кабелю
Дослідження оптичного волокнистого кабелю Ремонт автомобилей. Техническое нормирование станочных работ. (Тема 5.2.1)
Ремонт автомобилей. Техническое нормирование станочных работ. (Тема 5.2.1) Измерение силы Архимеда
Измерение силы Архимеда Электрические явления, 9 класс
Электрические явления, 9 класс Кристаллофизика негіздері
Кристаллофизика негіздері Лазеры в физике, химии, биологии, медицине, экологии и технике
Лазеры в физике, химии, биологии, медицине, экологии и технике Передаточна функція систем автоматики. Стуктурно-динамічні схеми систем автоматики та їх перетворення. (Лекція 2)
Передаточна функція систем автоматики. Стуктурно-динамічні схеми систем автоматики та їх перетворення. (Лекція 2) Викторина Знаешь ли ты Ломоносова М.В.?
Викторина Знаешь ли ты Ломоносова М.В.? Скорость света
Скорость света Общие сведения об энергетических системах ВС. Тема №5. МиГ-29. Ми-8Т
Общие сведения об энергетических системах ВС. Тема №5. МиГ-29. Ми-8Т Игра – путешествие по теме Движение и взаимодействие тел
Игра – путешествие по теме Движение и взаимодействие тел Закон Архимеда
Закон Архимеда Теплотехника. Основы теплопередачи
Теплотехника. Основы теплопередачи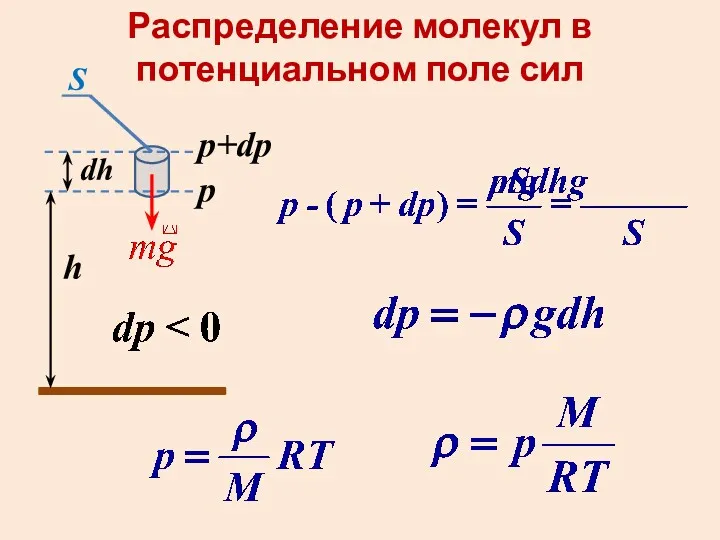 Распределение молекул в потенциальном поле сил
Распределение молекул в потенциальном поле сил Гидромеханические процессы
Гидромеханические процессы Презентация по физике 8 класс Зависимость силы тока от напряжения. Электрическое сопротивление
Презентация по физике 8 класс Зависимость силы тока от напряжения. Электрическое сопротивление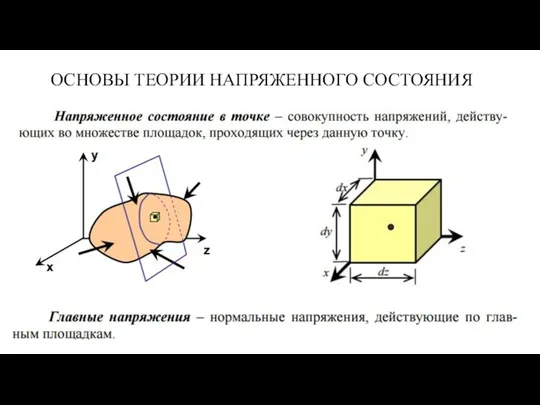 Основы теории напряженного состояния
Основы теории напряженного состояния