Содержание
- 2. Вопросы для повторения В чем заключается открытие, сделанное Беккерелем в 1896 году? Как стали называть способность
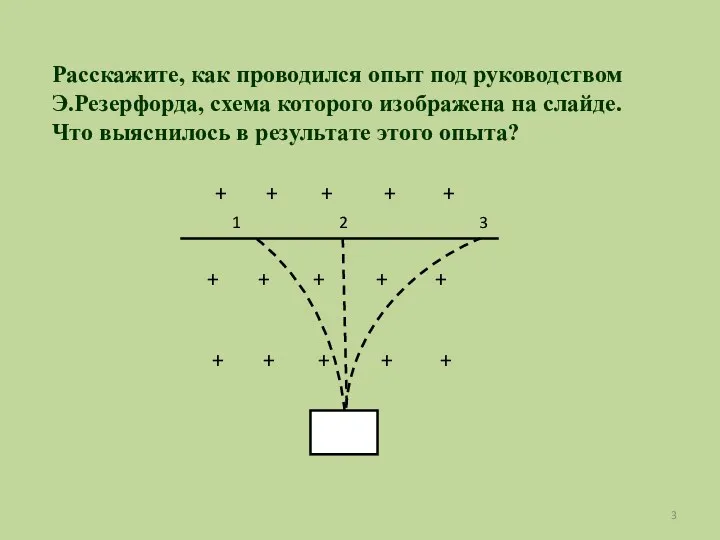
- 3. Расскажите, как проводился опыт под руководством Э.Резерфорда, схема которого изображена на слайде. Что выяснилось в результате
- 4. Демокрит: «Свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. У
- 5. В первой атомной теории Дальтона предполагалось, что мир состоит из определенного числа атомов — элементарных кирпичиков
- 6. Модель «пустого» атома Немецкий физик Филипп Ленард в 1903 году предложил модель «пустого» атома, внутри которого
- 7. Модель атома Томсона – модель «Пудинг с изюмом», англ. Plum pudding model 1903 г. - Дж.Дж.Томсон
- 8. Сэр Джозеф Джон Томсон Директор знаменитой Кавендишской лаборатории. В 1882 г. удостоен премии Адамса за сочинение
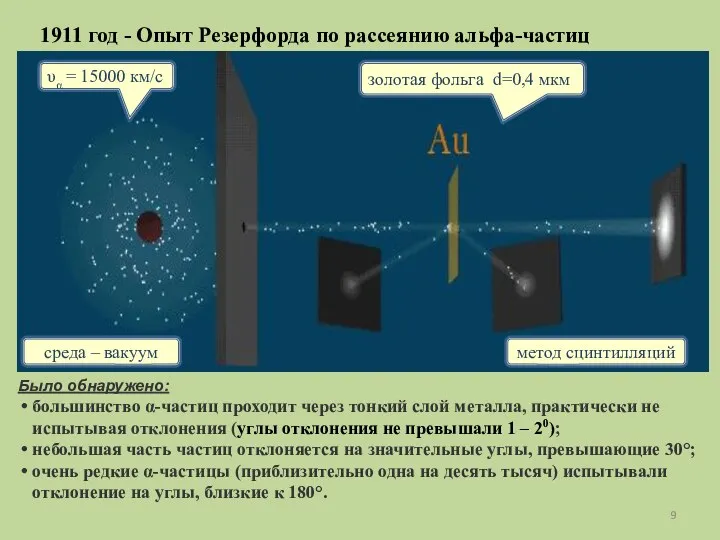
- 9. 1911 год - Опыт Резерфорда по рассеянию альфа-частиц Было обнаружено: большинство α-частиц проходит через тонкий слой
- 10. Выводы: mα >me примерно в 8000 раз → электроны не могут изменить направление движения α-частиц; отклонение
- 11. Эрнест Резерфорд 1871—1937 В 1908 году Резерфорду была присуждена Нобелевская премия по химии «за проведенные им
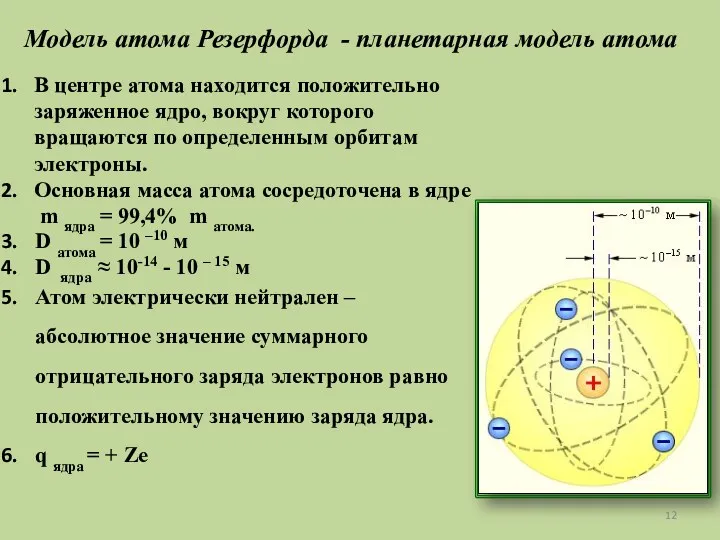
- 12. Модель атома Резерфорда - планетарная модель атома В центре атома находится положительно заряженное ядро, вокруг которого
- 13. Определите на каком рисунке показана модель атома Томсона?
- 14. II. Установите соответствие: Планетарную модель атома предложил… В этой модели атом представляет собой … Радиус атома
- 15. III. Установит соответствие: Исследование структуры атома было проведено … Ученый бомбардировал атомы … Заряд этих частиц
- 16. IV. Установит соответствие: Наличие небольшого числа альфа-частиц, отклоняющихся на углы, превышающие 900 , позволило Э. Резерфорду
- 17. Домашнее задание: § 56 Подготовить сообщения-презентации по теме: «Открытие протона»; «Открытие нейтрона».
- 19. Скачать презентацию













 Презентация Дисперсия. Дифракция и интерференция света
Презентация Дисперсия. Дифракция и интерференция света Основы радиопередачи и радиоприема
Основы радиопередачи и радиоприема Ядерная модель атома. Квантовые постулаты Бора
Ядерная модель атома. Квантовые постулаты Бора Методическая разработка урока по теме Закон Ома для участка цепи
Методическая разработка урока по теме Закон Ома для участка цепи Контактные явления. Контакт металл - полупроводник
Контактные явления. Контакт металл - полупроводник Основные положения молекулярно-кинетической теории и их опытные подтверждения
Основные положения молекулярно-кинетической теории и их опытные подтверждения Телефонная связь
Телефонная связь Интерференция, дифракция, поляризация
Интерференция, дифракция, поляризация Rotordynamics
Rotordynamics Problem № 2 “Aerosol”
Problem № 2 “Aerosol” Механическое оборудование электровоза ВЛ-80с
Механическое оборудование электровоза ВЛ-80с Семинарское занятие по теме основы электростатики, 10 класс
Семинарское занятие по теме основы электростатики, 10 класс Electrical group
Electrical group Разработка плана мероприятий по подготовке обучающихся к сдаче учебного предмета физика
Разработка плана мероприятий по подготовке обучающихся к сдаче учебного предмета физика Динамика материальной точки. Законы Ньютона
Динамика материальной точки. Законы Ньютона Биологическое действие радиоактивных излучений
Биологическое действие радиоактивных излучений Зарождения ракетных двигателей
Зарождения ракетных двигателей Криволинейное движение
Криволинейное движение Отклонения формы и взаимного расположения поверхностей
Отклонения формы и взаимного расположения поверхностей Законы фотоэффекта
Законы фотоэффекта Сообщающиеся сосуды
Сообщающиеся сосуды Техническое обслуживание и текущий ремонт переднего моста и рулевого управления автомобиля
Техническое обслуживание и текущий ремонт переднего моста и рулевого управления автомобиля Теория подобия и моделирования
Теория подобия и моделирования 135 лет со дня рождения Иоффе Абрама Федоровича.
135 лет со дня рождения Иоффе Абрама Федоровича. Компас. Виды. История открытия
Компас. Виды. История открытия Насоси. Загальна характеристика насосів
Насоси. Загальна характеристика насосів Давление. Единицы давления
Давление. Единицы давления Второе начало термодинамики. Циклические процессы и энтропия
Второе начало термодинамики. Циклические процессы и энтропия