Содержание
- 2. 1. Энтропия как функция состояния. Ее свойства. Отношение количества теплоты , переданного системе при любом элементарном
- 3. Энтропией системы S называется функция состояния, полный дифференциал которой при обратимых процессах равен приведенному количеству теплоты
- 4. 3) Энтропия определяется с точностью до произвольной постоянной, как и внутренняя энергия. Т.е. начало ее отсчета
- 5. Из (1) следует, что первое начало термодинамики для обратимых процессов через энтропию можно записать так:
- 6. 2. Второе начало термодинамики. (закон возрастания энтропии) Система в т.-д. считается замкнутой, если через ее границы
- 7. Пример необратимого процесса Покажем, что в замкнутой системе в процессе теплообмена между двумя телами с разными
- 8. 3. Статистический смысл энтропии и 2-го начала термодинамики. Одному макросостоянию системы (оно определяется набором макропараметров p,V,T)
- 9. Рассмотрим несколько соображений. 1) Энтропия механического движения. Если движение тела или системы абсолютно упорядочено, как например
- 10. 3) Изменение энтропии является количественной мерой необратимости процесса. Система всегда стремится перейти в равновесное состояние и
- 11. 4. Тепловые машины. Коэффициент полезного действия. Тепловая машина –циклически действующий двигатель, превращающий энергию сгорания топлива в
- 12. Для выполнения последнего условия р.т. должно в ходе расширения принимать тепло (обозначим его Q1 ), а
- 13. Следствие о невозможности создания вечного двигателя 2-го рода: Невозможно создать периодически действующий двигатель, который все получаемое
- 14. 5. Цикл Карно. Теорема Карно Т.о. у любой тепловой машины Рассмотрим наиболее экономичную тепловую машину, у
- 15. Т. о. единственным обратимым процессом, сопровождаемым теплообменом с нагревателем, является изотермический процесс, протекающий при постоянной температуре
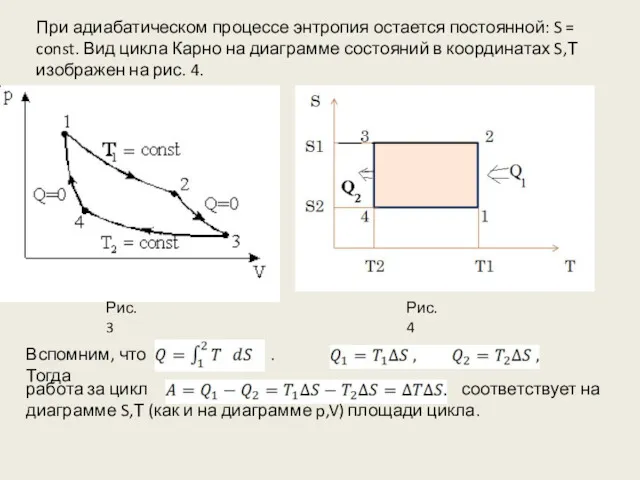
- 16. При адиабатическом процессе энтропия остается постоянной: S = const. Вид цикла Карно на диаграмме состояний в
- 18. Скачать презентацию













 Законы Кирхгофа
Законы Кирхгофа Электродинамика, обобщение темы
Электродинамика, обобщение темы US4/ Обновление ПО ГУ
US4/ Обновление ПО ГУ Плавание тел. Урок в физики в 7 классе с применением когнитивной технологии
Плавание тел. Урок в физики в 7 классе с применением когнитивной технологии Численный расчёт температурных полей на поверхности макета моноблока дивертора ИТЭР при высоких тепловых нагрузках
Численный расчёт температурных полей на поверхности макета моноблока дивертора ИТЭР при высоких тепловых нагрузках Подшипники качения
Подшипники качения Элементы трансмиссии в автомобилях
Элементы трансмиссии в автомобилях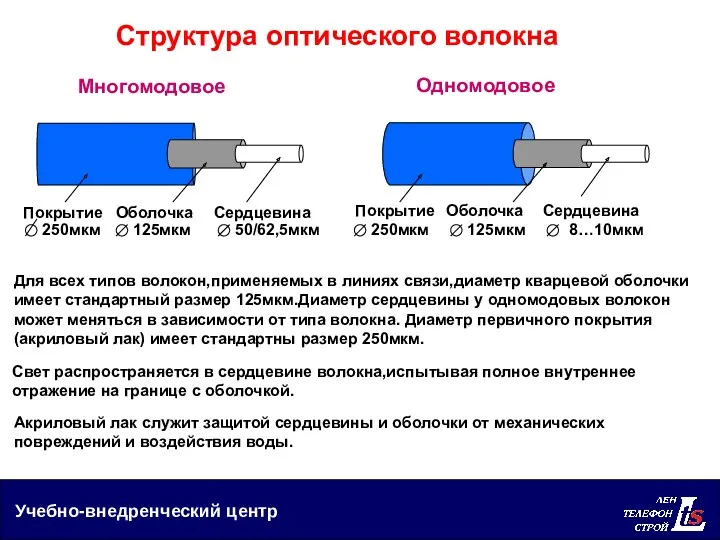 Структура оптического волокна
Структура оптического волокна Електрика: промислова, статична і атмосферна
Електрика: промислова, статична і атмосферна Презентация по Физики 7 класс На тему Механическая работа и мощность.
Презентация по Физики 7 класс На тему Механическая работа и мощность. Магнитные свойства аморфных микропроводов с положительной магнитострикцией
Магнитные свойства аморфных микропроводов с положительной магнитострикцией Требования к элементам дороги в продольном и поперечном профилях. Нормирование продольных уклонов
Требования к элементам дороги в продольном и поперечном профилях. Нормирование продольных уклонов Холодильні машини
Холодильні машини Сила. Явление тяготения. Сила тяжести
Сила. Явление тяготения. Сила тяжести Айналмалы бірқалыпты қозғалыс
Айналмалы бірқалыпты қозғалыс Тепловозные дизели
Тепловозные дизели Швидкість руху тіла
Швидкість руху тіла Схемы электрических соединений на стороне 6-10 кВ. (Лекция 12)
Схемы электрических соединений на стороне 6-10 кВ. (Лекция 12)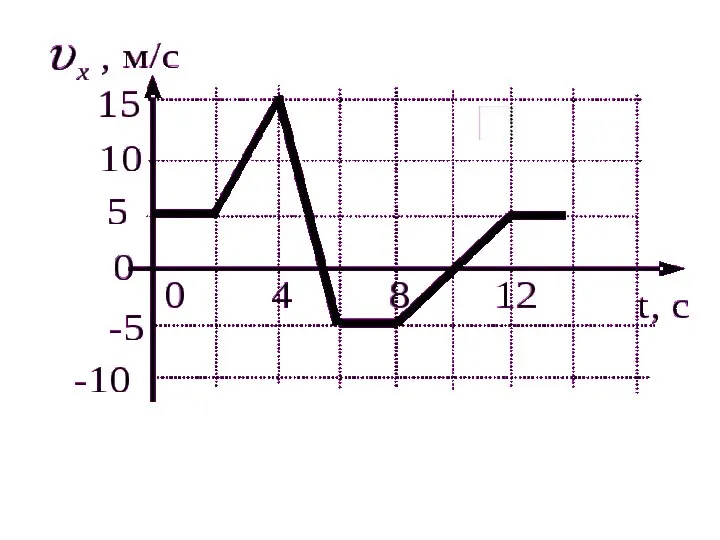 Сложение скоростей
Сложение скоростей Геометрическая оптика. Законы распространения света
Геометрическая оптика. Законы распространения света Експлуатація навчального вертольота. Експлуатація трансмісії
Експлуатація навчального вертольота. Експлуатація трансмісії Тема урока. Индукция магнитного поля.8 класс
Тема урока. Индукция магнитного поля.8 класс Конспект урока. Сила упругости. Закон Гука
Конспект урока. Сила упругости. Закон Гука Ядерная и термоядерная энергетика
Ядерная и термоядерная энергетика Поляризация света
Поляризация света презентация Векторы.Действия над векторами.Проекция вектора
презентация Векторы.Действия над векторами.Проекция вектора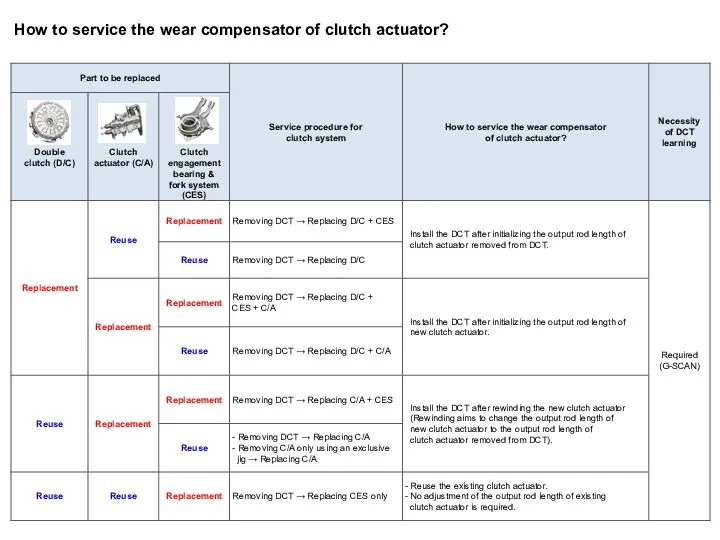 How to service the wear compensator of clutch actuator
How to service the wear compensator of clutch actuator Изменение энергии нейтронов при рассеянии. Замедляющая способность вещества
Изменение энергии нейтронов при рассеянии. Замедляющая способность вещества