Содержание
- 2. Тема 1. Модели атомов. Атом водорода по теории Бора. 1.1. Закономерности в атомных спектрах. 1.2. Ядерная
- 4. Концепция атомизма 1.Дихотомия Демокрита
- 5. ? Легенда о яблоке
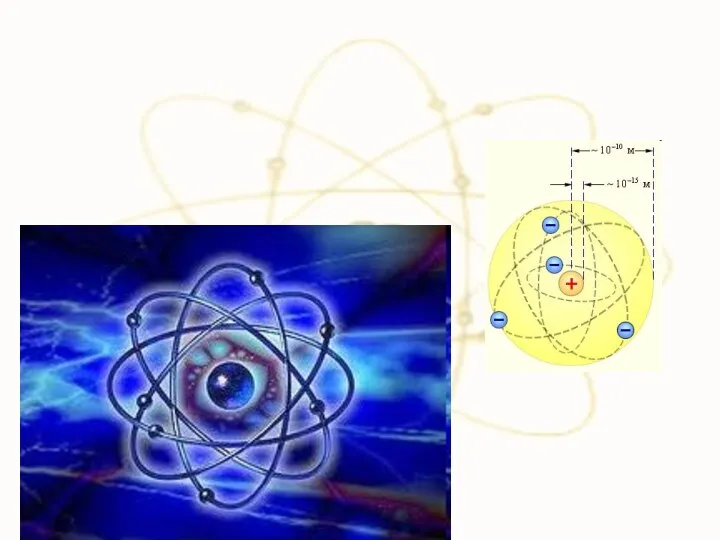
- 6. 1.1. Закономерности в атомных спектрах. х Итак, что же такое атом? Изолированные атомы в виде разреженного
- 8. Линейчатые спектры излучения в видимой области: водород, ртуть, неон. Спектр поглощения водорода. Дискретность, квантованность спектров излучения
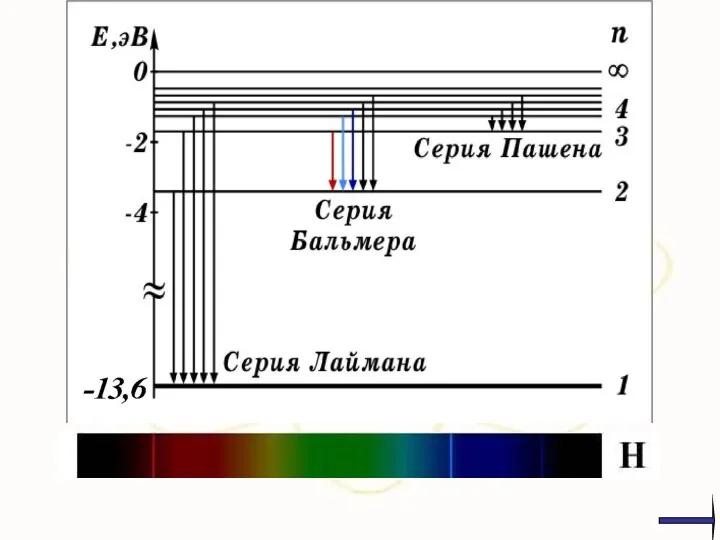
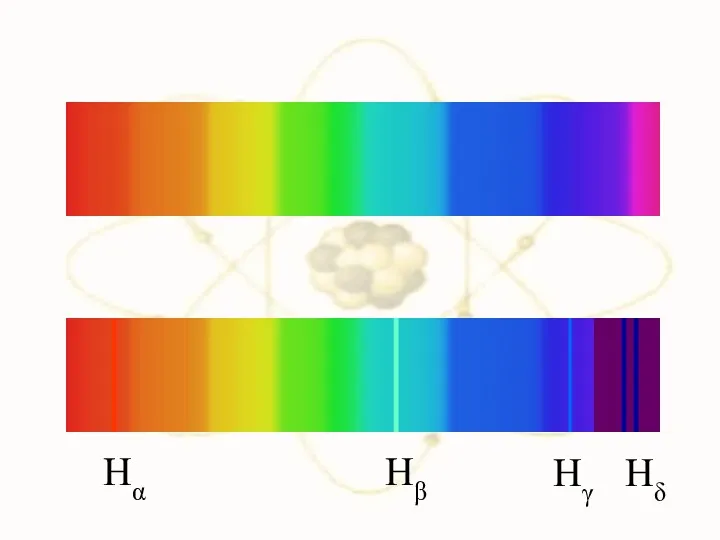
- 9. Швейцарский физик Й. Бальмер в 1885 году установил, что длины волн серии в видимой части спектра
- 10. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий: х
- 11. Обобщенная формула Й. Бальмера где k = 1, 2, 3,…, n = k + 1, k
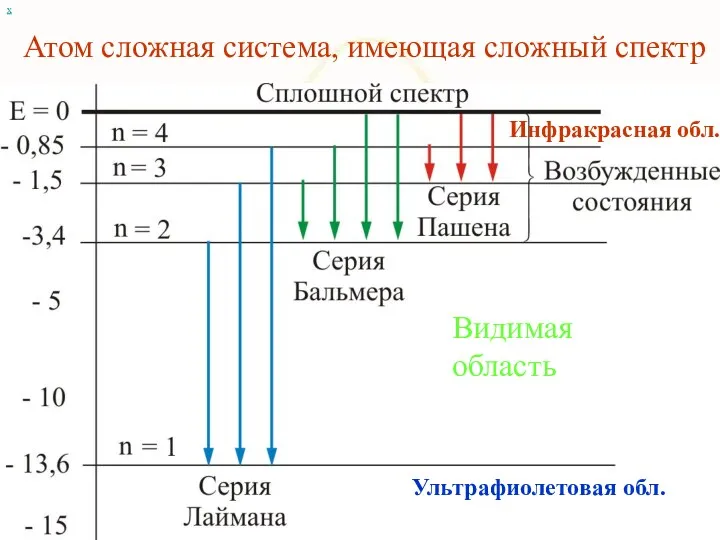
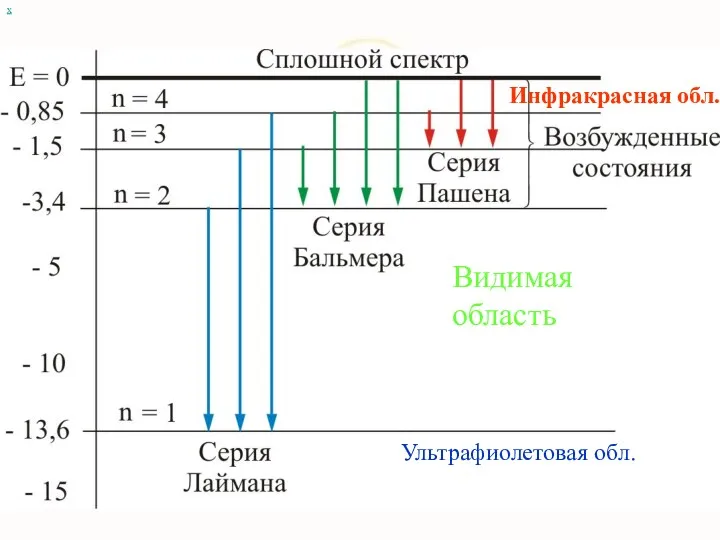
- 12. Атом сложная система, имеющая сложный спектр х Видимая область Инфракрасная обл. Ультрафиолетовая обл.
- 13. В то время учеными рассматривались многие модели атомов Рисунок 1.2
- 14. «То, что внизу, подобно тому, что вверху»
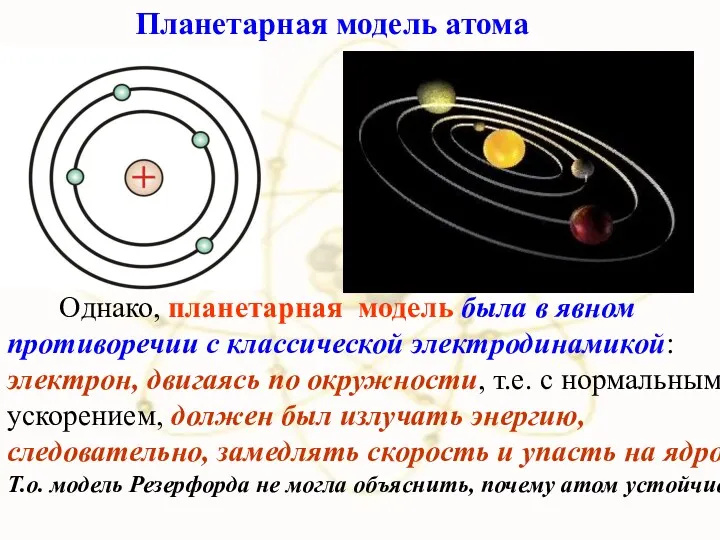
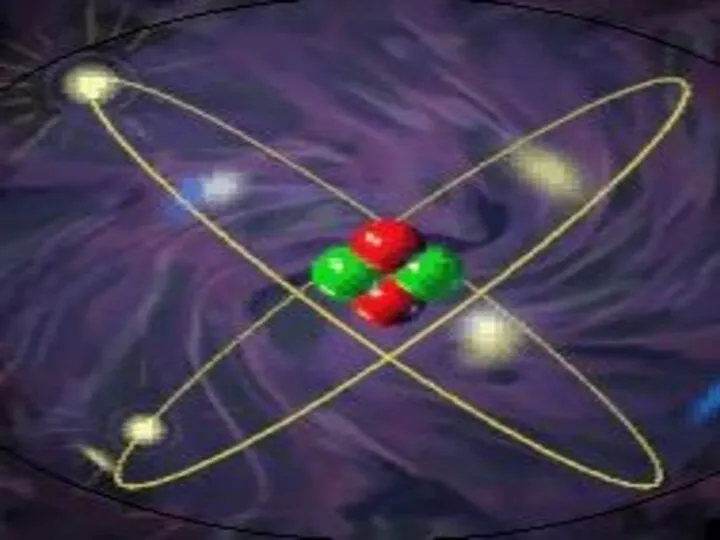
- 15. Планетарная модель строения атома
- 16. Конец ХIХ - - начало ХХ века
- 17. Закон постоянства состава соединений Лавуазье (1743-1794) Открытие атомов в химии
- 19. Интерпретация Дальтона: имеются определенные минимальные количества элементов и веществ (соединений)
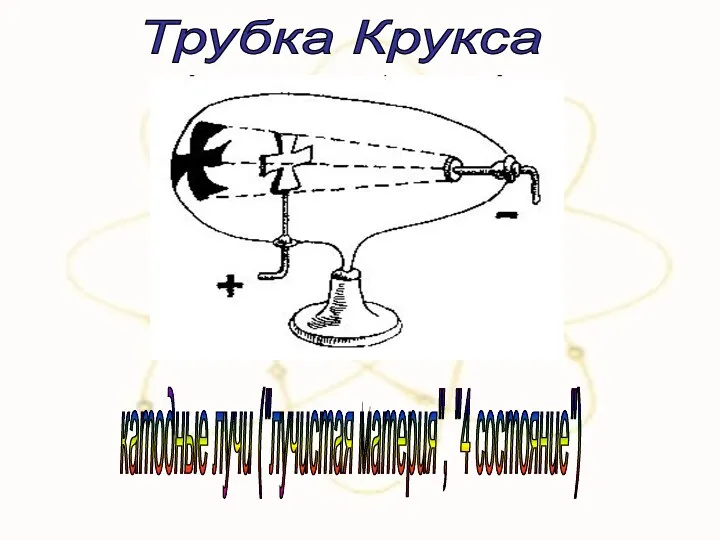
- 20. Проблема внутреннего строения атома Открытие электрона Исследование тока в разреженных газах
- 21. Трубка Крукса катодные лучи ("лучистая материя", "4 состояние")
- 22. 3- свойства К-лучей не зависят от типа газа 1 - отклоняются в магнитном поле 2 -
- 23. К-лучи - это поток отрицательно заряженных частиц вещества. ВЫВОДЫ:
- 24. Дж.Дж.Томсон в 1897 году определил величину отношения "заряд"/"масса" для этих частиц.
- 25. В состав всех атомов входят частицы малой массы - э л е к т р о
- 26. 1895- открытие Х-лучей Рентгеном 1896- открытие радиоактивности Беккерелем
- 27. 1896 - основание ТПУ! 1897 - открытие электрона
- 28. Физики «отобрали» атом у химиков
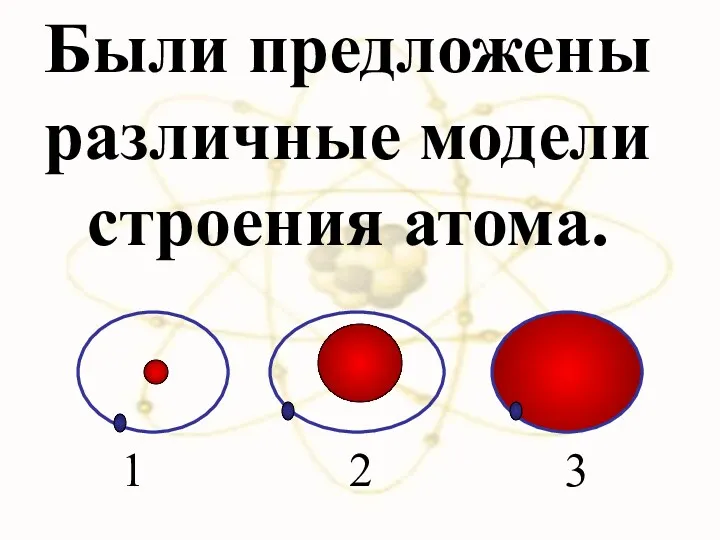
- 29. Были предложены различные модели строения атома. 1 2 3
- 31. «То, что находится внизу, подобно тому, что находится вверху» Гермес Тримегист (древний Египет)
- 32. Модель Ж. Перрена (1901)
- 33. Модель Х. Нагаока (1904)
- 34. х В 1903 году Дж. Дж. Томсон, предложил модель атома: сфера, равномерно заполненная положительным электричеством, внутри
- 35. Модель Дж.Дж Томсона (1904)
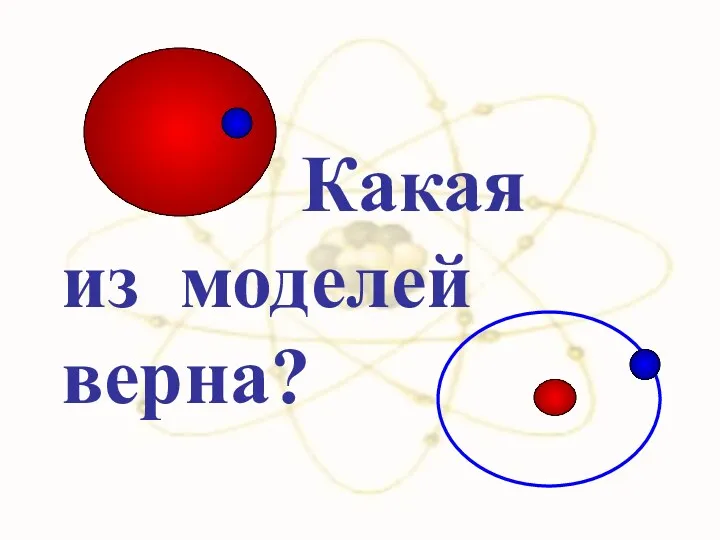
- 36. Какая из моделей верна?
- 37. Планетарная модель строения атома
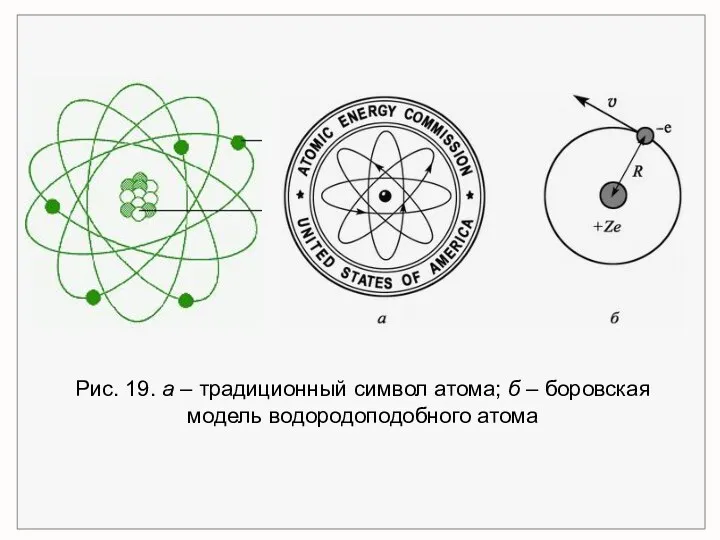
- 38. Рис. 19. а – традиционный символ атома; б – боровская модель водородоподобного атома
- 39. Своими фундаментальными открытиями в этих областях заложил основы современного учения о радиоактивности и теории строения атома.
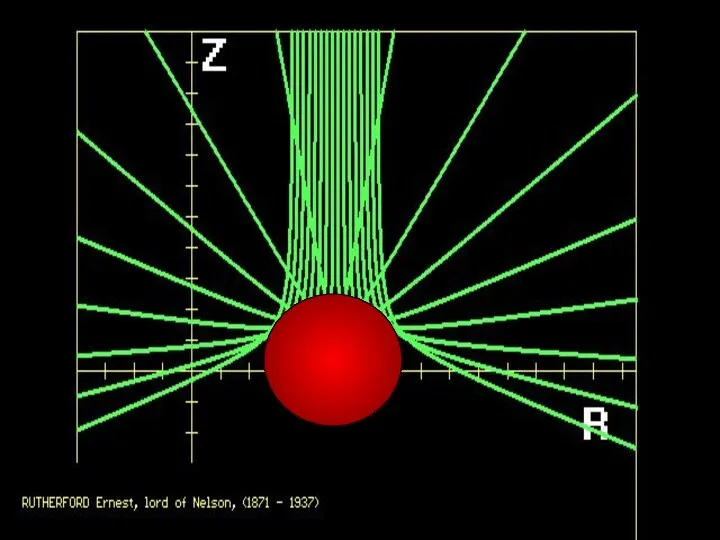
- 40. RUTHERFORD Ernest, Lord of NELSON (1871-1937)
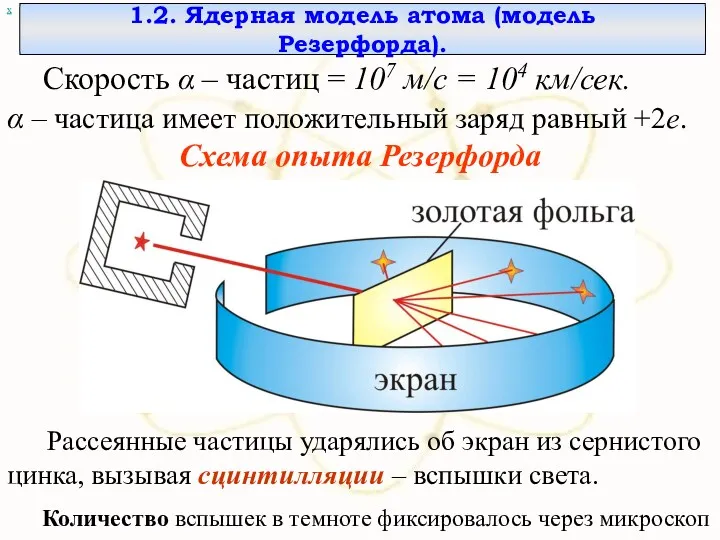
- 41. х 1.2. Ядерная модель атома (модель Резерфорда). Скорость α – частиц = 107 м/с = 104
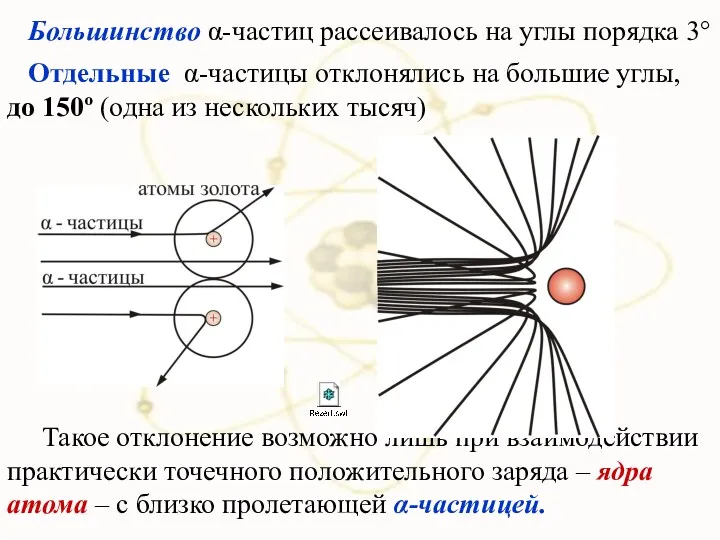
- 42. Большинство α-частиц рассеивалось на углы порядка 3° Отдельные α-частицы отклонялись на большие углы, до 150º (одна
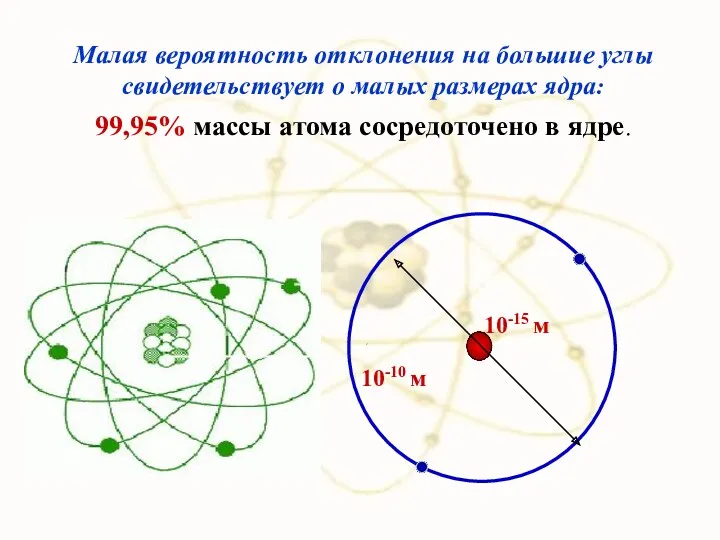
- 43. Малая вероятность отклонения на большие углы свидетельствует о малых размерах ядра: 99,95% массы атома сосредоточено в
- 44. Движение α-частицы происходит по гиперболе: Угол рассеяния равен углу между асимптотами гиперболы m – масса α-частицы,
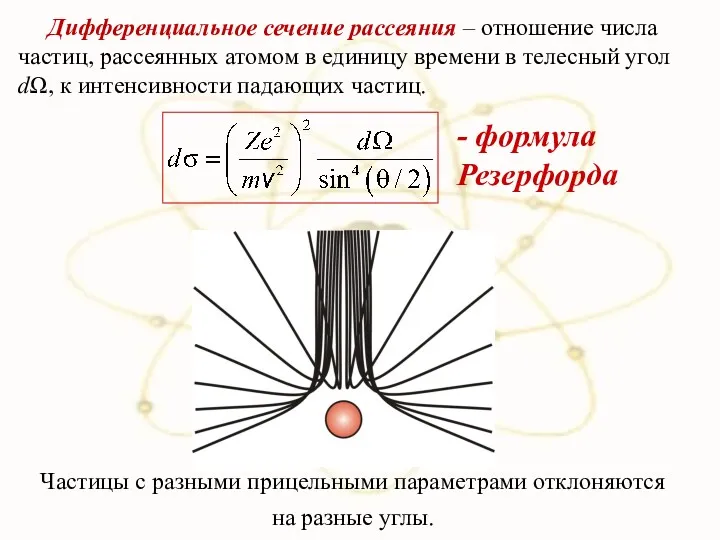
- 45. Дифференциальное сечение рассеяния – отношение числа частиц, рассеянных атомом в единицу времени в телесный угол dΩ,
- 47. 10-15м Радиус ядра R ≈ (10−14 ÷ 10−15 )м и зависит от числа нуклонов в ядре.
- 48. Альфа - частица Атом золота ?
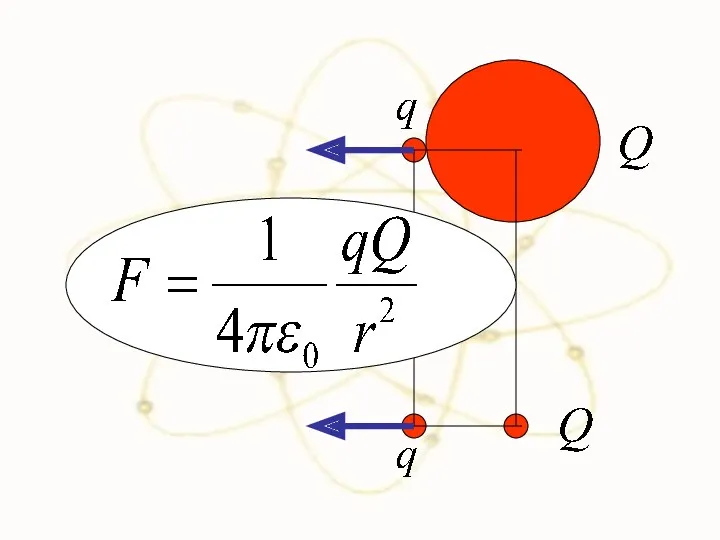
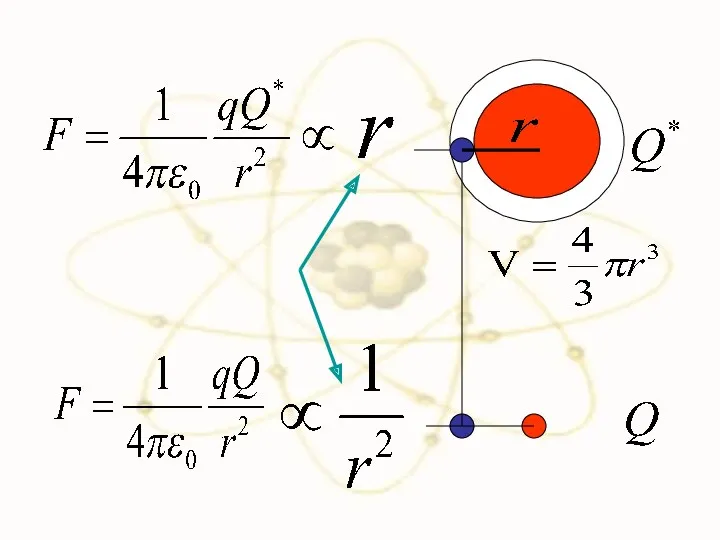
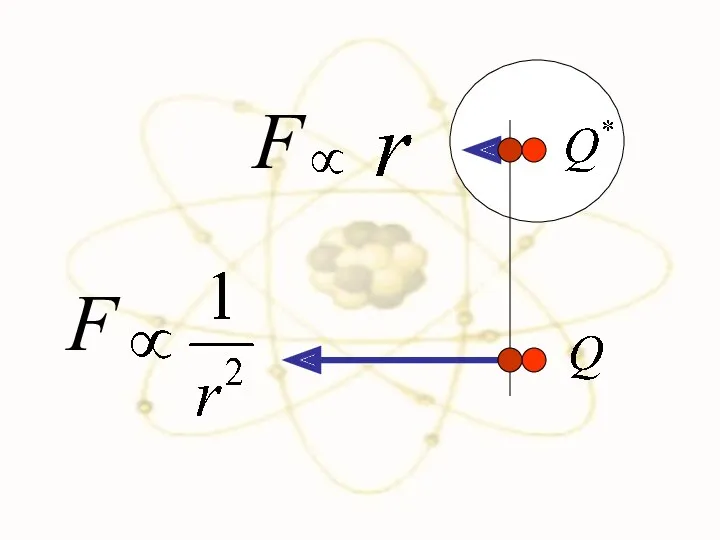
- 49. Сравним силы взаимодействия двух положительно заряженных частиц в разных моделях
- 52. F F
- 53. С помощью компьютера ...
- 55. Однако, планетарная модель была в явном противоречии с классической электродинамикой: электрон, двигаясь по окружности, т.е. с
- 57. Планетарная модель атома противоречит электродинамике Максвелла!!!
- 58. Согласно теории Максвелла, ускоренно движущийся заряд излучает электромагнитные волны.
- 59. При движении по окружности имеется центростремительное ускорение. Поэтому электрон должен терять энергию на электромагнитное излучение и
- 60. … излучать и падать...
- 61. Нестабильный атом?! Падать на ядро!
- 62. Попыткой спасения планетарной модели атома стали постулаты Н. Бора
- 63. х 1.3. Элементарная теория Бора. БОР Нильс Хендрик Давид (1885–1962) – Выдающийся датский физик-теоретик, один из
- 65. 1. Атом следует описывать как «пирамиду» стационарных энергетических состояний. Пребывая в одном из стационарных состояний, атом
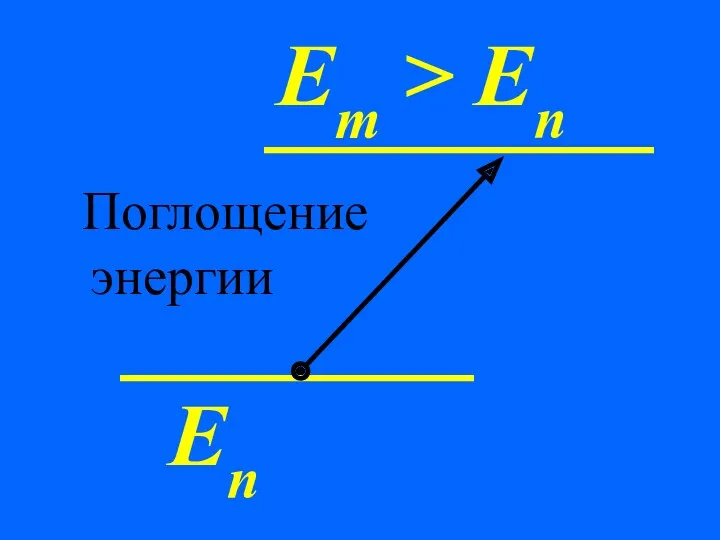
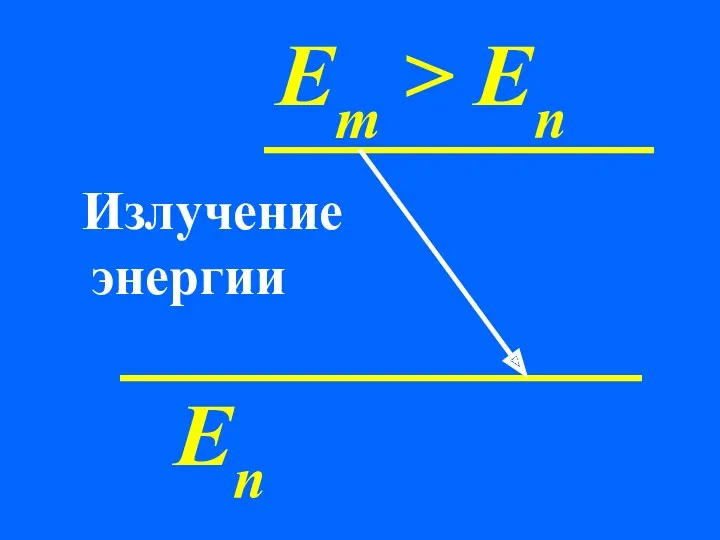
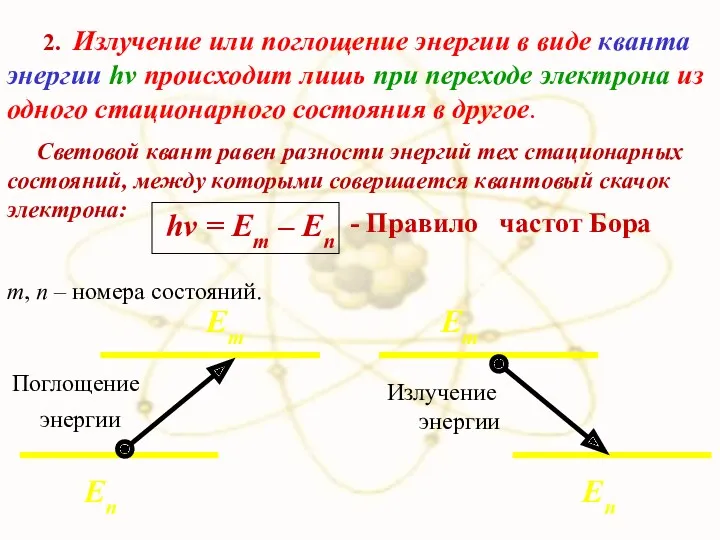
- 67. 2. При переходах между стационарными состояниями атом поглощает или излучает квант энергии. При поглощении энергии атом
- 68. Еn Em > En Поглощение энергии
- 69. Еn Em > En Излучение энергии
- 70. Теория Бора
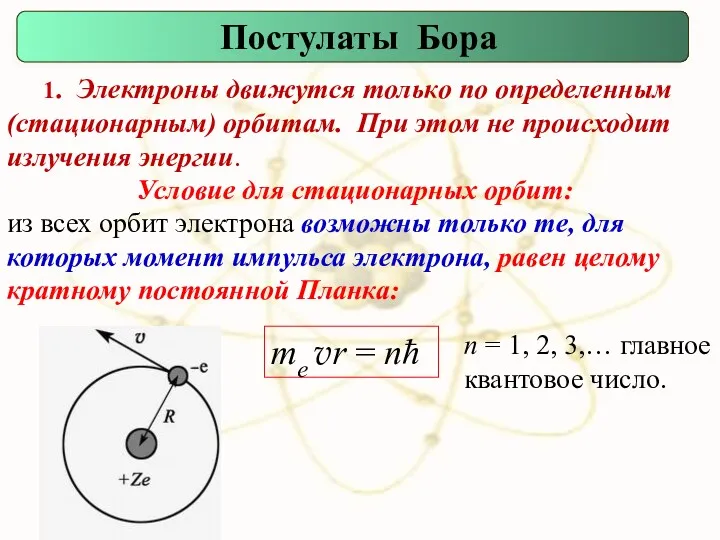
- 71. 1. Электроны движутся только по определенным (стационарным) орбитам. При этом не происходит излучения энергии. Постулаты Бора
- 72. 2. Излучение или поглощение энергии в виде кванта энергии hν происходит лишь при переходе электрона из
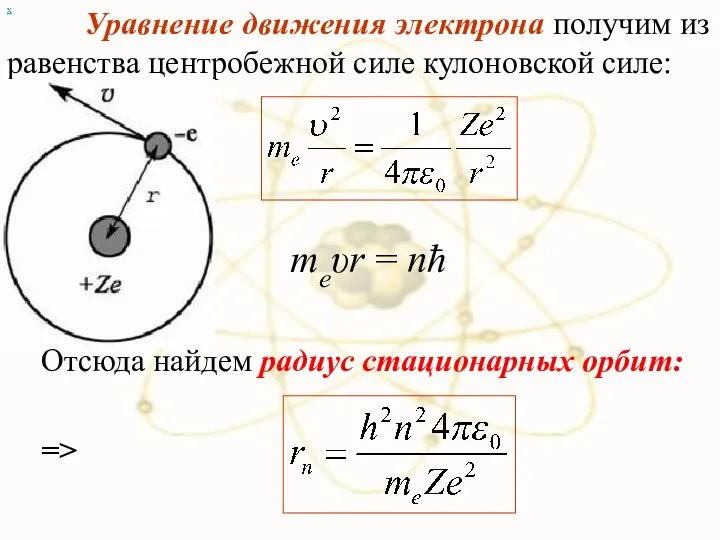
- 73. х Уравнение движения электрона получим из равенства центробежной силе кулоновской силе: => Отсюда найдем радиус стационарных
- 74. Радиус первой орбиты водородного атома называют Боровским радиусом: При n =1, Z = 1 для водорода
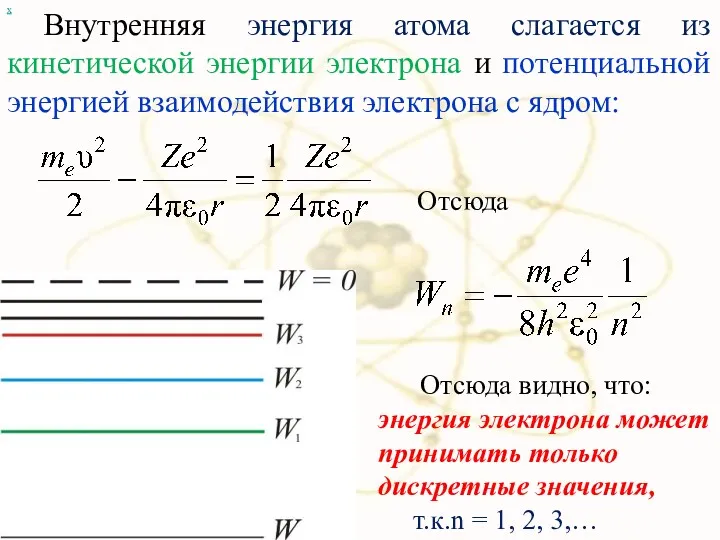
- 75. Внутренняя энергия атома слагается из кинетической энергии электрона и потенциальной энергией взаимодействия электрона с ядром: х
- 76. х Видимая область Инфракрасная обл. Ультрафиолетовая обл.
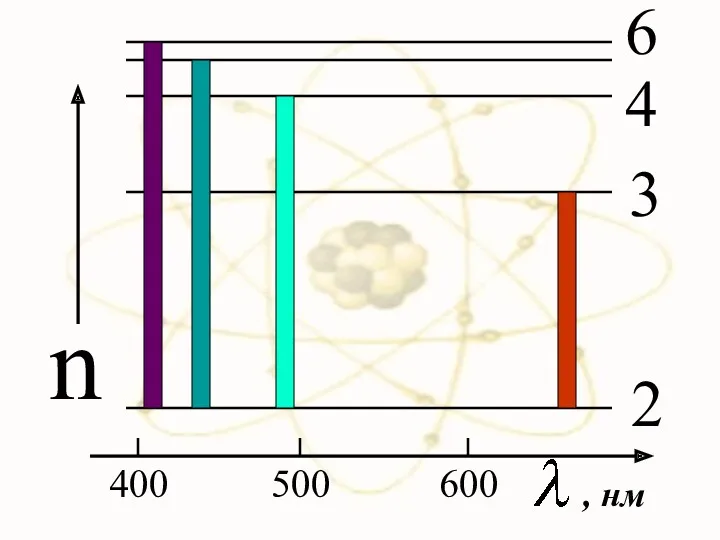
- 77. При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией
- 78. Серьезным успехом теории Бора явилось: вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых
- 79. 400 500 600 n 2 3 4 6 , нм
- 81. Бор теоретически вычислил отношение массы протона к массе электрона mp/me = 1847, это находится в соответствии
- 82. «Портрет» атома радия ( Н. Бор, 1925 )
- 83. х Однако наряду с успехами в теории Бора с самого начала обнаружились существенные недостатки. Главнейшее –
- 84. Аналогия теории Бора как слияния двух описаний микромира (Feline)
- 85. х Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и
- 86. Дальнейшее развитие квантовой механики привело к отказу от механической картины движения электрона в поле ядра.
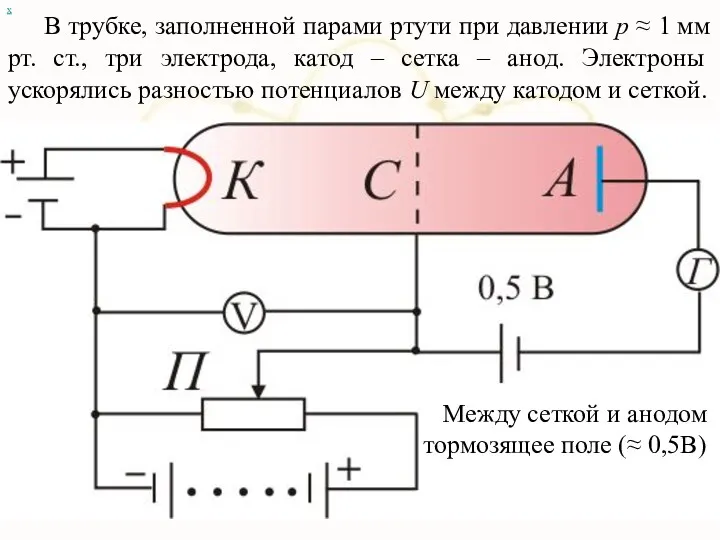
- 87. х 1.4. Опыт Франка и Герца. Существование дискретных энергетических уровней атома и доказательство правильности теории Бора
- 88. В трубке, заполненной парами ртути при давлении р ≈ 1 мм рт. ст., три электрода, катод
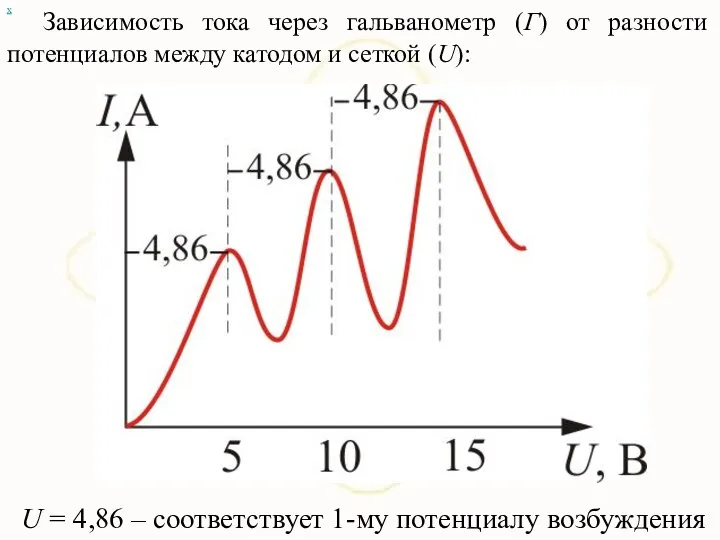
- 89. х Зависимость тока через гальванометр (Г) от разности потенциалов между катодом и сеткой (U): U =
- 90. Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию бомбардирующих
- 91. При U энергия электронов меньше ΔЕ1; соударения между электронами и атомами ртути носят упругий характер. При
- 92. Атомы ртути, получившие при соударении с электронами энергию ΔЕ1 и перешедшие в возбужденное состояние, спустя время
- 94. Скачать презентацию































































 Восстановление деталей давлением
Восстановление деталей давлением Торможение автомобиля
Торможение автомобиля Процессы нагревания
Процессы нагревания Бензиновые двигатели
Бензиновые двигатели Топливные форсунки автомобиля
Топливные форсунки автомобиля Внеклассное мероприятие Мой дом и физика в нем
Внеклассное мероприятие Мой дом и физика в нем Устройство зерноуборочных комбайнов
Устройство зерноуборочных комбайнов Динамика КШМ, часть 1. Лекция №2
Динамика КШМ, часть 1. Лекция №2 презентация к уроку физики Действие магнитного поля на проводник
презентация к уроку физики Действие магнитного поля на проводник Абсолютная температура как мера средней кинетической энергии частиц
Абсолютная температура как мера средней кинетической энергии частиц Дисперсия света. Опыт Ньютона
Дисперсия света. Опыт Ньютона Холодильні машини
Холодильні машини Ходовая часть
Ходовая часть Сложное сопротивление
Сложное сопротивление Методы электрофизической и электрохимической обработки поверхностей заготовок
Методы электрофизической и электрохимической обработки поверхностей заготовок Волновая оптика
Волновая оптика Технический проект моторного участка зоны ТР, при эксплуатации автомобилей ГАЗ 2705 в г. Нижний Тагил
Технический проект моторного участка зоны ТР, при эксплуатации автомобилей ГАЗ 2705 в г. Нижний Тагил Лекция №6 (6 ). Поле системы элементарных излучателей
Лекция №6 (6 ). Поле системы элементарных излучателей Презентация. Путешествие в страну Физика
Презентация. Путешествие в страну Физика Физико–химические свойства нефти, нефтепродуктов. Качество нефти и нефтепродуктов. Методы их анализа
Физико–химические свойства нефти, нефтепродуктов. Качество нефти и нефтепродуктов. Методы их анализа Застосування електричного струму в газах
Застосування електричного струму в газах Испытания на сдвиг, методы определения модулей сдвига при кручении плоских образцов и пластин по периоду крутильных колебаний
Испытания на сдвиг, методы определения модулей сдвига при кручении плоских образцов и пластин по периоду крутильных колебаний Рама тепловоза. Механическая часть тепловоза. Тема 1.2
Рама тепловоза. Механическая часть тепловоза. Тема 1.2 Виды теплообмена. Урок 10
Виды теплообмена. Урок 10 Презентация ЕГЭ по физике
Презентация ЕГЭ по физике Основы генерирования и формирования сигналов. Лекция 2
Основы генерирования и формирования сигналов. Лекция 2 Оптические приборы
Оптические приборы Теплообмен человека с окружающей средой
Теплообмен человека с окружающей средой