Содержание
- 2. Основные положения МКТ Все тела состоят из малых частиц, между которыми есть промежутки. Частицы тел постоянно
- 3. СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ Джон Дмитрий Дальтон Менделеев Амедео Эрнест Авогадро Резерфорд
- 4. Микропараметры вещества характеризуют каждую частицу вещества в отдельности, в отличие от макропараметров, характеризующих вещество в целом.
- 5. ПЕРВОЕ ПОЛОЖЕНИЕ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц –
- 6. ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение Движение молекул молекул газа твердых тел
- 7. ТРЕТЬЕ ПОЛОЖЕНИЕ Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо
- 8. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании
- 9. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ II положение 1. Диффузия – перемешивание молекул разных веществ. 2.Броуновское движение – движение взвешенных
- 10. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение
- 11. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
- 12. Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул.
- 13. КОЛИЧЕСТВО ВЕЩЕСТВА В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется
- 15. МОЛЯРНАЯ МАССА В одном моле любого вещества содержится одно и то же число частиц (молекул). Это
- 16. МАССА МОЛЕКУЛЫ m0 – масса молекулы М – молярная масса NА – число Авогадро
- 17. ЗАДАЧА 1. Рассчитать массу молекулы Н2SО4. Решение: М(Н2SО4) = 2·1 + 32 + 16·4 = 98
- 18. 2. Сколько молекул содержится в 50г Аℓ? Решение: М(Аℓ) = 27г/моль N = νNA ν =
- 20. Скачать презентацию
 Fundamentals of Electrical Engineering
Fundamentals of Electrical Engineering Бинарный урок - конференция по физике и химии
Бинарный урок - конференция по физике и химии Фазы вещества. Фазовые переходы
Фазы вещества. Фазовые переходы презентация Сила трения
презентация Сила трения Уроки настоящего 2019-2020. Цикл 2. Модуль 1. Тезаурус
Уроки настоящего 2019-2020. Цикл 2. Модуль 1. Тезаурус Рентгеновская дифрактометрия
Рентгеновская дифрактометрия Мобильный телефон с точки зрения физики
Мобильный телефон с точки зрения физики Механическая мощность. Физика 7 класс
Механическая мощность. Физика 7 класс Жарық толқындарының интерференциясы
Жарық толқындарының интерференциясы виды излучений. физика 11 класс
виды излучений. физика 11 класс Электромагнитные колебания
Электромагнитные колебания Свет как электромагнитная волна
Свет как электромагнитная волна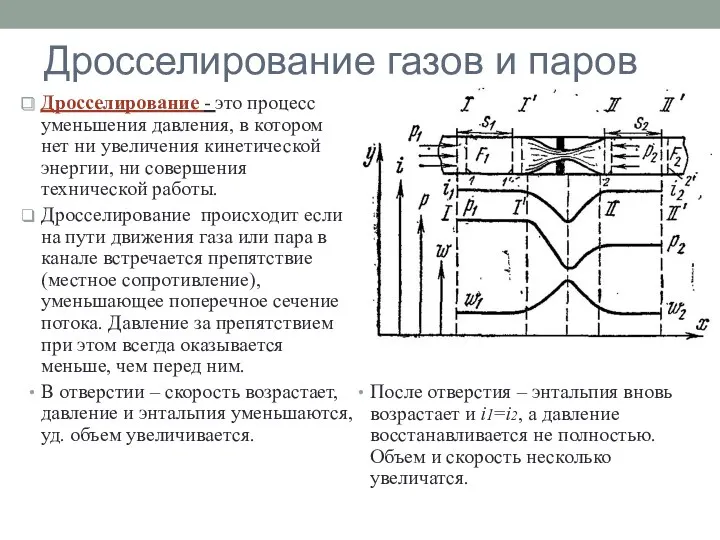 Дросселирование газов и паров
Дросселирование газов и паров Razele x
Razele x Циклы. Теплотехника
Циклы. Теплотехника Рідкі кристали та їх використання
Рідкі кристали та їх використання Презентация Работа сил электрического поля
Презентация Работа сил электрического поля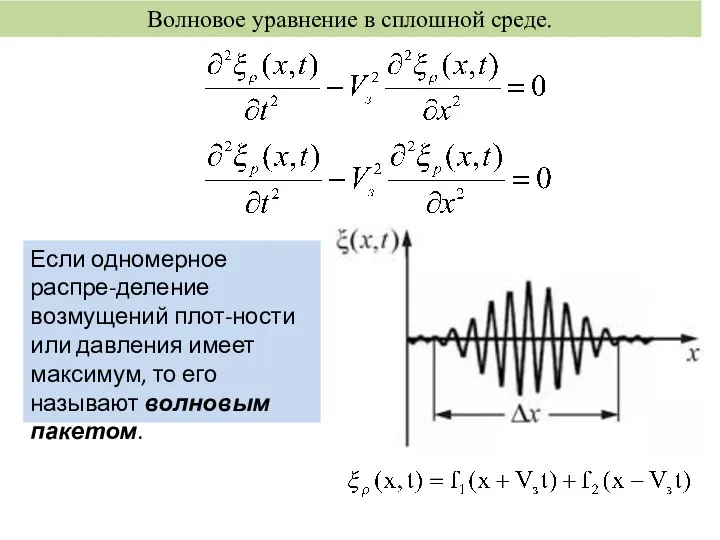 Волновое уравнение в сплошной среде
Волновое уравнение в сплошной среде Методические рекомендации при выполнении экспериментальных заданий ГИА по физике
Методические рекомендации при выполнении экспериментальных заданий ГИА по физике Ультрақысқа толқындар
Ультрақысқа толқындар Урок колебательный контур 11 класс.
Урок колебательный контур 11 класс. Презентация к уроку физики в 7 классе Механическая работа
Презентация к уроку физики в 7 классе Механическая работа Адсорбция из растворов на разных поверхностях раздела фаз
Адсорбция из растворов на разных поверхностях раздела фаз Буксовые узлы электровозов ВЛ80, ВЛ85, 2ЭС5К
Буксовые узлы электровозов ВЛ80, ВЛ85, 2ЭС5К Урок в 8 классе Сила тока.
Урок в 8 классе Сила тока. Кинематика. Лекция 1-1
Кинематика. Лекция 1-1 ТРИЗ Электричество
ТРИЗ Электричество Импульс, закон сохранения импульса
Импульс, закон сохранения импульса