Содержание
- 2. Цели урока: Сформировать основные понятия термодинамики Сформулировать первый закон термодинамики Рассмотреть принцип действия тепловых двигателей и
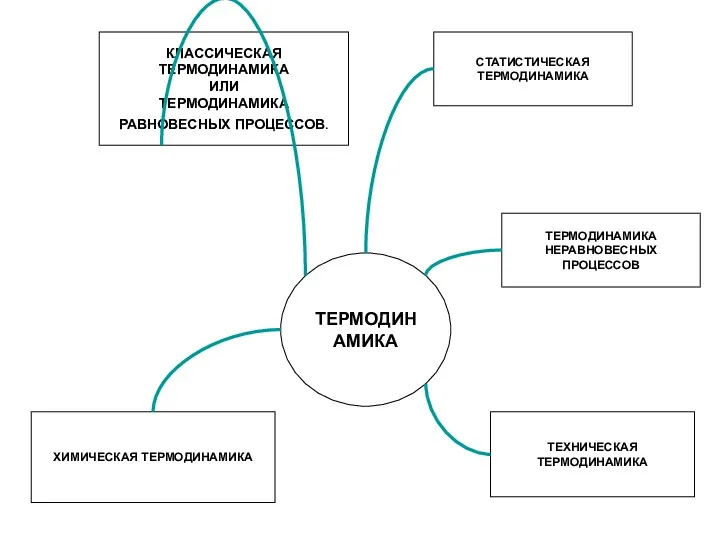
- 3. ТЕРМОДИНАМИКА
- 4. ОСНОВЫ ТЕРМОДИНАМИКИ. Это теория о наиболее общих свойствах макроскопических тел. На первый план выступают тепловые процессы
- 5. ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ
- 6. ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ
- 7. ЧТО ИЗУЧАЕТ ТЕРМОДИНАМИКА? √ Возникла как наука тепловых процессов, рассматриваемых с точки зрения энергетических преобразований. √
- 8. ГРАНИЦЫ ПРИМЕНИМОСТИ ТЕРМОДИНАМИКИ Неприменима к системе из нескольких молекул. Не может быть применима ко всей Вселенной,
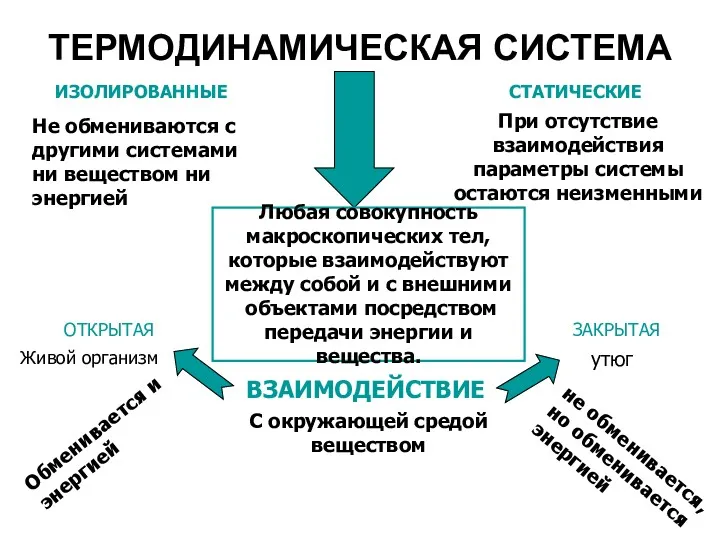
- 9. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Любая совокупность макроскопических тел, которые взаимодействуют между собой и с внешними объектами посредством передачи
- 10. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ Совокупность физических величин, характеризующих свойства термодинамической системы.
- 11. Внутренняя энергия Определение: Внутренняя энергия тела – это сумма кинетической энергии хаотического теплового движения частиц (атомов
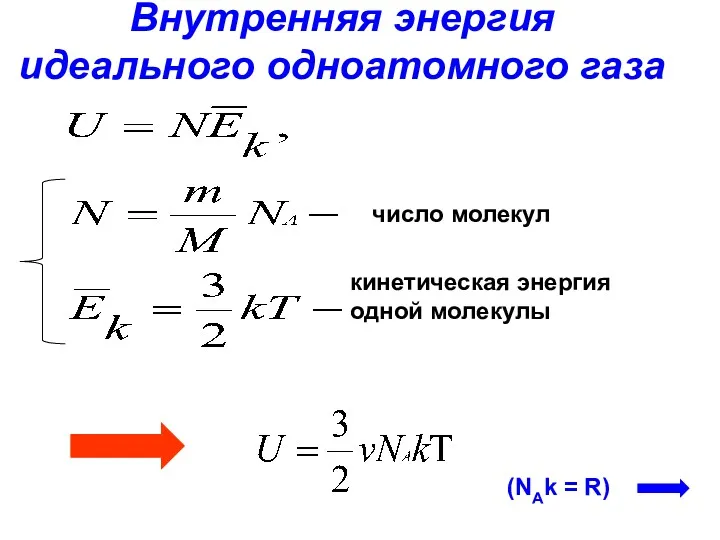
- 12. Внутренняя энергия идеального одноатомного газа число молекул кинетическая энергия одной молекулы (NAk = R)
- 13. Внутренняя энергия идеального одноатомного газа
- 14. Внутренняя энергия идеального двухатомного газа
- 15. Так как - уравнение Менделеева–Клапейрона, то внутренняя энергия: - для одноатомного газа - для двухатомного газа.
- 16. В общем виде: где i – число степеней свободы молекул газа (i = 3 для одноатомного
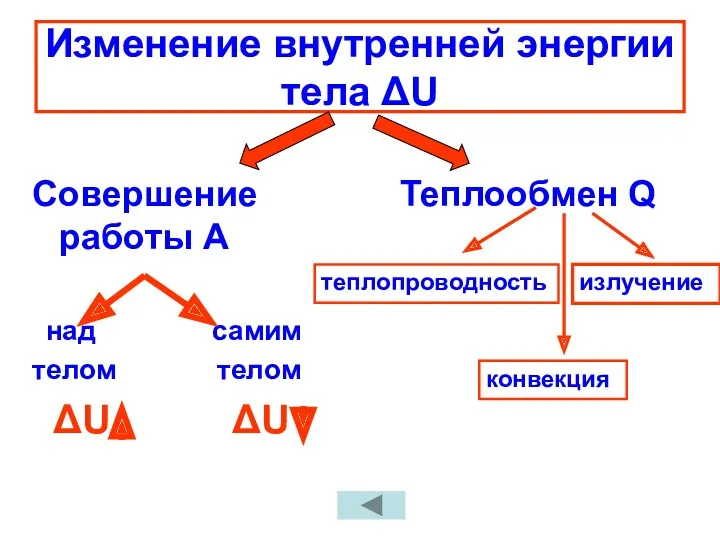
- 17. Изменение внутренней энергии тела ΔU Совершение работы А над самим телом телом ΔU ΔU Теплообмен Q
- 18. Работа в термодинамике Работа газа: Работа внешних сил:
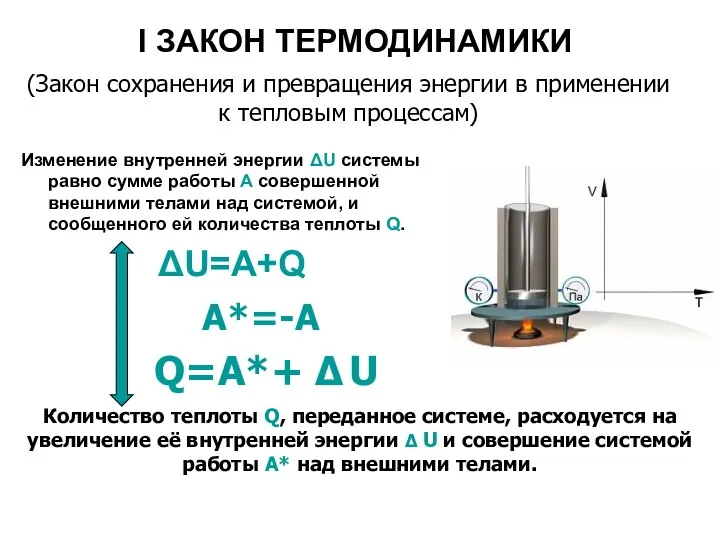
- 19. I ЗАКОН ТЕРМОДИНАМИКИ Изменение внутренней энергии ΔU системы равно сумме работы A совершенной внешними телами над
- 20. Первый закон термодинамики Изменение внутренней энергии системы при переходе её из одного состояния в другое равно
- 21. ТЕРМОДИНАМИКА ИЗОПРОЦЕССОВ. Процессы, происходящие при постоянном значении одного из параметров состояния (T,V или P) с данной
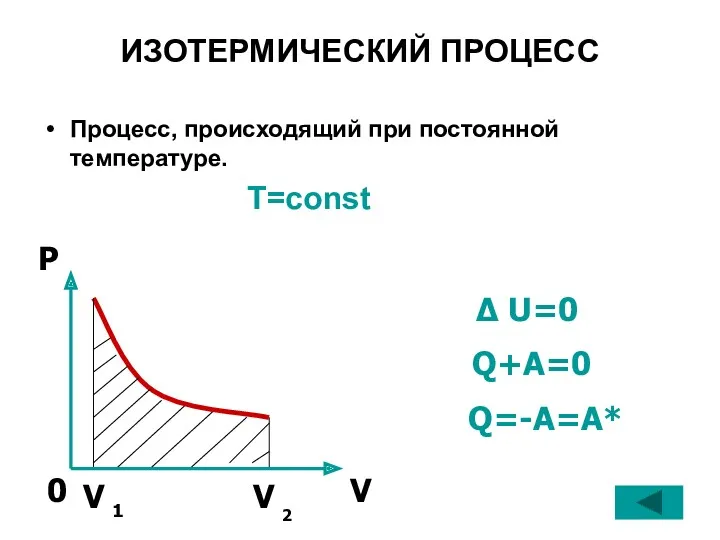
- 22. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Процесс, происходящий при постоянной температуре. T=const Δ U=0 Q+A=0 Q=-A=A*
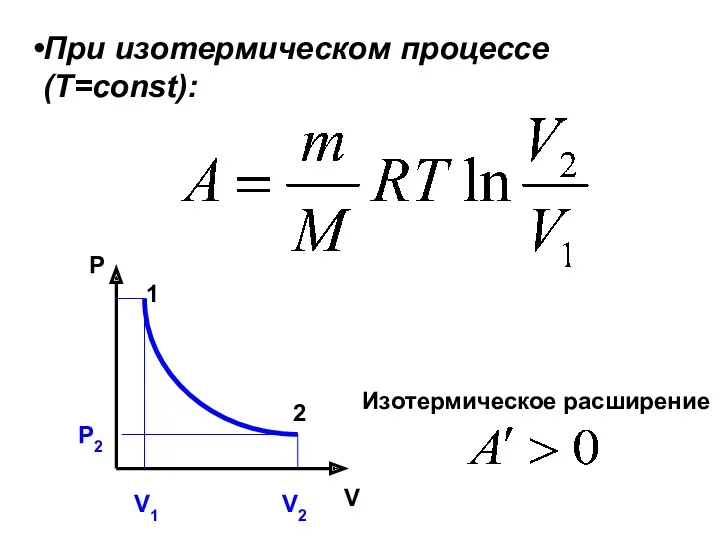
- 23. При изотермическом процессе (Т=const): P V Изотермическое расширение Р2 1 2 V1 V2
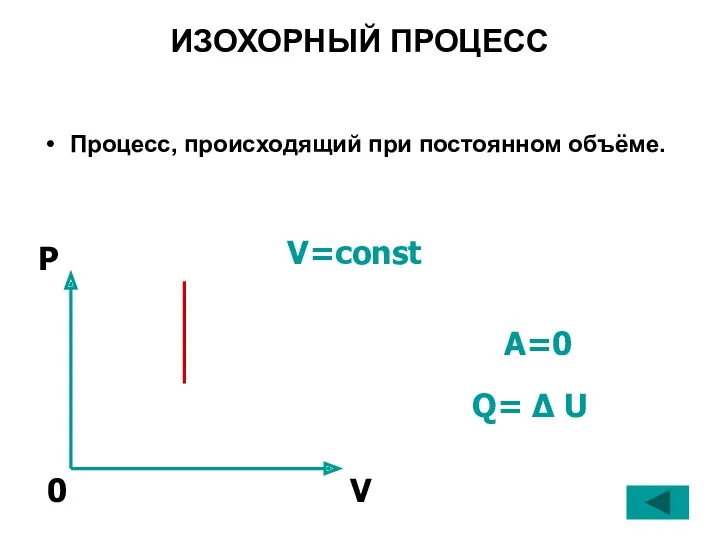
- 24. ИЗОХОРНЫЙ ПРОЦЕСС Процесс, происходящий при постоянном объёме. V=const Q= Δ U A=0
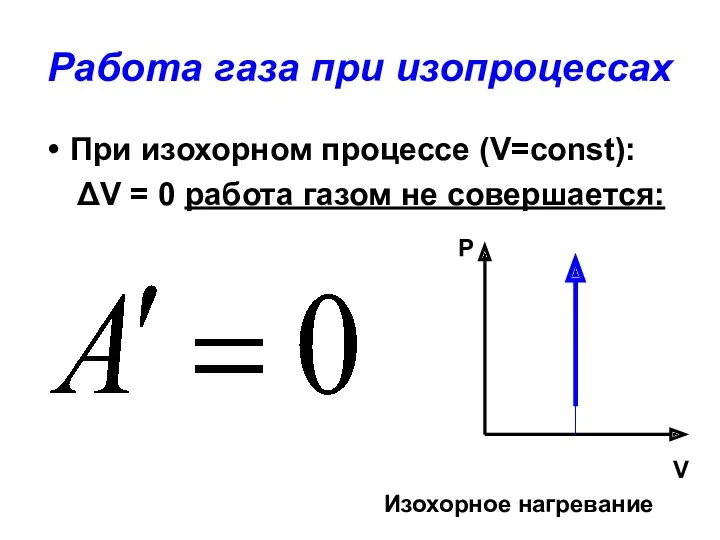
- 25. Работа газа при изопроцессах При изохорном процессе (V=const): ΔV = 0 работа газом не совершается: P
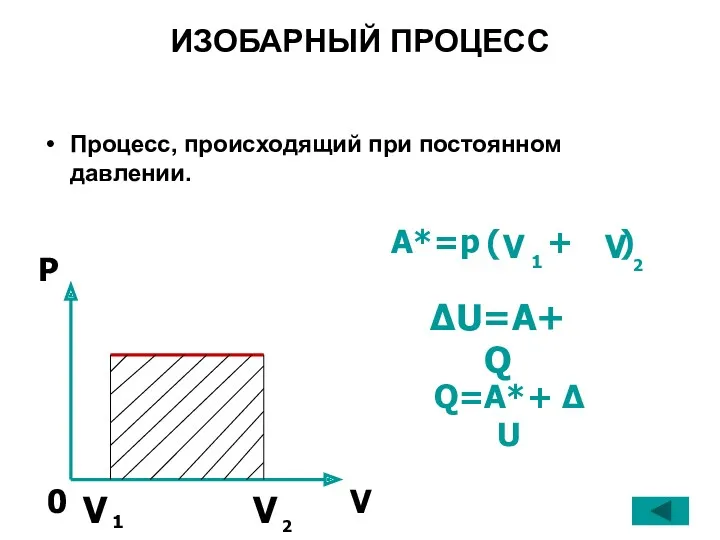
- 26. ИЗОБАРНЫЙ ПРОЦЕСС Процесс, происходящий при постоянном давлении. A*=p ( + ) ΔU=A+Q Q=A*+ Δ U
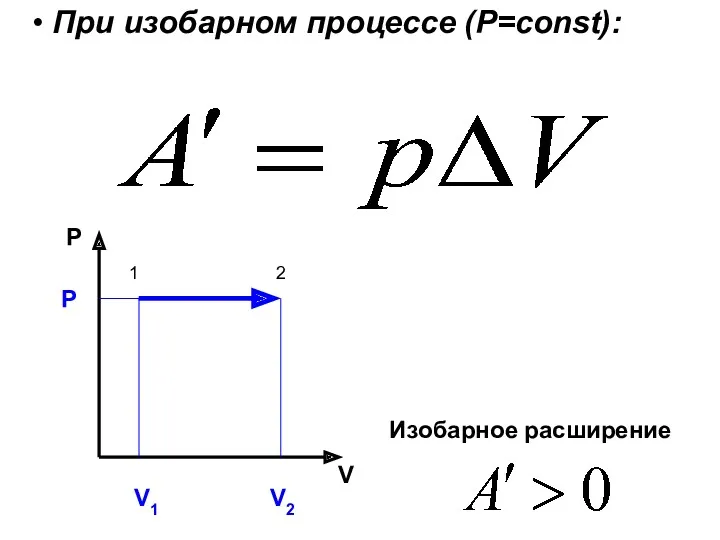
- 27. При изобарном процессе (Р=const): P V V1 V2 P Изобарное расширение 1 2
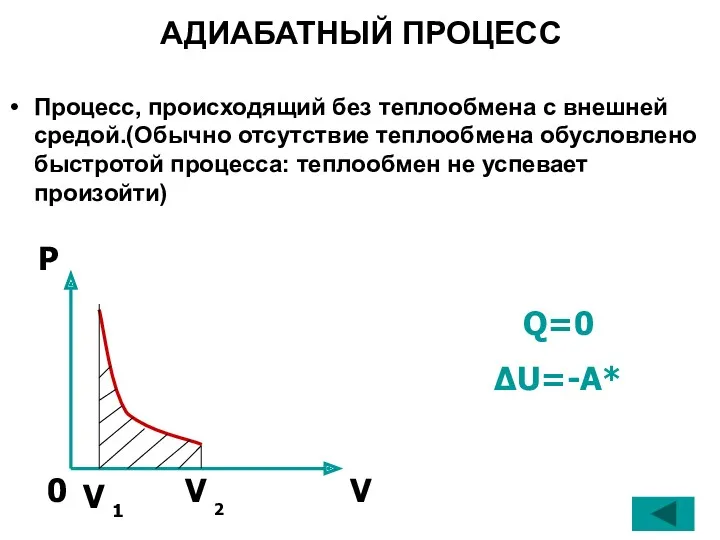
- 28. АДИАБАТНЫЙ ПРОЦЕСС Процесс, происходящий без теплообмена с внешней средой.(Обычно отсутствие теплообмена обусловлено быстротой процесса: теплообмен не
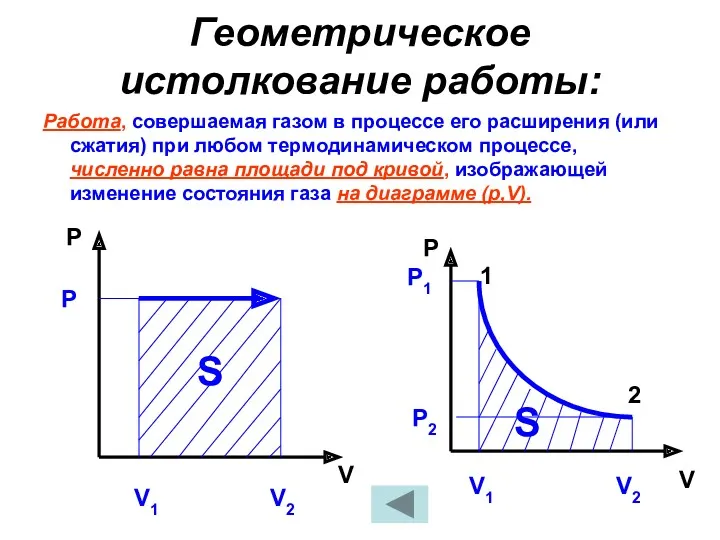
- 29. Геометрическое истолкование работы: Работа, совершаемая газом в процессе его расширения (или сжатия) при любом термодинамическом процессе,
- 30. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
- 31. Применение первого закона термодинамики к различным процессам
- 32. II ЗАКОН ТЕРМОДИНАМИКИ Тепловые процессы необратимы. Не возможно перевести теплоту от более холодной системы к более
- 33. Тепловые двигатели – устройства, превращающие внутреннюю энергию топлива в механическую. Виды тепловых двигателей
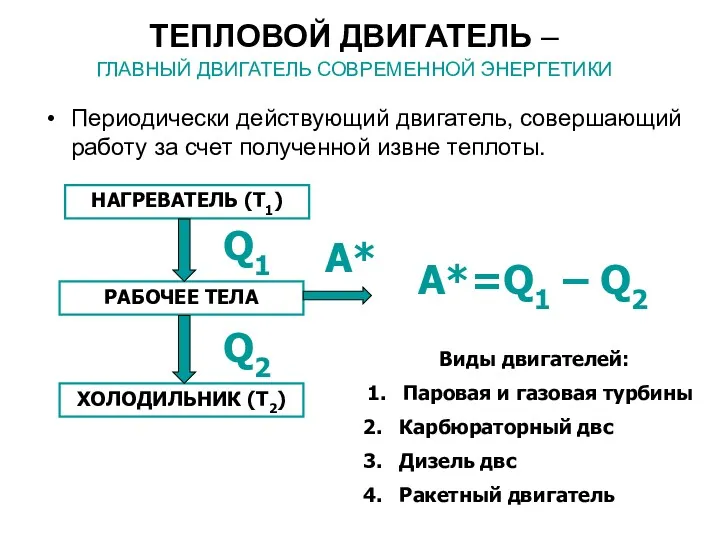
- 34. ТЕПЛОВОЙ ДВИГАТЕЛЬ – ГЛАВНЫЙ ДВИГАТЕЛЬ СОВРЕМЕННОЙ ЭНЕРГЕТИКИ Периодически действующий двигатель, совершающий работу за счет полученной извне
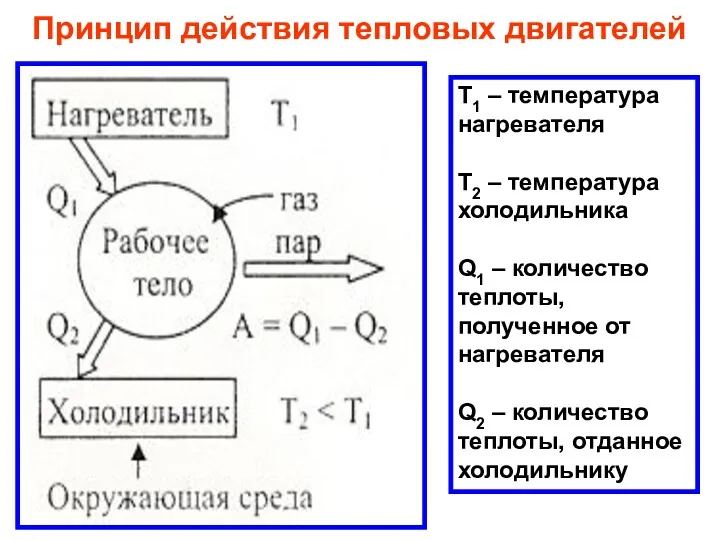
- 35. Принцип действия тепловых двигателей Т1 – температура нагревателя Т2 – температура холодильника Q1 – количество теплоты,
- 36. Коэффициент полезного действия (КПД) теплового двигателя – отношение работы А’, совершаемой двигателем, к количеству теплоты, полученному
- 37. где работа, совершаемая двигателем тогда КПД всегда меньше единицы, так как у всех двигателей некоторое количество
- 38. Максимальное значение КПД тепловых двигателей (цикл Карно):
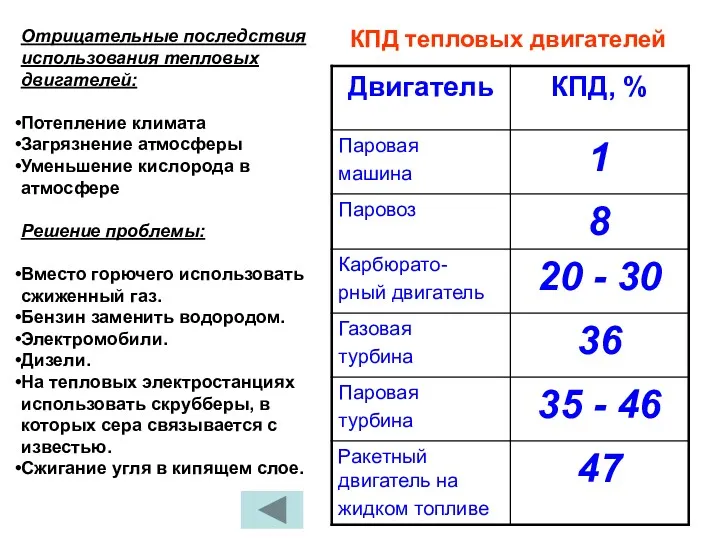
- 39. Отрицательные последствия использования тепловых двигателей: Потепление климата Загрязнение атмосферы Уменьшение кислорода в атмосфере Решение проблемы: Вместо
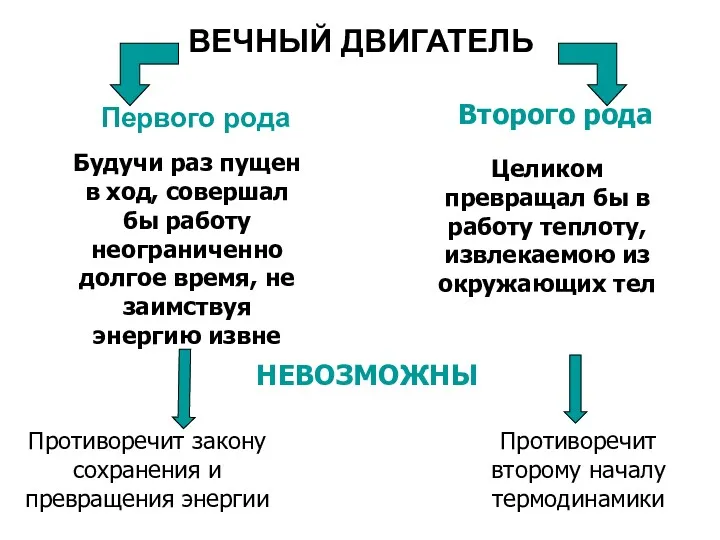
- 40. ВЕЧНЫЙ ДВИГАТЕЛЬ Первого рода Второго рода Целиком превращал бы в работу теплоту, извлекаемою из окружающих тел
- 41. ТЕРМОДИНАМИКА И ПРИРОДА В окружающей нас природе термодинамически обратимых процессов нет. Энтропия в термодинамически не обратимых
- 42. Тест по ТЕРМОДИНАМИКЕ На сколько отделов делится термодинамика как предмет? а) на три в) на пять
- 43. Тест по ТЕРМОДИНАМИКЕ (продолжение) При каком изопроцессе работа не совершается? а) при изотермическом в) адиабатном б)
- 45. Скачать презентацию

























 Ограничение перенапряжений. Лекция № 4
Ограничение перенапряжений. Лекция № 4 Системы запуска газотурбинных двигателей (ГТД )
Системы запуска газотурбинных двигателей (ГТД ) Электростатика. Потенциал. Работа электрического поля. Электроемкость. Постоянный и переменный ток
Электростатика. Потенциал. Работа электрического поля. Электроемкость. Постоянный и переменный ток Английский язык в механике
Английский язык в механике Многоточечный электронный впрыск
Многоточечный электронный впрыск Механическое движение. Что называется механическим движением?
Механическое движение. Что называется механическим движением? Термоэлектрические термометры
Термоэлектрические термометры Системы смазки и охлаждения двигателя
Системы смазки и охлаждения двигателя Как вычислить проекцию?
Как вычислить проекцию? Електричне коло та його елементи
Електричне коло та його елементи Гидродинамика Солнца. (Лекция 6)
Гидродинамика Солнца. (Лекция 6) Определение коэффициента теплопроводности изоляционного материала методом трубы
Определение коэффициента теплопроводности изоляционного материала методом трубы Электрический ток в полупроводниках
Электрический ток в полупроводниках История возникновения спектроскопии
История возникновения спектроскопии Механические подвески автомобиля
Механические подвески автомобиля Одноковшовые экскаваторы. Классификация и обозначения. Характеристика и общее устройство. Рабочее оборудование
Одноковшовые экскаваторы. Классификация и обозначения. Характеристика и общее устройство. Рабочее оборудование Проводники в электростатическом поле. Конденсаторы. Энергия электрического поля. (Лекция 3)
Проводники в электростатическом поле. Конденсаторы. Энергия электрического поля. (Лекция 3) Автоматизация производственных процессов в машиностроении
Автоматизация производственных процессов в машиностроении Потенциальная энергия заряженного тела в однородном электростатическом поле. Потенциал поля и разность потенциалов
Потенциальная энергия заряженного тела в однородном электростатическом поле. Потенциал поля и разность потенциалов презентация для 7 класс Определение цены деления прибора
презентация для 7 класс Определение цены деления прибора Оптические методы
Оптические методы Атмосферное давление. Измерение атмосферного давления. 7 класс
Атмосферное давление. Измерение атмосферного давления. 7 класс Строение вещества. Молекулы
Строение вещества. Молекулы Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4)
Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4) Принцип дії теплових машин
Принцип дії теплових машин Сила Ампера
Сила Ампера Перспективы развития АЭС
Перспективы развития АЭС Структурные уровни организации материи. Лекция 6 (1ч)
Структурные уровни организации материи. Лекция 6 (1ч)