Содержание
- 2. ЛЕКЦИЯ 18. ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА. А.И. Валишев волновых функций
- 3. ФОРМУЛИРОВКА БОРА.
- 4. Формулировка Бора Бор. Последовательность, свойства элементов связаны с зарядом ядра (не массой) Свойства атома определяются структурой
- 5. Формулировка Бора В чисто кулоновском поле энергия электронного уровня зависит только от главного квантового числа n
- 6. Формулировка Бора
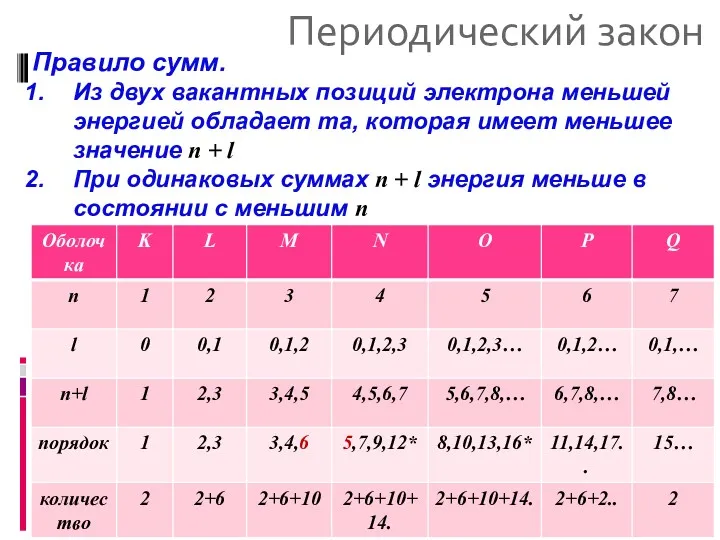
- 7. Периодический закон Правило сумм. Из двух вакантных позиций электрона меньшей энергией обладает та, которая имеет меньшее
- 8. Периодический закон Порядок заполнения уровней и подуровней в многоэлектронных атомах: 1s, 2s, 2p, 3s, 3p, 4s,
- 9. Периодический закон Последовательность заполнения оболочек 4. Be – 4-й электрон заполняет 2s подоболочку. Терм ОС -
- 10. Периодический закон Последовательность заполнения оболочек 1-й период – заполнена K оболочка – 2 элемента 2-й период
- 11. Периодический закон Последовательность заполнения оболочек 4-й период заканчивается Kr – инертный газ с полностью заполненными K,L,M,N
- 12. Особенности d,f электронов В классике точки поворота s,p электронов при больших радиусах по- сравнению с d,f
- 13. Особенности d,f электронов Три переходные группы с заполнением d подоболочек. Группа Fe (Sc, Ti, V, …,Ni)
- 14. Особенности d,f электронов Пример. 46 Pd Завершает собственную группу. Появляется 2 электрона (9,10 в 4d )
- 15. Особенности d,f электронов Добавляемые электроны с n=4, l=3, находятся глубоко внутри атома. По теории Бора радиус
- 16. ХАРАКТЕРИСТИЧЕСКОЕ РЕНТГЕНОВСКОЕ ИЗЛУЧЕНИЕ.
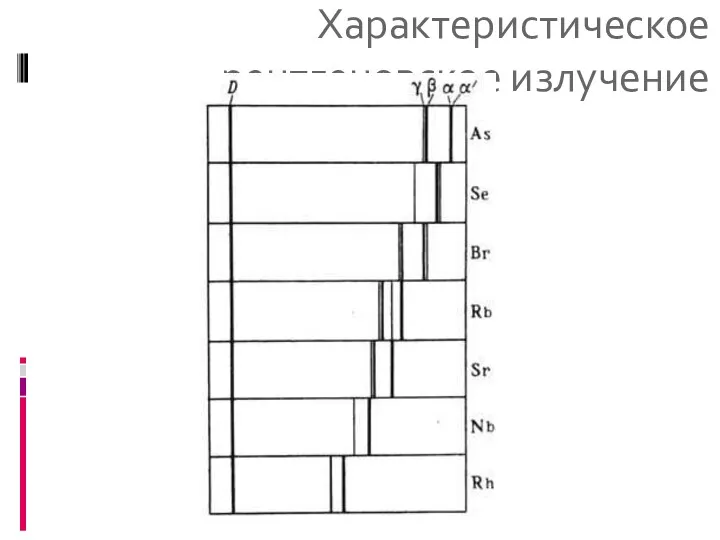
- 17. Характеристическое рентгеновское излучение Характеристическое рентгеновское излуче-ние возникает при заполнении вакантного места в одной из внутренних оболочек
- 18. Характеристическое рентгеновское излучение
- 19. Характеристическое рентгеновское излучение Линии X. с. возникают при переходе электрона с одной из внеш. электронных оболочек
- 20. Характеристическое рентгеновское излучение Пример. K линия – переход с оболочек n>=2, l на оболочку с n=1,
- 21. ЗАКОН МОЗЛИ.
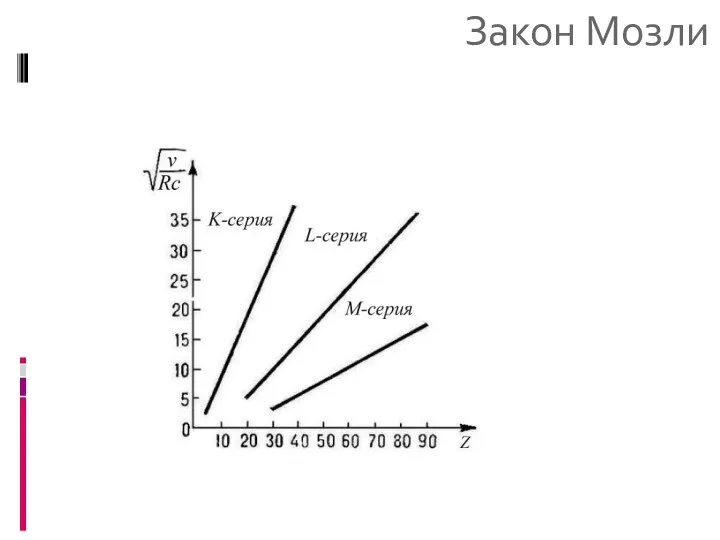
- 22. Закон Мозли Эмпирически установлено соотношение между частотой рентгеновской линии спектра (х.с.) с атомным номером элемента Пример.
- 23. Закон Мозли Для серии Kα Заряд ядра Z заменен на Z-δ вследствие экранировки кулоновского поля ядра
- 24. Закон Мозли
- 25. Интернет ресурс http//:edu.ci.nsu.ru Курс лекций Задачник
- 27. Скачать презентацию





















 Основи молекулярно - кінетичної теорії газів (лекція 6)
Основи молекулярно - кінетичної теорії газів (лекція 6) Что изучает физика
Что изучает физика Теплотехнические схемы парогенераторов АЭС
Теплотехнические схемы парогенераторов АЭС Ремонт системы питания КамАЗ 4326
Ремонт системы питания КамАЗ 4326 Механическое движение. Материальная точка. Система отсчета
Механическое движение. Материальная точка. Система отсчета Типовые детали машин
Типовые детали машин Расчет и проектирование элементов механического измельчения отходов
Расчет и проектирование элементов механического измельчения отходов Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул
Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул Равномерное движение по окружности. Решение задач.
Равномерное движение по окружности. Решение задач. Физика пласта. Подземная нефтегидродинамика
Физика пласта. Подземная нефтегидродинамика Исследовательский проект Машина Голдберга Разбивалка яйиц
Исследовательский проект Машина Голдберга Разбивалка яйиц Физические основы механики. Физика в познании вещества, поля, пространства и времени
Физические основы механики. Физика в познании вещества, поля, пространства и времени Звук и его характеристики
Звук и его характеристики Сравнительная характеристика полупроводниковых материалов
Сравнительная характеристика полупроводниковых материалов Общие сведения об устройствах получения информации о процессе
Общие сведения об устройствах получения информации о процессе Lektsia_9_Difraktsia_Frenelya
Lektsia_9_Difraktsia_Frenelya Электромагнитные волны и их свойства. Шкала электромагнитных волн
Электромагнитные волны и их свойства. Шкала электромагнитных волн Озоновый слой атмосферы и озоновые дыры
Озоновый слой атмосферы и озоновые дыры Преломление света. 8 класс
Преломление света. 8 класс Сообщающиеся сосуды
Сообщающиеся сосуды Елементи теорії поля. (Лекція 10)
Елементи теорії поля. (Лекція 10) Материалы с особыми электрическими свойствами
Материалы с особыми электрическими свойствами Процесс ремонтной окраски Mazda 46G
Процесс ремонтной окраски Mazda 46G Дисперсия света
Дисперсия света Методы исследования переключения в сегнетоэлектриках. Микроскопия
Методы исследования переключения в сегнетоэлектриках. Микроскопия Bosch Airless SCR System
Bosch Airless SCR System Электромагнитная совместимость
Электромагнитная совместимость Оптические явления. Урок для 8 класса
Оптические явления. Урок для 8 класса