Содержание
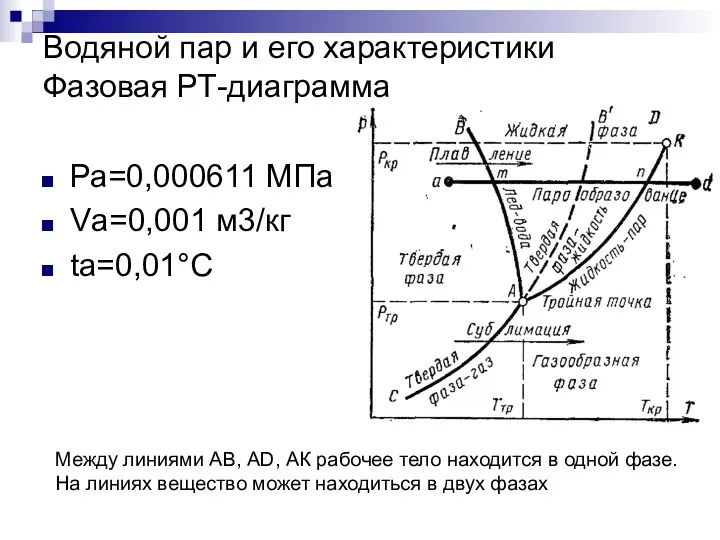
- 2. Водяной пар и его характеристики Фазовая РТ-диаграмма Ра=0,000611 МПа Vа=0,001 м3/кг ta=0,01°С Между линиями АВ, AD,
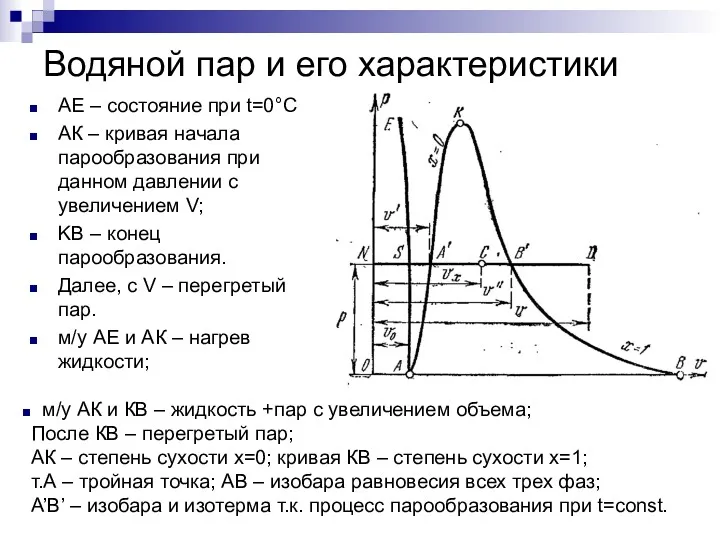
- 3. Водяной пар и его характеристики АЕ – состояние при t=0°С АК – кривая начала парообразования при
- 4. Pv-диаграмма водяного пара Выводы по Pv– диаграмме: Pv – диаграмма служит рабочим инструментом для определения свойств
- 5. Водяной пар Реальный газ, образующийся при испарении или кипении воды, - рабочее тело в теплотехнике. Парообразование
- 6. Кипение Процесс происходит при определенной температуре. Температура кипения зависит от физических свойств жидкости и давления окружающей
- 7. Парообразование 1 кг воды при 0С и под некоторым давление, создаваемым поршнем; Подводим тепло, температура …..
- 8. Пар Пар, не содержащий капелек воды и имеющий температуру насыщения, - сухой насыщенный пар. Если в
- 9. Степень сухости Массовая доля сухого пара во влажном паре – степень сухости: где mП - масса
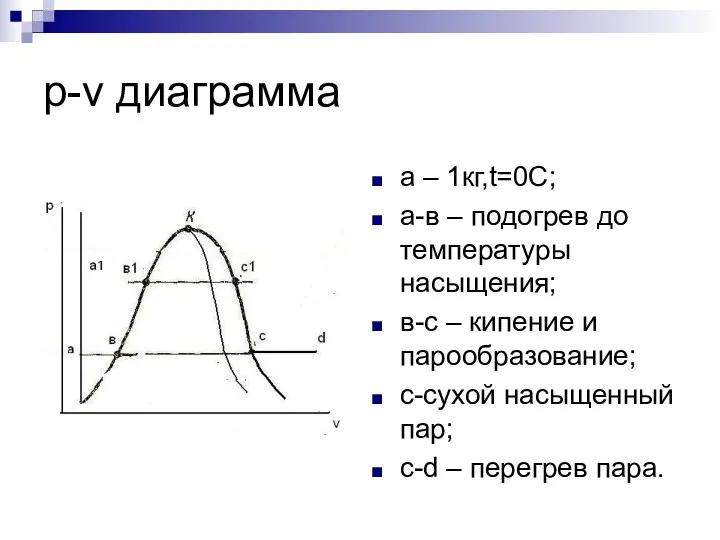
- 10. p-v диаграмма a – 1кг,t=0С; a-в – подогрев до температуры насыщения; в-с – кипение и парообразование;
- 11. p-v диаграмма Нулевая изотерма; в-k –зависимость удельного объема воды от давления при параметрах насыщения; c-k- зависимость
- 12. Критическая точка Критическая точка (удельные объемы пара и жидкости сравниваются ) – максимально возможная температура сосуществования
- 13. Тройная точка Наименьшее давление, при котором еще возможно равновесие воды и насыщенного пара, - давление тройной
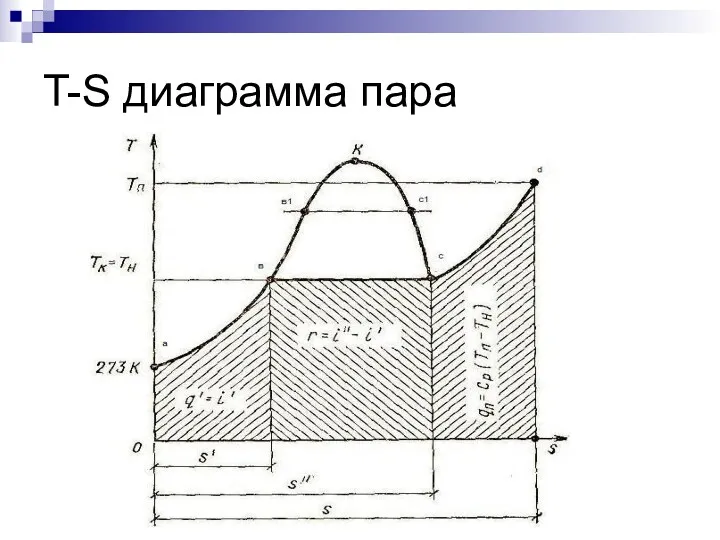
- 14. T-S диаграмма пара
- 15. T-S диаграмма Площадь под кривой a-в - количество тепла на подогрев воды от 0С до температуры
- 17. Скачать презентацию










 Практическая работа. Изучение машин и оборудования для расчистки озеленяемых территорий
Практическая работа. Изучение машин и оборудования для расчистки озеленяемых территорий Сила Ампера і сила Лоренца
Сила Ампера і сила Лоренца Векторлар өрісінің циркуляциясы, роторы
Векторлар өрісінің циркуляциясы, роторы Электромагнитное взаимодействие
Электромагнитное взаимодействие Механика. Глава 1. Кинематика ---
Механика. Глава 1. Кинематика --- Электрический ток в биологических тканях. Основы реографии
Электрический ток в биологических тканях. Основы реографии Холодильні машини
Холодильні машини Кулон заңы тақырыбына есептер шығару
Кулон заңы тақырыбына есептер шығару Теоретические основы электротехники. Теория электромагнитного поля. Лекция 2
Теоретические основы электротехники. Теория электромагнитного поля. Лекция 2 Экранирование электромагнитных полей
Экранирование электромагнитных полей Устройство увеличительных приборов
Устройство увеличительных приборов Звукоизоляция
Звукоизоляция Техніка високих напруг (ТВН). Частина 1
Техніка високих напруг (ТВН). Частина 1 Static Equilibrium and Friction
Static Equilibrium and Friction Енергія, робота та потужність.Закон збереження енергії. Лекція 5
Енергія, робота та потужність.Закон збереження енергії. Лекція 5 Итоговая контрольная работа по физике 7 клас
Итоговая контрольная работа по физике 7 клас Проводники в электростатическом поле. Конденсаторы. Энергия электрического поля
Проводники в электростатическом поле. Конденсаторы. Энергия электрического поля Износостойкие покрытия режущих инструментов
Износостойкие покрытия режущих инструментов Теплота сгорания топлива
Теплота сгорания топлива Система постоянного полного привода. История полного привода
Система постоянного полного привода. История полного привода Розчинник
Розчинник Физика. Разделы физики
Физика. Разделы физики Презентация Упругое и неупругое соударение
Презентация Упругое и неупругое соударение Магнитное поле
Магнитное поле Основы слесарно-сборочных и электромонтажных работ. Сущность и назначение операции опиливания
Основы слесарно-сборочных и электромонтажных работ. Сущность и назначение операции опиливания Нанотехнология және наноматериалдар. Қазіргі нанотехнология мәселелері
Нанотехнология және наноматериалдар. Қазіргі нанотехнология мәселелері Простые механизмы в технике и в быту
Простые механизмы в технике и в быту Жылуалмасу теориясының негізгі ережелері. Жылудың жылуөткізгіштікпен берілуі
Жылуалмасу теориясының негізгі ережелері. Жылудың жылуөткізгіштікпен берілуі