Содержание
- 2. Химическая термодинамика Может предсказывать: возможность протекания химической реакции . Используется: для расчета энергии, необходимой для осуществления
- 3. “Термодинамическая система ” Система- это любая совокупность веществ, отделённая от окружающей среды реальной или воображаемой поверхностью
- 4. ТИПЫ СИСТЕМ Полностью изолированные Отсутствует обмен энергией и веществом с окружающей средой, (примером может служить вселенная).
- 5. СОСТОЯНИЯ СИСТЕМЫ стационарное Для открытых систем: все живые организмы, для которых характерно постоянство параметров pH, t0,
- 6. ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС Переход системы из одного состояния в другое называется процессом. В зависимости от условий процессы
- 7. Внутренняя энергия системы Энергия – это способность совершать работу (кДж/моль) Внутренняя энергия равна сумме потенциальной и
- 8. Первый закон термодинамики (Ю.Р.МАЙЕР 1842) энергия может превращаться из одного вида в другой, но не может
- 9. термохимия изучает энергетические эффекты химических и физико-химических процессов. Тепловой эффект реакции – это количество энергии, которое
- 10. Расчеты в термохимии. Закон Гесса (1836). “Тепловой эффект (энтальпия) реакции зависит только от природы и физического
- 11. Следствия из закона Гесса : Энтальпия образования вещества равна энтальпии разложения вещества, но противоположна по знаку:
- 12. Типовая задача. Рассчитать тепловой эффект реакции окисления 1 моль глюкозы: С6Н12О6 (т)+ 6О2(г) = 6Н2О(ж) +
- 13. Движущие силы реакции Энтальпийный фактор экзотермический процесс : ∆H эндотермический : ∆H > 0 Самопроизвольно любая
- 14. Второй закон термодинамики тенденция частиц объединяться , понижая U and H (∆H тенденция частиц распадаться ,
- 15. Влияние температуры на направление реакции ( по уравнению Гиббса: ∆G=∆H - T∆S ) Четыре возможных случая:
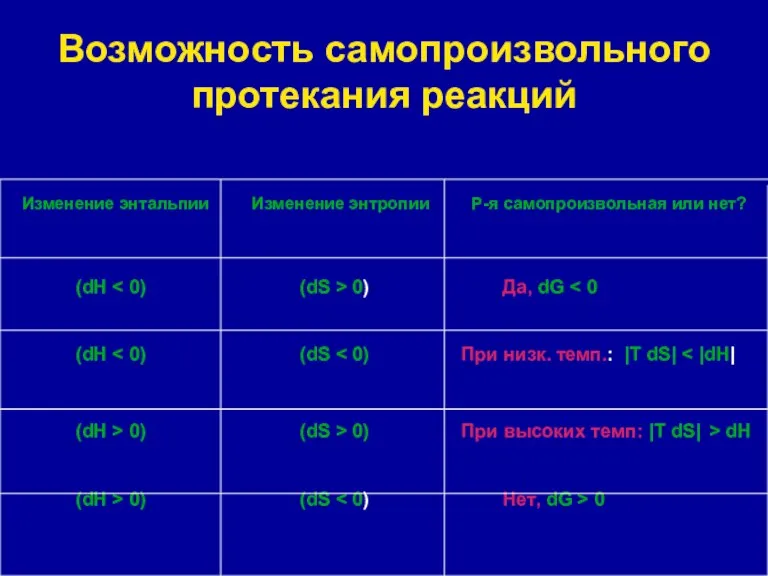
- 16. Возможность самопроизвольного протекания реакций Изменение энтальпии Изменение энтропии Р-я самопроизвольная или нет? (dH 0) Да, dG
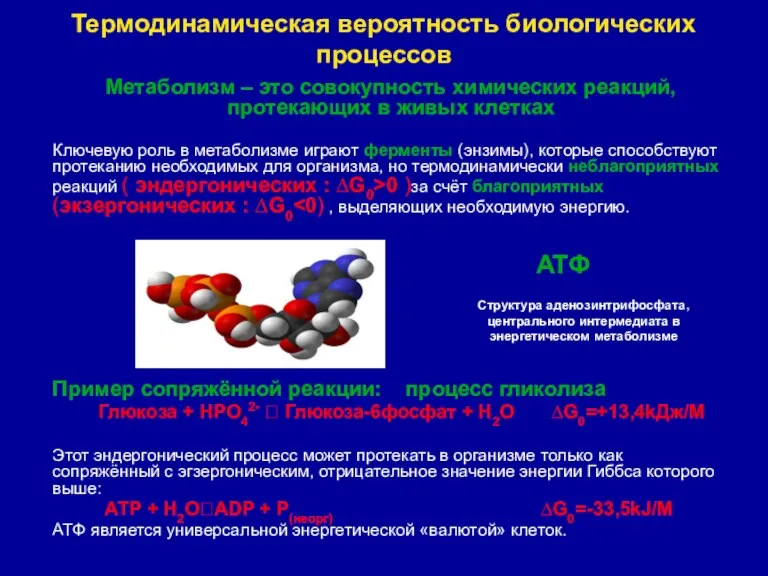
- 17. Термодинамическая вероятность биологических процессов Метаболизм – это совокупность химических реакций, протекающих в живых клетках Ключевую роль
- 19. Скачать презентацию














 Подшипники качения
Подшипники качения Изопроцессы в газах
Изопроцессы в газах Хроматография
Хроматография Дифузія навколо нас
Дифузія навколо нас Тепловые явления. Изменение агрегатных состояний вещества
Тепловые явления. Изменение агрегатных состояний вещества Расчет токов короткого замыкания. Лекция 9
Расчет токов короткого замыкания. Лекция 9 Квантовые постулаты Бора
Квантовые постулаты Бора Компрессордың қуаттылығы
Компрессордың қуаттылығы Холодильні машини
Холодильні машини Гидропневматическая подвеска в автомобиле
Гидропневматическая подвеска в автомобиле Урок физики Движение тела по наклонной плоскости
Урок физики Движение тела по наклонной плоскости Уравнение Менделеева-Клапейрона
Уравнение Менделеева-Клапейрона Постоянный электрический ток. (Лекция 5)
Постоянный электрический ток. (Лекция 5) Общие сведения о двигателях внутреннего сгорания
Общие сведения о двигателях внутреннего сгорания презентация Атмосферное давление
презентация Атмосферное давление Фазовое равновесие
Фазовое равновесие Презентация Искусственные спутники Земли, 9 класс
Презентация Искусственные спутники Земли, 9 класс Методы эффективного управления инверторами напряжения в приводах переменного тока
Методы эффективного управления инверторами напряжения в приводах переменного тока Статика. Дайте мне точку опоры, и я подниму Землю!
Статика. Дайте мне точку опоры, и я подниму Землю! Философские проблемы физики и астрономии
Философские проблемы физики и астрономии Филворд Известные ученые для 9 класса по физике
Филворд Известные ученые для 9 класса по физике Водяной пар и его свойства
Водяной пар и его свойства Вертолет Ми-8МТВ. Масляная система двигателя
Вертолет Ми-8МТВ. Масляная система двигателя Бүгінгі таңдағы физикалық жетістіктер. Өзінің қолтаңбасын қалдырған ғалым
Бүгінгі таңдағы физикалық жетістіктер. Өзінің қолтаңбасын қалдырған ғалым Изучение свойств магнита и его использование человеком
Изучение свойств магнита и его использование человеком Нагревание проводников электрическим током. Закон Джоуля – Ленца
Нагревание проводников электрическим током. Закон Джоуля – Ленца Физико-химические процессы разрушения деталей машин
Физико-химические процессы разрушения деталей машин Электрический ток в вакууме. Электроннолучевая трубка
Электрический ток в вакууме. Электроннолучевая трубка