Содержание
- 2. Твердое состояние вещества- это одно из агрегатных состояний вещества, отличающееся от других агрегатных состояний стабильностью формы
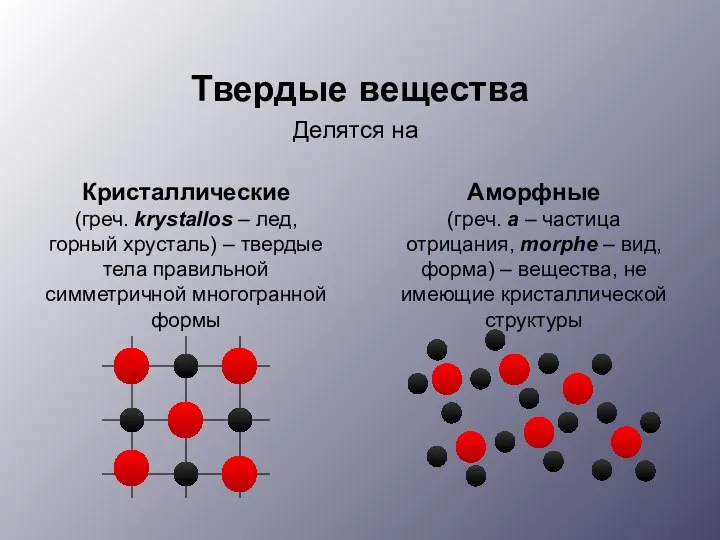
- 3. Кристаллические (греч. krуstallos – лед, горный хрусталь) – твердые тела правильной симметричной многогранной формы Аморфные (греч.
- 4. Аморфные вещества (стекло, шоколад, смолы) Излом ограничен овальными поверхностями. При нагревании постепенно размягчаются. Нет определенной температуры
- 5. Кристаллическое вещество образует кристаллы совершенно определенной формы. Кристаллическая решетка –пространственный каркас, который возникает, если обозначить все
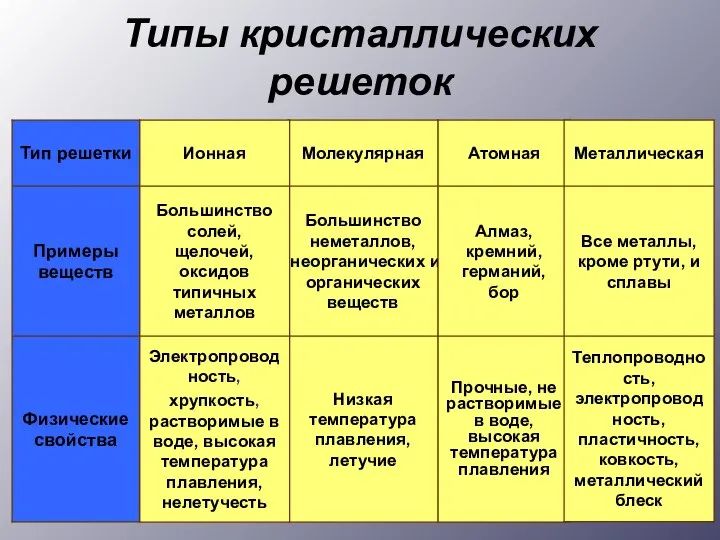
- 6. Типы кристаллических решеток
- 7. Кристаллические решетки Ионная Атомная Металлическая Молекулярная Промежуточная
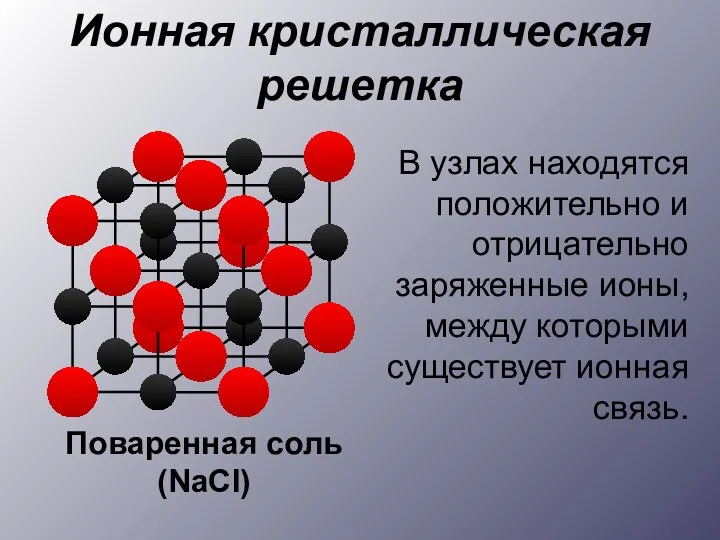
- 8. Ионная кристаллическая решетка В узлах находятся положительно и отрицательно заряженные ионы, между которыми существует ионная связь.
- 9. Примеры веществ: Соли, щелочи, оксиды типичных металлов Перманганат калия Оксид кальция Гидроксид калия
- 10. Основные свойства: Электропроводность В твердом состоянии ионы прочно связаны в решетке и не могут двигаться и
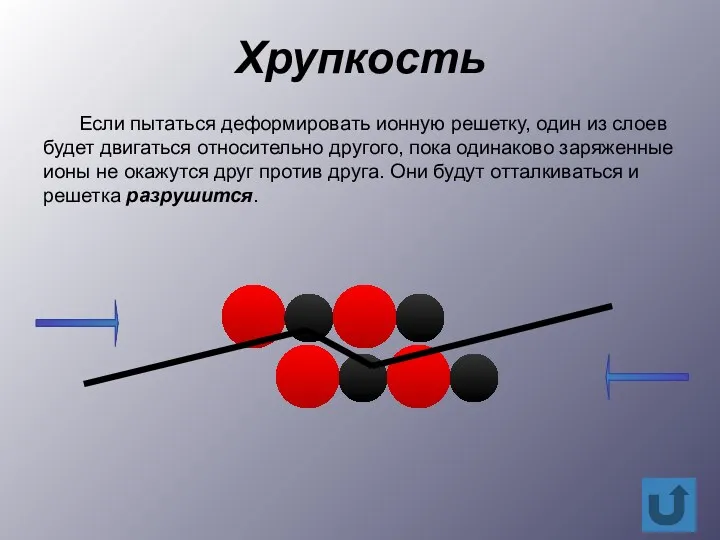
- 11. Хрупкость Если пытаться деформировать ионную решетку, один из слоев будет двигаться относительно другого, пока одинаково заряженные
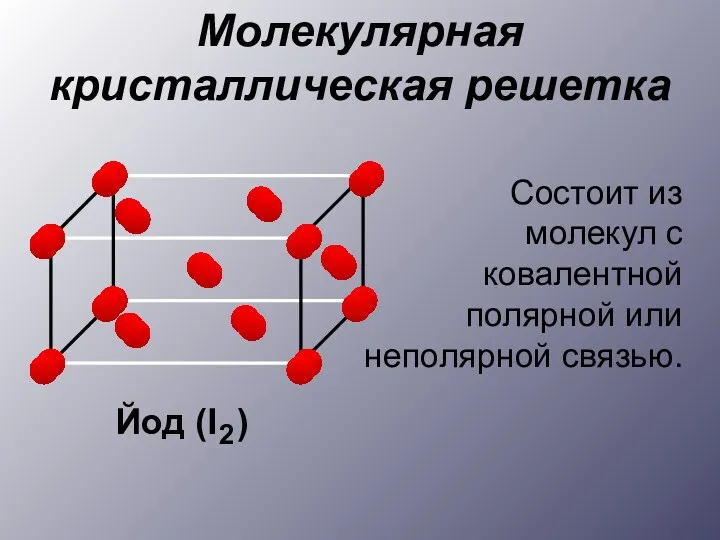
- 12. Молекулярная кристаллическая решетка Состоит из молекул с ковалентной полярной или неполярной связью.
- 13. Примеры веществ: Неметаллы, неорганические и органические вещества Хлорид фосфора (V) Бром Фенол
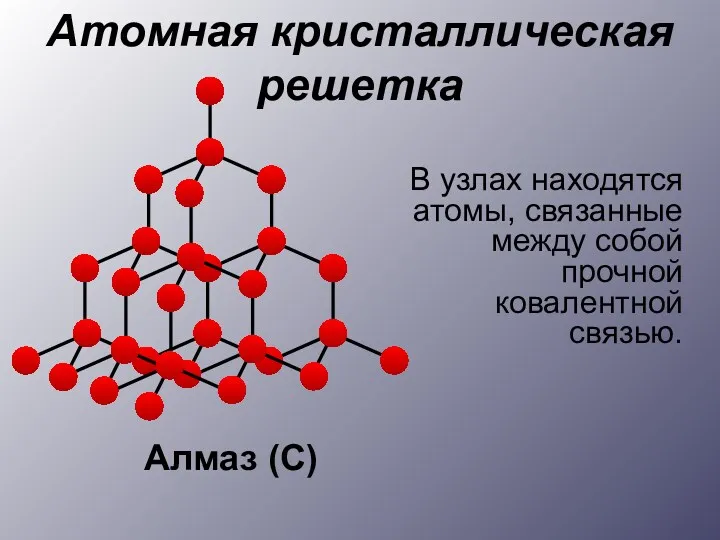
- 14. В узлах находятся атомы, связанные между собой прочной ковалентной связью. Атомная кристаллическая решетка Алмаз (С)
- 15. Алмаз Бор Германий Примеры веществ:
- 16. Металлическая кристаллическая решетка В узлах находятся отдельные атомы и положительные ионы, между которыми существует металлическая связь.
- 17. Металлы и сплавы Бериллий Чугун (коррозия) Латунь
- 18. – Электропроводность + В металлической решетке присутствует большое число делокализованных внешних электронов. Если к металлу приложить
- 19. Пластичность, ковкость Металлы можно изгибать и изменять их форму, при этом не разрушая. Способность удлиняться при
- 21. Скачать презентацию












 Давление. Единицы давления. Способы уменьшения и увеличения давления
Давление. Единицы давления. Способы уменьшения и увеличения давления Двигатели внутреннего сгорания
Двигатели внутреннего сгорания Фізичні характеристики Сонця
Фізичні характеристики Сонця Способ установки фаркопа для легковых автомобилей категории М1 и его сертификация
Способ установки фаркопа для легковых автомобилей категории М1 и его сертификация Импульс, закон сохранения импульса
Импульс, закон сохранения импульса ИК-спектроскопия
ИК-спектроскопия Электромагнитное излучение. Свойства излучения Электромагнитное излучение, исследуемое в астрофизике
Электромагнитное излучение. Свойства излучения Электромагнитное излучение, исследуемое в астрофизике Механика твердого тела. (Лекция 4)
Механика твердого тела. (Лекция 4) Физические основы воздействия на атмосферные процессы. Реагенты
Физические основы воздействия на атмосферные процессы. Реагенты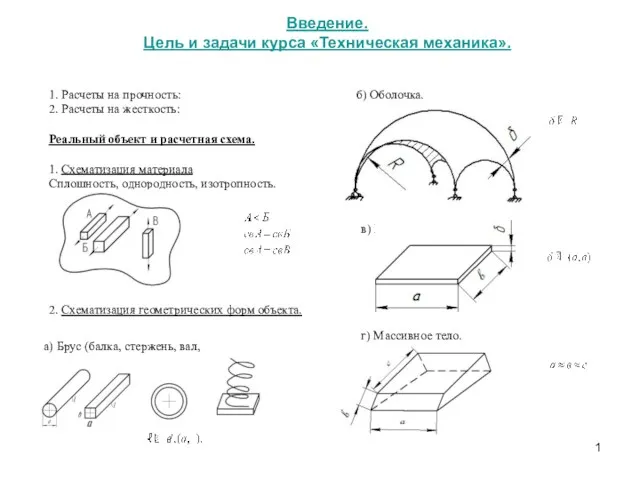 Цель и задачи курса Техническая механика. Расчеты на прочность. Расчеты на жесткость
Цель и задачи курса Техническая механика. Расчеты на прочность. Расчеты на жесткость Электронная презентация Изопроцессы в идеальном газе
Электронная презентация Изопроцессы в идеальном газе Теплотехника. Термодинамика открытых систем
Теплотехника. Термодинамика открытых систем Электрический ток в металлах. Электролитическая диссоциация. Электролиз
Электрический ток в металлах. Электролитическая диссоциация. Электролиз Энергия. Работа. Мощность
Энергия. Работа. Мощность NW Rapid Site Installation
NW Rapid Site Installation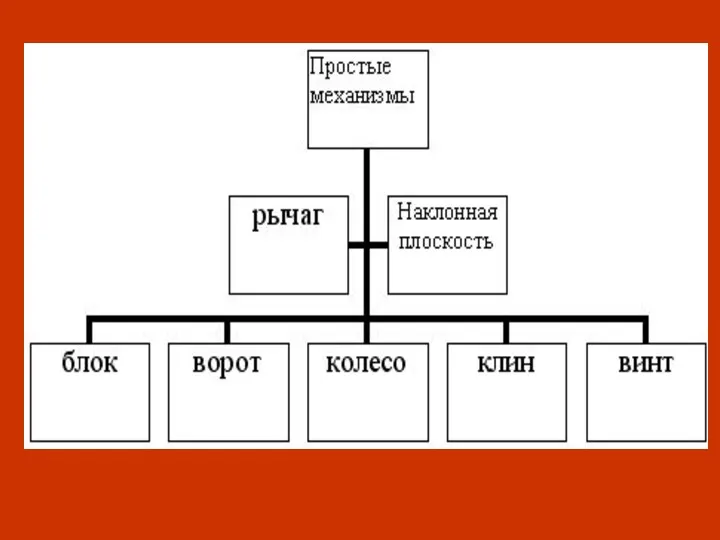 Простые механизмы
Простые механизмы Гетерогенный химический процесс система газ твердое
Гетерогенный химический процесс система газ твердое Стоячие волны
Стоячие волны Конспект урока по физике в 7 классе Сообщающиеся сосуды
Конспект урока по физике в 7 классе Сообщающиеся сосуды Сила трения
Сила трения Механизмы переноса тепла: теплопроводность, конвекция, излучение
Механизмы переноса тепла: теплопроводность, конвекция, излучение Сила трения. Особенности сил трения
Сила трения. Особенности сил трения Закон сохранения энергии, 7 класс
Закон сохранения энергии, 7 класс Огляд конструкцій плугів спец. призначення. Огляд конструкцій фрезерних машин, ямокопачів, площадкоутворювачів. Лекція 4 (ч. 2)
Огляд конструкцій плугів спец. призначення. Огляд конструкцій фрезерних машин, ямокопачів, площадкоутворювачів. Лекція 4 (ч. 2) Ремонт и сборка зубчатых передач
Ремонт и сборка зубчатых передач Система единиц СИ. Векторные и скалярные величины
Система единиц СИ. Векторные и скалярные величины Основні закономірності термодинаміки. Термостатика та термодинаміка. Лекція 1
Основні закономірності термодинаміки. Термостатика та термодинаміка. Лекція 1 Ректификация үдерісі
Ректификация үдерісі