Содержание
- 2. Устойчивость дисперсной системы – неизменность во времени ее основных параметров: дисперсности и равномерного распределения частиц дисперсной
- 3. Факторы агрегативной устойчивости Электростатический – наличие ДЭС на поверхности частиц. Адсорбционно - сольватный – всякая коллоидная
- 4. Коагуляция – процесс разрушения коллоидных систем за счет слипания частиц, образования более крупных агрегатов с потерей
- 5. Коагуляция золей электролитами Основным фактором, вызывающим коагуляцию, является действие на коллоидный раствор электролитов. Эмпирические правила электролитной
- 6. Коагулирующая способность электролита (Р) - величина, обратная порогу коагуляции: Влияние заряда иона коагулятора (правило Шульце-Гарди): коагулирующая
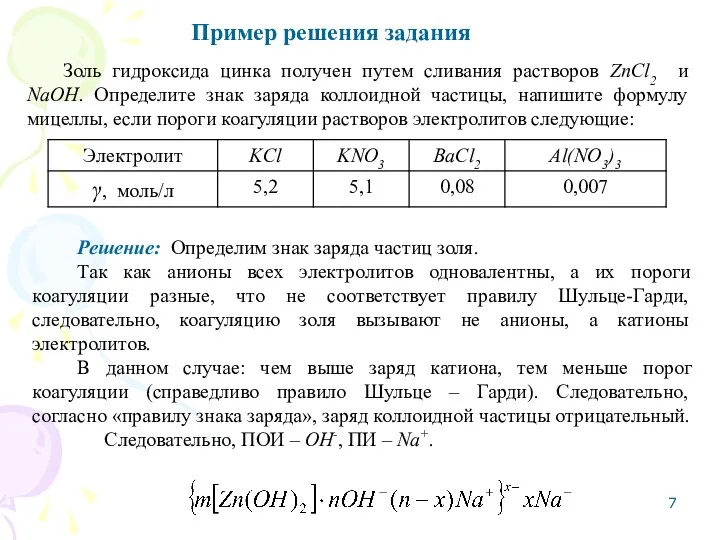
- 7. Пример решения задания Золь гидроксида цинка получен путем сливания растворов ZnCl2 и NaOH. Определите знак заряда
- 8. Теория устойчивости лиофобных дисперсных систем ДЛФО (DLVO) 1937 – 1941 гг. Теория ДЛФО (Б.В.Дерягин, Л.Д.Ландау, Е.Фервей,
- 9. Задачи теории Объяснить механизм коагуляции. Теоретически обосновать правило Шульце – Гарди. Объяснить связь между значением электрокинетического
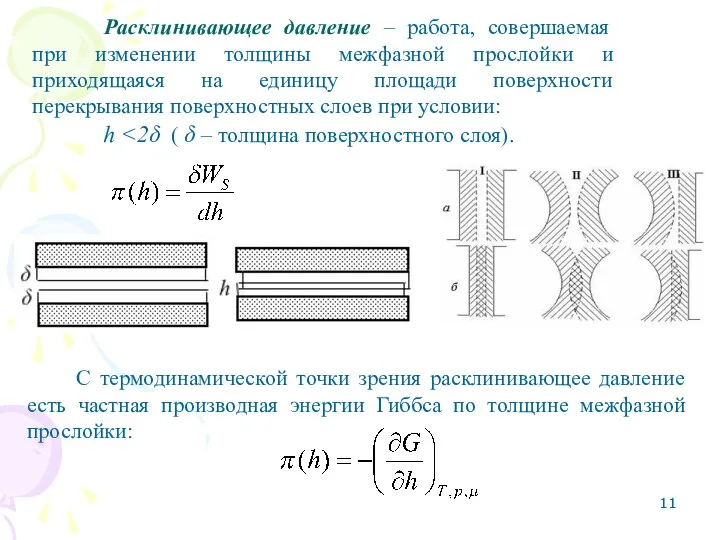
- 10. Расклинивающее давление Расклинивающее давление (π) – избыточное давление, возникающее в межфазной прослойке жидкости при достаточном ее
- 11. Расклинивающее давление – работа, совершаемая при изменении толщины межфазной прослойки и приходящаяся на единицу площади поверхности
- 12. Составляющие расклинивающего давления Молекулярная составляющая (πм) – обусловлена силами притяжения Ван–дер–Вальса, действующими между ядрами мицелл. Электростатическая
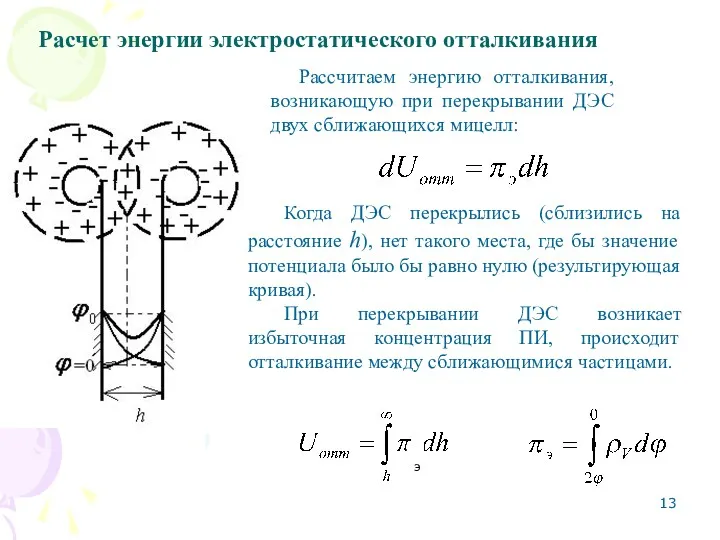
- 13. Расчет энергии электростатического отталкивания Рассчитаем энергию отталкивания, возникающую при перекрывании ДЭС двух сближающихся мицелл: Когда ДЭС
- 14. Для слабозаряженных золей (φ0 Для сильнозаряженных золей (φ0 > 100 мВ): В общем случае: Энергия отталкивания
- 15. Расчет энергии притяжения Притяжение между частицами обусловлено силами Ван-дер-Ваальса, включающие три составляющие: ориентационное, индукционное и дисперсионное
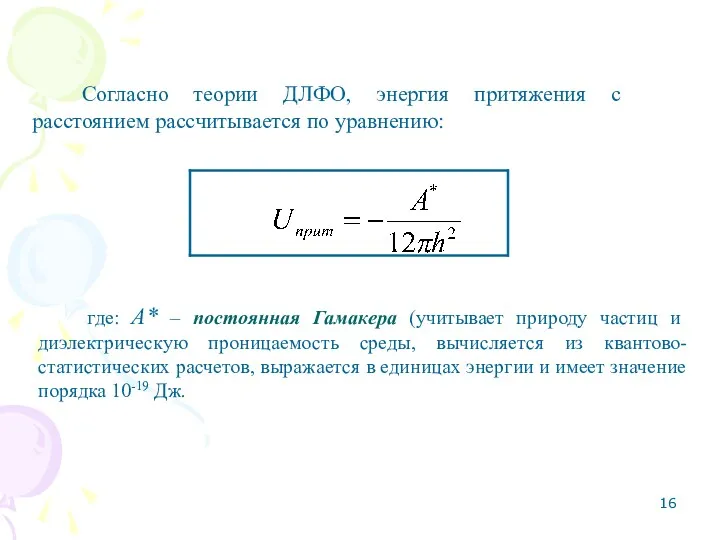
- 16. Согласно теории ДЛФО, энергия притяжения с расстоянием рассчитывается по уравнению: где: А* – постоянная Гамакера (учитывает
- 17. Потенциальные кривые взаимодействия частиц Взаимодействие двух частиц дисперсной фазы характеризуют с помощью потенциальных кривых – зависимостей
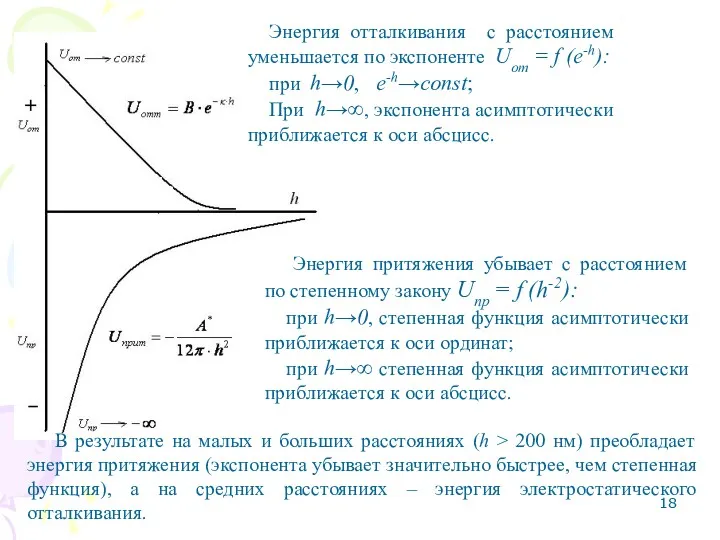
- 18. Энергия притяжения убывает с расстоянием по степенному закону Uпр = f (h-2): при h→0, степенная функция
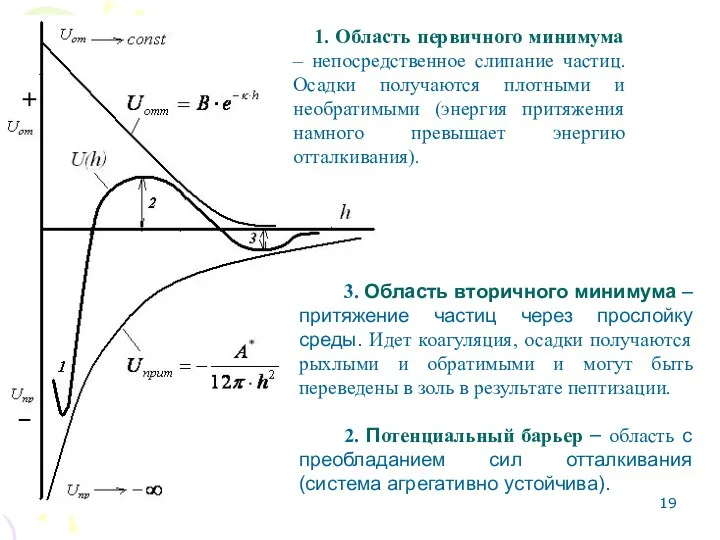
- 19. 3. Область вторичного минимума – притяжение частиц через прослойку среды. Идет коагуляция, осадки получаются рыхлыми и
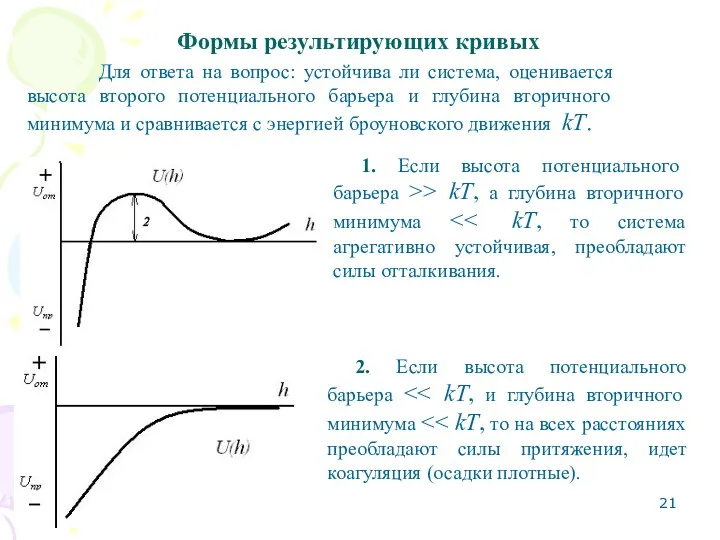
- 21. Формы результирующих кривых Для ответа на вопрос: устойчива ли система, оценивается высота второго потенциального барьера и
- 22. 3. Если глубина вторичного минимума >> kT, то не зависимо от высоты потенциального барьера возникает дальнее
- 23. Концентрационная коагуляция Концентрационная коагуляция характерна для сильно заряженных золей (φ0 > 100 мВ) при добавлении индифферентного
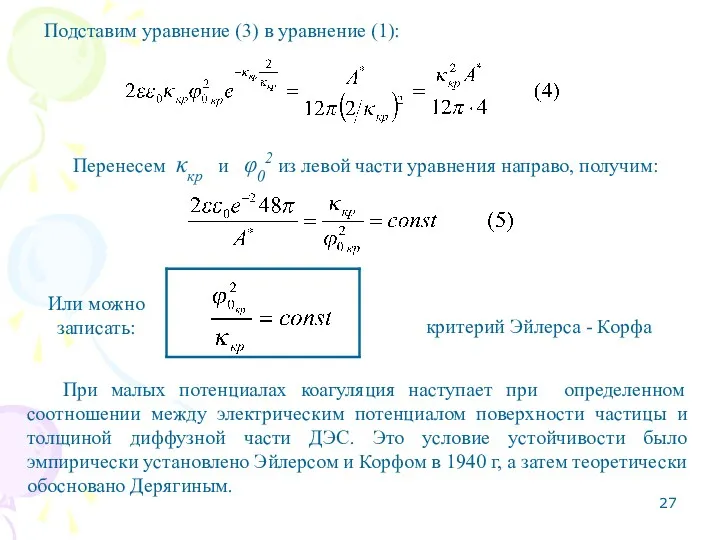
- 24. Подставим уравнение (3) в уравнение (1): Перенесем κкр из левой части уравнения направо, получим: Подставим вместо
- 25. В правой части уравнения константы, тогда запишем: Возведем уравнение (4) в квадрат, получим: Закон шестой степени
- 26. Нейтрализационная коагуляция Нейтрализационная коагуляция характерна для слабо заряженных золей (φ0 Неиндифферентные электролиты частично нейтрализуют φ0, что
- 27. Подставим уравнение (3) в уравнение (1): Перенесем κкр и φ02 из левой части уравнения направо, получим:
- 28. Подставим в уравнение (5) вместо κкр его значение из теории Гуи-Чепмена: Получим: Перенесем все константы налево,
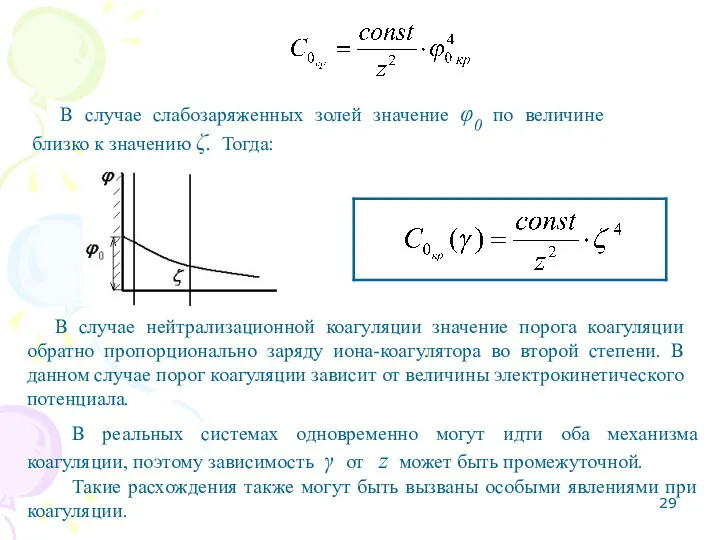
- 29. В случае слабозаряженных золей значение φ0 по величине близко к значению ζ. Тогда: В случае нейтрализационной
- 30. Значение теории ДЛФО 1. Теория ДЛФО объяснила механизм коагуляции. В соответствии с теорией ДЛФО введение электролита
- 31. Скорость коагуляции Скорость коагуляции υ - это изменение концентрации коллоидных частиц в единицу времени при постоянном
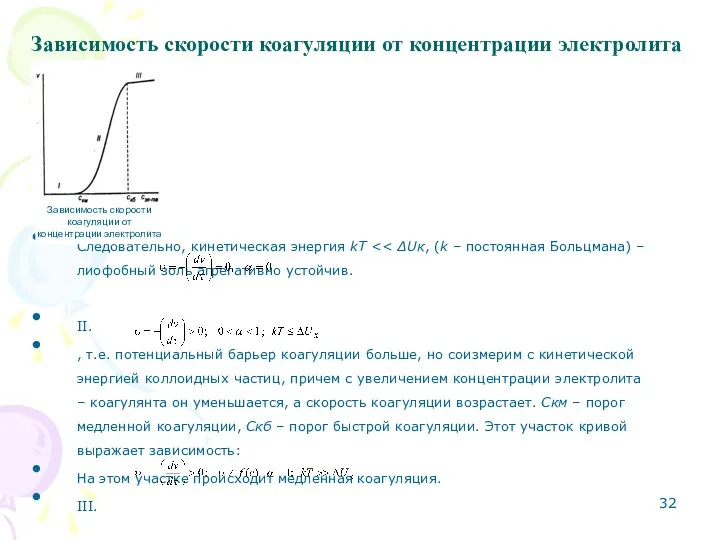
- 32. Зависимость скорости коагуляции от концентрации электролита I. Следовательно, кинетическая энергия kТ II. , т.е. потенциальный барьер
- 33. Теория быстрой коагуляции где υ0 – концентрация частиц золя в начальный момент времени; υt – концентрация
- 34. Теория быстрой коагуляции Согласно теории быстрой коагуляции, константа коагуляции зависит от коэффициента диффузии и может быть
- 35. Теория медленной коагуляции Медленная коагуляция связана с неполной эффективностью столкновений вследствие существования энергетического барьера. Простое введение
- 36. Пять факторов устойчивости коллоидных систем Известны пять факторов устойчивости, среди которых два первых играют главную роль.
- 37. Коагуляция смесью электролитов В промышленных условиях коагуляцию проводят смесью электролитов. Коагулирующее действие смеси электролитов часто бывает
- 38. Одним из вариантов коагуляции является процесс структурообразования. Структурообразование - вариант коагуляции, протекающий при больших концентрациях дисперсной
- 39. Тиксотропия – способность системы восстанавливать структуру во времени после ее механического разрушения. Например, масляная краска благодаря
- 41. Скачать презентацию




























 Исследовательская работа Посудомоечная машина
Исследовательская работа Посудомоечная машина Изопроцессы в газах
Изопроцессы в газах Метрология. Законодательная метрология
Метрология. Законодательная метрология Low-Band Receive Antennas
Low-Band Receive Antennas Вид деформации растяжение-сжатие
Вид деформации растяжение-сжатие Газовые законы
Газовые законы Адаев Презхентация
Адаев Презхентация Физические основы работы оптических волокон
Физические основы работы оптических волокон Физико-химические методы анализа
Физико-химические методы анализа Резисторы. Основные параметры резисторов
Резисторы. Основные параметры резисторов Динамика твердого тела
Динамика твердого тела Инструментальные методы качественного анализа неорганических веществ
Инструментальные методы качественного анализа неорганических веществ Экзамен ПМ 01. Билет № 12. Сборка неподвижных соединений с натягом
Экзамен ПМ 01. Билет № 12. Сборка неподвижных соединений с натягом Затухающие и вынужденные колебания. Резонанс
Затухающие и вынужденные колебания. Резонанс Ускорители заряженных частиц. Магнитное поле
Ускорители заряженных частиц. Магнитное поле Молекулярно-кинетическая теория газов. (Тема 10)
Молекулярно-кинетическая теория газов. (Тема 10) Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1
Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1 Силы в природе
Силы в природе Основні відомості про теорію машин та механізмів
Основні відомості про теорію машин та механізмів Презентация для урока физики 9 класс Холодильник. Экологические проблемы использования тепловых машин.
Презентация для урока физики 9 класс Холодильник. Экологические проблемы использования тепловых машин. Формирование и первичная обработка видеосигналов
Формирование и первичная обработка видеосигналов Трехфазные цепи
Трехфазные цепи Physical chemistry of nanostructured systems (lecture no. 5)
Physical chemistry of nanostructured systems (lecture no. 5) Қысым
Қысым Физика – основа естествознания
Физика – основа естествознания Применение приёмов развития критического мышления на уроках физики
Применение приёмов развития критического мышления на уроках физики Биоэлектрлік құбылыстар. Биопотенциалдар табиғаты туралы қазіргі кездегі көзқарас
Биоэлектрлік құбылыстар. Биопотенциалдар табиғаты туралы қазіргі кездегі көзқарас Электрическое поле и его напряженность. Принцип суперпозиции полей точечных зарядов
Электрическое поле и его напряженность. Принцип суперпозиции полей точечных зарядов