Внутренняя энергия. Работа расширения. Теплота. Аналитическое выражение первого закона термодинамики. (Занятие 2) презентация
Содержание
- 2. Внутренняя энергия (U) Фильм 21
- 3. Внутренняя энергия (U) U = Uк + Uп + Uо + Uя Uк=f(T) Uп=f(V) Uо=0 Uя=0
- 4. Внутренняя энергия (U) Фильм 23
- 5. Свойства внутренней энергии 1. U=f(состояния тела) => U=f(V,P,T) 2. свойство аддитивности. U=U1+ U2+… 3. u=U/М [Дж/кг]
- 6. Работа расширения (L) - форма передачи энергии в ТД процессе Фильм 24
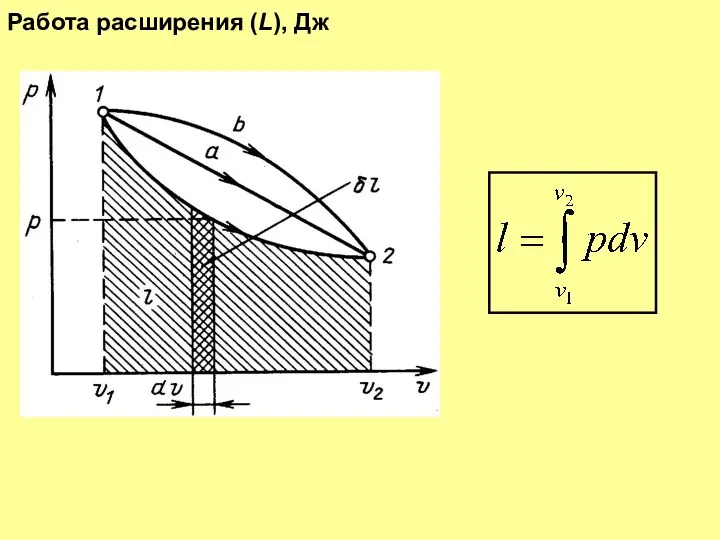
- 7. Работа расширения (L), Дж
- 8. Работа расширения (L) Свойства : L=f(процесса) 2. Макрофизическая форма передачи энергии в ТД процессе 3. l=L/М
- 9. Теплота (Q), Дж (q, дж/кг) Фильм 25 - форма передачи энергии на микрофизическом уровне
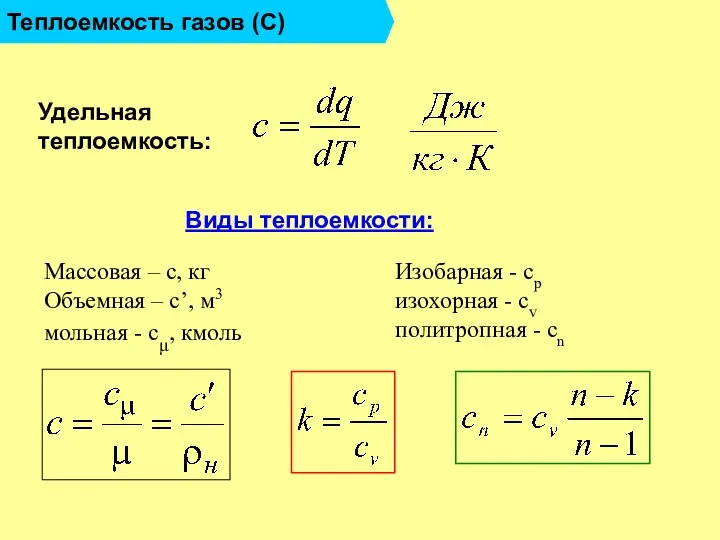
- 10. Теплоемкость газов (С) - количество теплоты, которое необходимо подвести или отвести от единицы рабочего тела для
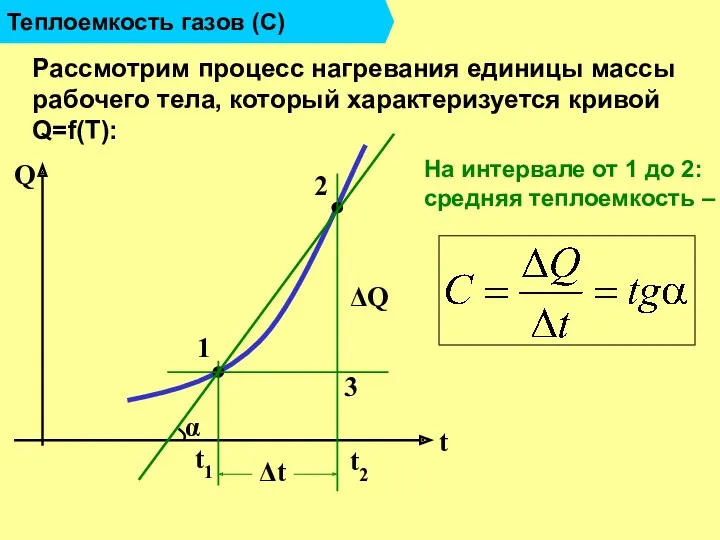
- 11. Теплоемкость газов (С) Рассмотрим процесс нагревания единицы массы рабочего тела, который характеризуется кривой Q=f(T): 1 2
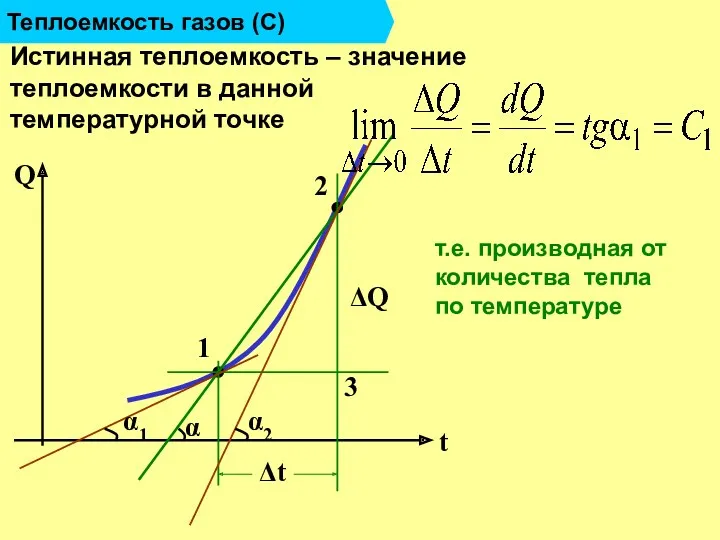
- 12. Теплоемкость газов (С) Истинная теплоемкость – значение теплоемкости в данной температурной точке 1 2 3 ΔQ
- 13. Теплоемкость газов (С) Расход тепла в процессе: 1. Через среднюю теплоемкость: 2. Через истинную теплоемкость:
- 14. Теплоемкость газов (С) Массовая – с, кг Объемная – с’, м3 мольная - сμ, кмоль Удельная
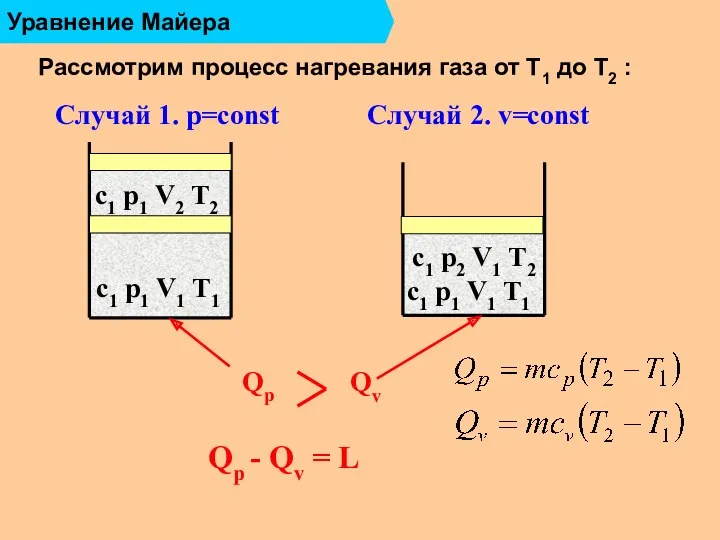
- 15. Уравнение Майера Рассмотрим процесс нагревания газа от Т1 до Т2 : Случай 1. p=const Qp c1
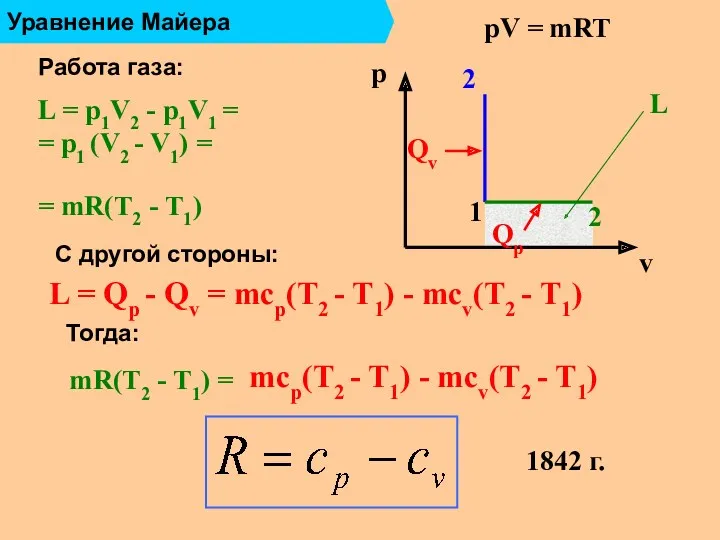
- 16. Уравнение Майера Работа газа: Qp Qv L = p1V2 - p1V1 = = p1 (V2 -
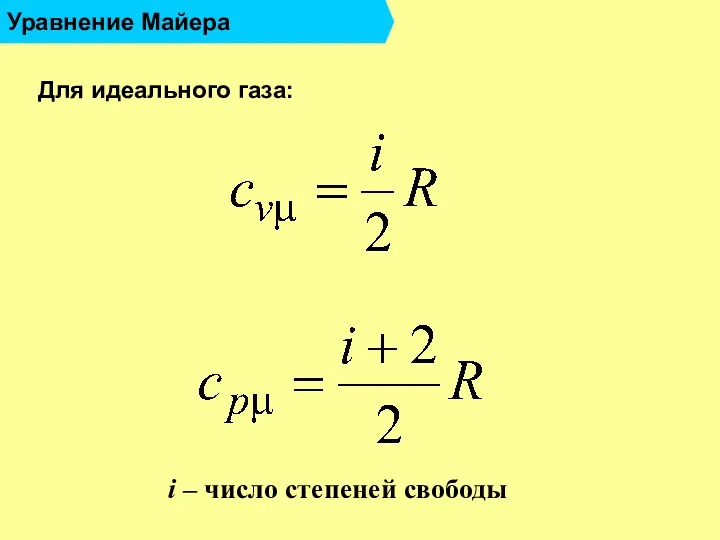
- 17. Уравнение Майера Для идеального газа: i – число степеней свободы
- 18. Уравнение Майера Коэффициент Пуассона:
- 19. Энтальпия (i) u + pv = i [Дж/кг] I = U + pV [Дж] Функция состояния
- 20. Первый закон термодинамики Е=const Полная энергия изолированной термодинамической системы при любых происходящих в системе процессах остается
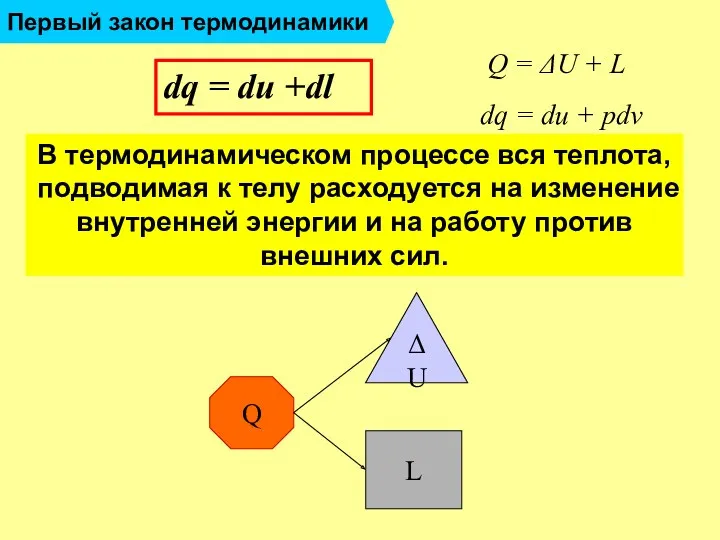
- 21. Первый закон термодинамики dq = du +dl dq = du + pdv Q = ΔU +
- 23. Скачать презентацию









![Энтальпия (i) u + pv = i [Дж/кг] I =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/347762/slide-18.jpg)

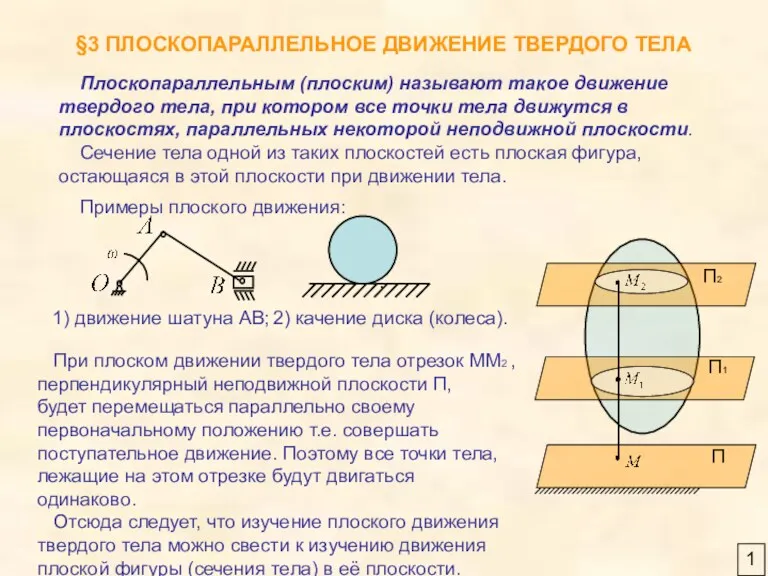 Плоскопараллельное движение твердого тела
Плоскопараллельное движение твердого тела Сопротивление материалов. Курс лекций
Сопротивление материалов. Курс лекций Робототехника. Робот-дворник
Робототехника. Робот-дворник Явление электромагнитной индукции
Явление электромагнитной индукции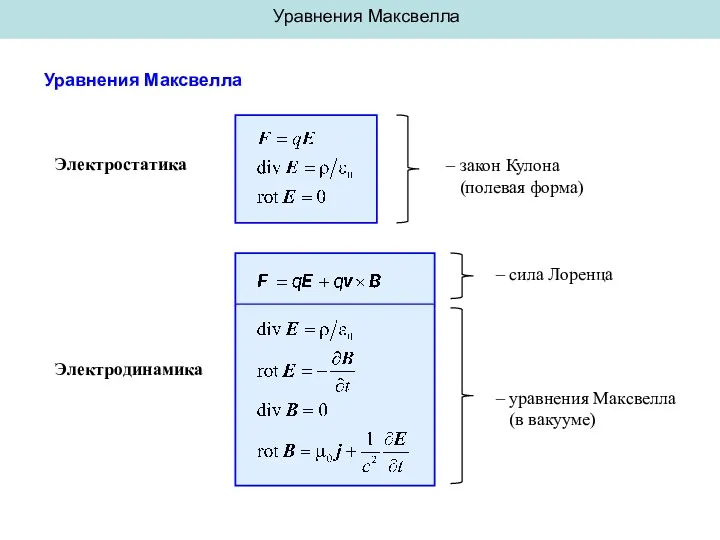 Уравнения Максвелла
Уравнения Максвелла Система автоматического управления
Система автоматического управления Следствия из уравнений Максвелла: распространение ЭМВ в пространстве, свойства ЭМВ
Следствия из уравнений Максвелла: распространение ЭМВ в пространстве, свойства ЭМВ Электротехника. Электрическое поле. Электрические и магнитные цепи. Анализ и расчет электрических цепей
Электротехника. Электрическое поле. Электрические и магнитные цепи. Анализ и расчет электрических цепей Основы аэродинамики и динамики полёта. Занятие 1
Основы аэродинамики и динамики полёта. Занятие 1 Измерение длины световой волны с помощью дифракционной решётки. Лабораторная работа №22:
Измерение длины световой волны с помощью дифракционной решётки. Лабораторная работа №22: Технология мини-исследования на уроках физики
Технология мини-исследования на уроках физики Однородный полупроводник
Однородный полупроводник Электротехника и электроника. Методы расчета сложных линейных цепей постоянного тока. (Лекция 2)
Электротехника и электроника. Методы расчета сложных линейных цепей постоянного тока. (Лекция 2) Термодинамика и теплопередача. Внутренняя энергия
Термодинамика и теплопередача. Внутренняя энергия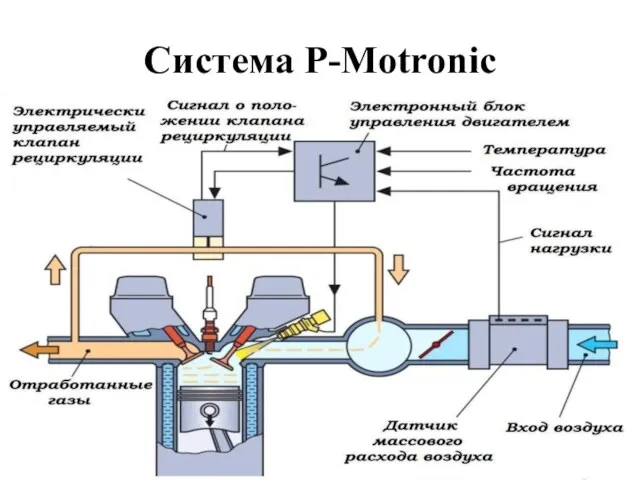 Система P-Motronic
Система P-Motronic Технический осмотр и ремонт ходовой части автомобиля. Подвеска
Технический осмотр и ремонт ходовой части автомобиля. Подвеска Урок + презентация. Тема: Сила Ампера
Урок + презентация. Тема: Сила Ампера Lektsia_7_PolyarizatsiaMalyus-Bryuster
Lektsia_7_PolyarizatsiaMalyus-Bryuster Маломощные радиостанции КВ диапазона. Тактико-технические данные радиостанции Р-130М. (Тема 4.1)
Маломощные радиостанции КВ диапазона. Тактико-технические данные радиостанции Р-130М. (Тема 4.1) Первое начало термодинамики
Первое начало термодинамики Основы классической термодинамики. Первое начало термодинамики. (Лекция 10)
Основы классической термодинамики. Первое начало термодинамики. (Лекция 10) Динамика поступательного движения
Динамика поступательного движения Назначение и состав космического комплекса. Лекция №2
Назначение и состав космического комплекса. Лекция №2 Скорость при равномерном движении
Скорость при равномерном движении Цепи синусоидального напряжения
Цепи синусоидального напряжения Определение плотности куска мыла
Определение плотности куска мыла Изотопы. Радиоактивные превращения атомных ядер
Изотопы. Радиоактивные превращения атомных ядер Плавание тел в жидкости
Плавание тел в жидкости