Содержание
- 2. Аміни - органічні похідні аміаку NH3, в молекулі якого один, два або три атоми гідрогену заміщені
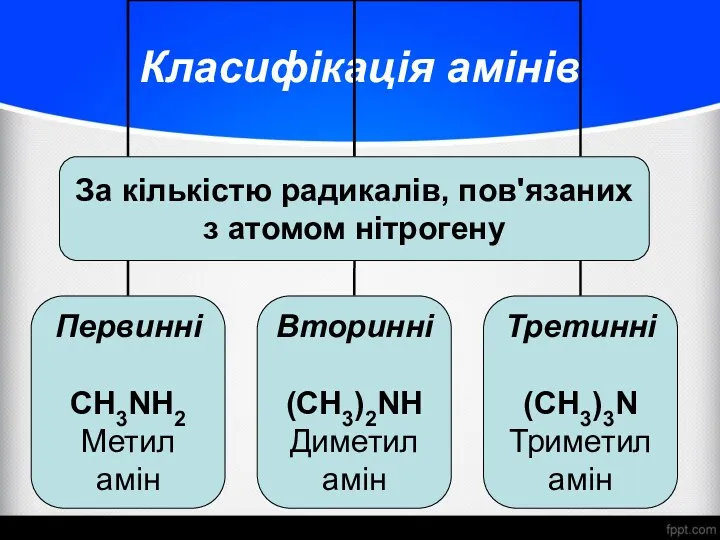
- 3. Класифікація амінів
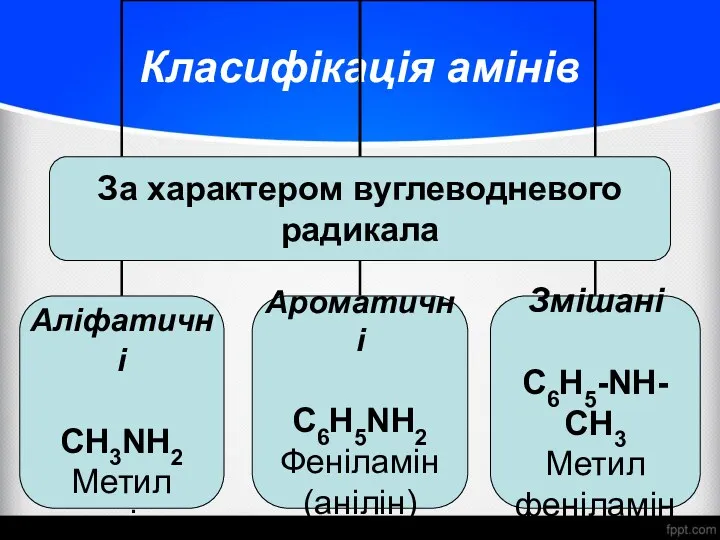
- 4. Класифікація амінів
- 5. Номенклатура амінів. У більшості випадків назви амінів утворюють з назв вуглеводневих радикалів і суфікса амін. Різні
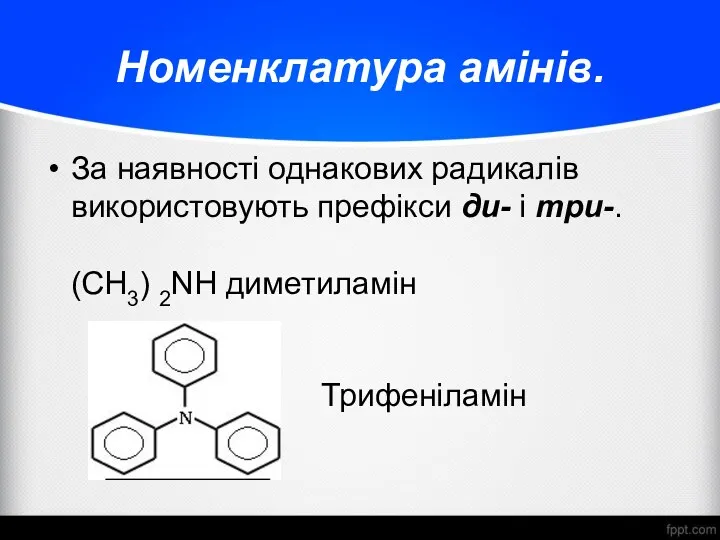
- 6. Номенклатура амінів. За наявності однакових радикалів використовують префікси ди- і три-. (CH3) 2NH диметиламін Трифеніламін
- 7. Номенклатура амінів. Первинні аміни часто називають як похідні вуглеводнів, у молекулах яких один або кілька атомів
- 8. Ізомерія амінів. Структурна ізомерія : А) карбонового ланцюгу, починаючи з С4H9NH2: н.бутил амін втор.бутиламін трет.бутил амін
- 9. Ізомерія амінів. Структурна ізомерія : Б) положення аміногрупи, починаючи зС3H7NH2: пропан амін -1 пропан амін -
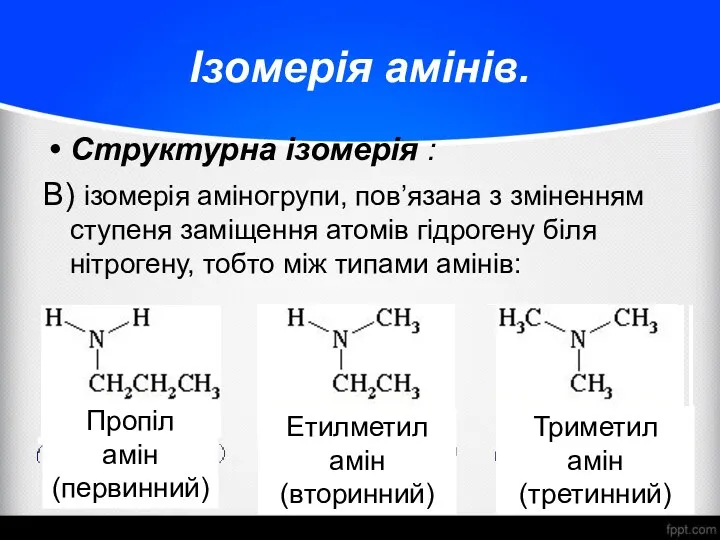
- 10. Ізомерія амінів. Структурна ізомерія : В) ізомерія аміногрупи, пов’язана з зміненням ступеня заміщення атомів гідрогену біля
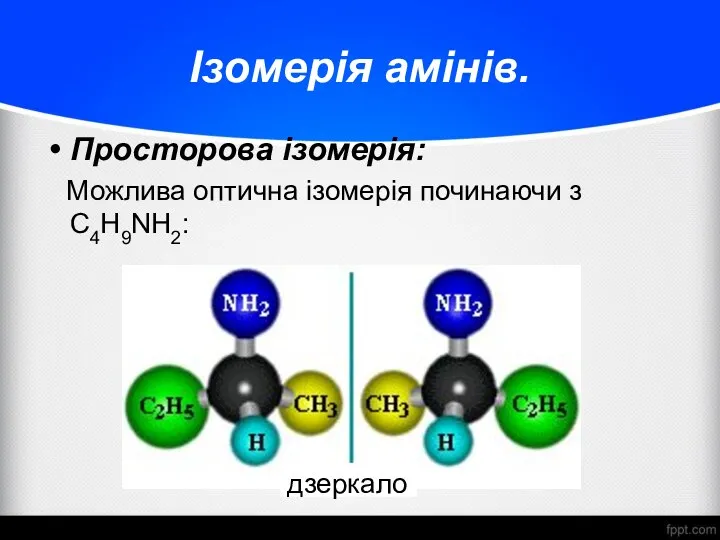
- 11. Ізомерія амінів. Просторова ізомерія: Можлива оптична ізомерія починаючи з С4H9NH2: дзеркало
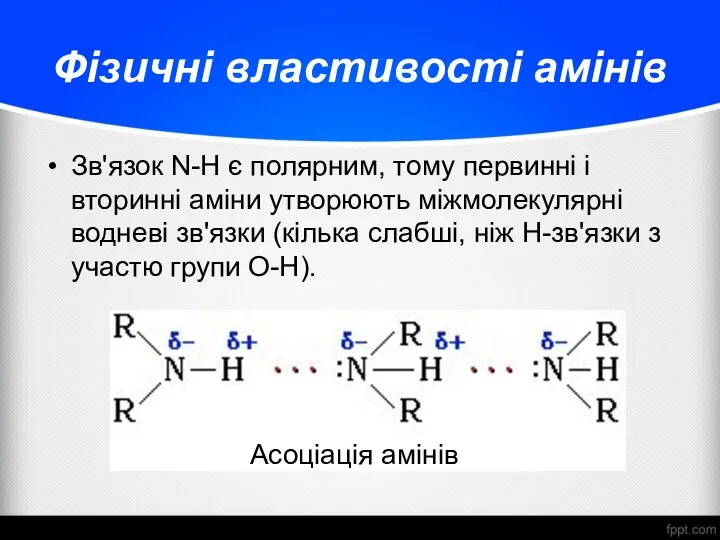
- 12. Фізичні властивості амінів Зв'язок N-H є полярним, тому первинні і вторинні аміни утворюють міжмолекулярні водневі зв'язки
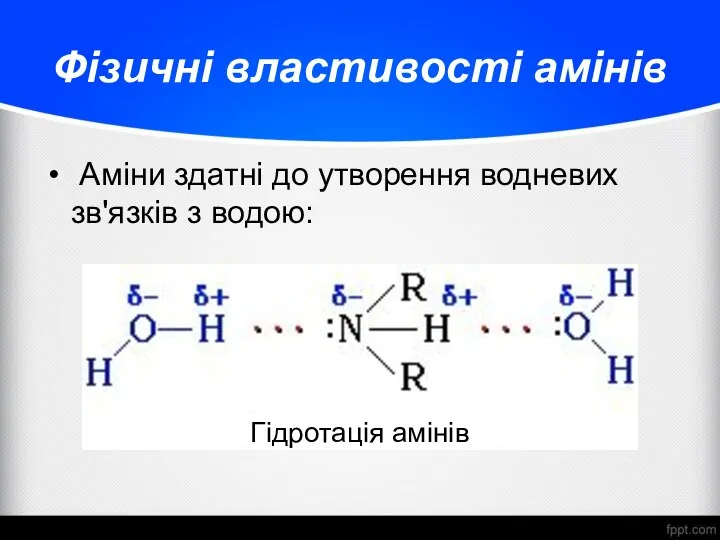
- 13. Фізичні властивості амінів Аміни здатні до утворення водневих зв'язків з водою: Гідротація амінів
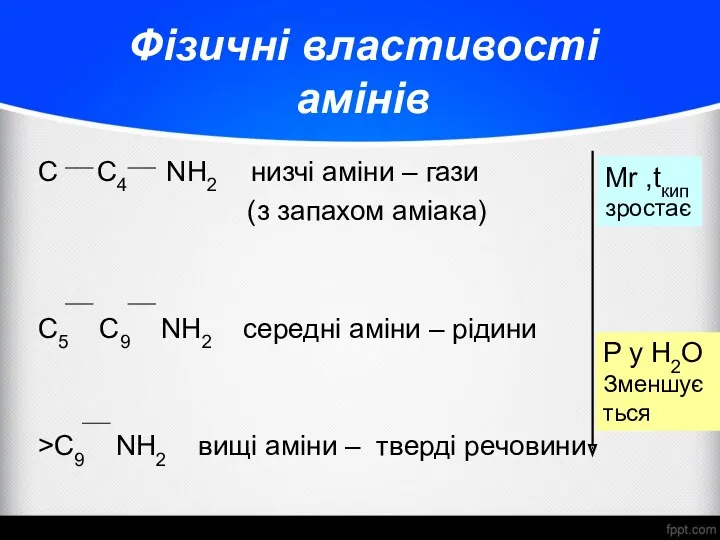
- 14. Фізичні властивості амінів C C4 NH2 низчі аміни – гази (з запахом аміака) C5 C9 NH2
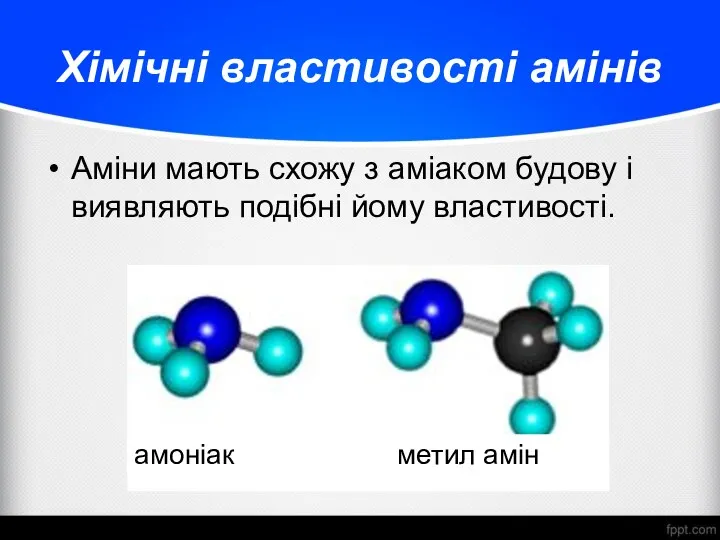
- 15. Хімічні властивості амінів Аміни мають схожу з аміаком будову і виявляють подібні йому властивості. амоніак метил
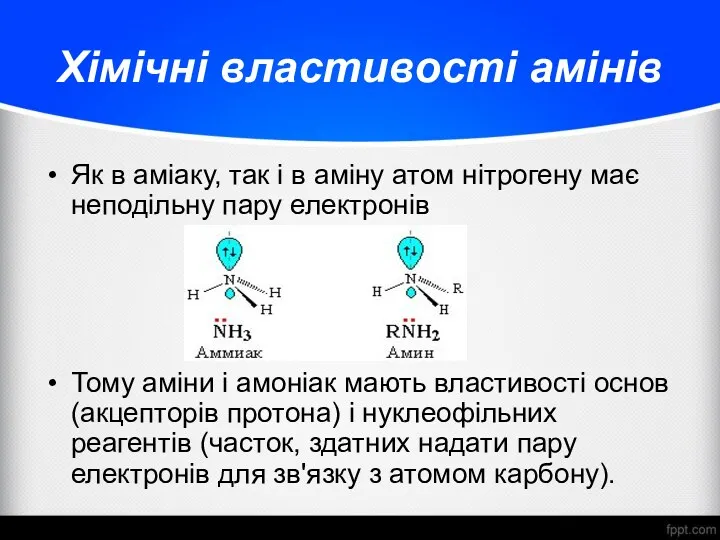
- 16. Хімічні властивості амінів Як в аміаку, так і в аміну атом нітрогену має неподільну пару електронів
- 17. Хімічні властивості амінів 1. Водні розчини аліфатичних амінів проявляють лужну реакцію, тому що при їх взаємодії
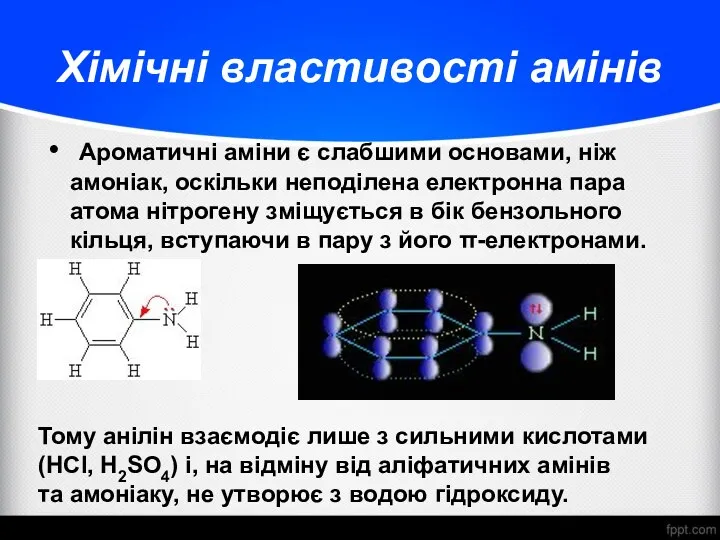
- 18. Хімічні властивості амінів Ароматичні аміни є слабшими основами, ніж амоніак, оскільки неподілена електронна пара атома нітрогену
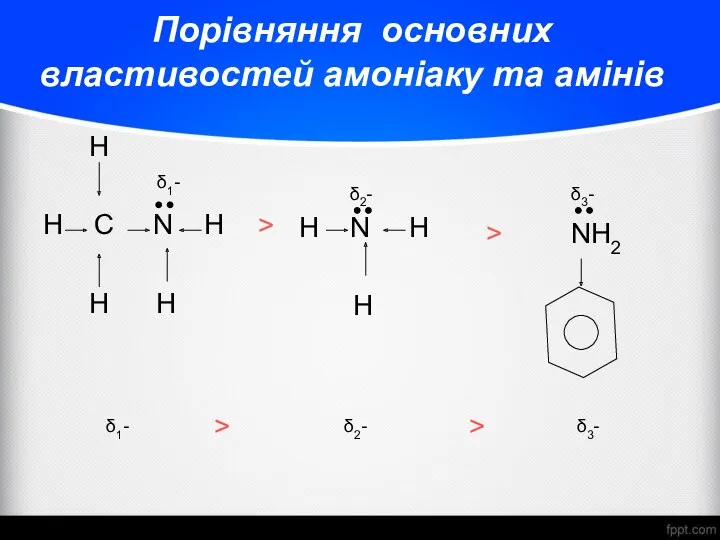
- 19. Порівняння основних властивостей амоніаку та амінів H H C N H H H δ1- δ2- H
- 20. Хімічні властивості амінів Взаємодіючи з кислотами, аміни утворюють солі: хлорид метил амонію Солі амінів - тверді
- 21. Хімічні властивості амінів Окислення амінів Аліфатичні аміни окислюються під дією сильних окислювачів. На відміну від амоніаку,
- 22. Хімічні властивості амінів Ароматичні аміни легко окислюються навіть киснем повітря. Будучи в чистому вигляді безбарвними речовинами,
- 23. Хімічні властивості амінів Взаємодія з нітритною кислотою А) Первинні аліфатичні аміни з HNO2 утворюють спирти. Характерною
- 24. Хімічні властивості амінів Взаємодія з нітритною кислотою Б) Вторинні аміни (аліфатичні, ароматичні і змішані) під дією
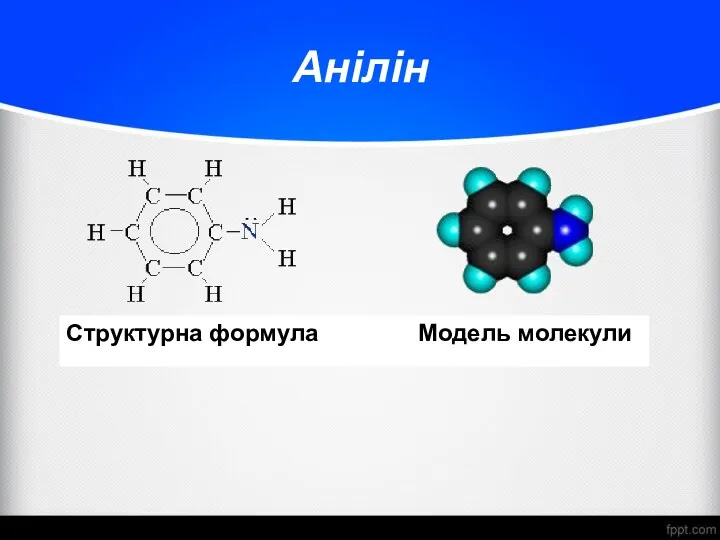
- 25. Анілін Структурна формула Модель молекули
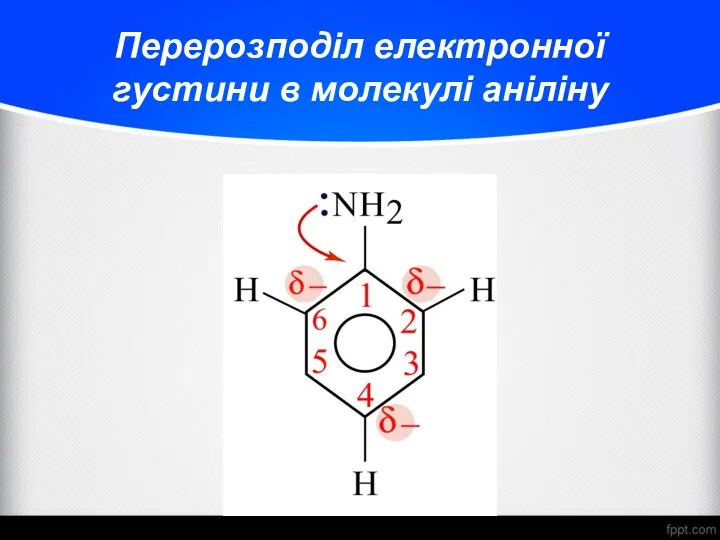
- 26. Перерозподіл електронної густини в молекулі аніліну
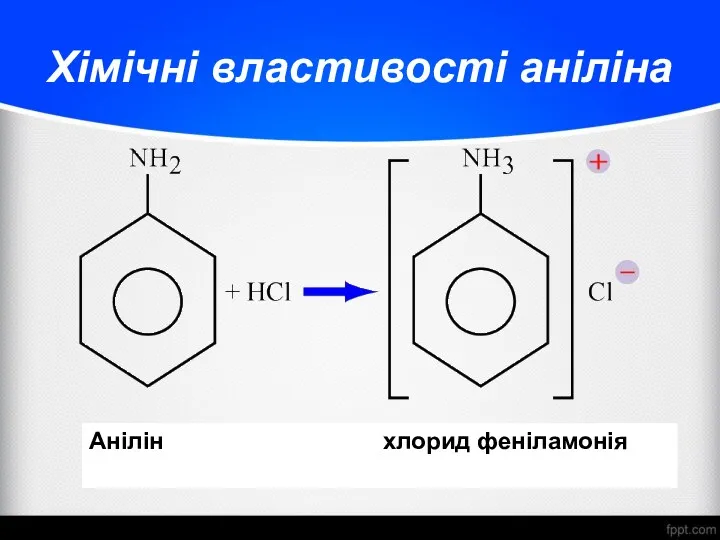
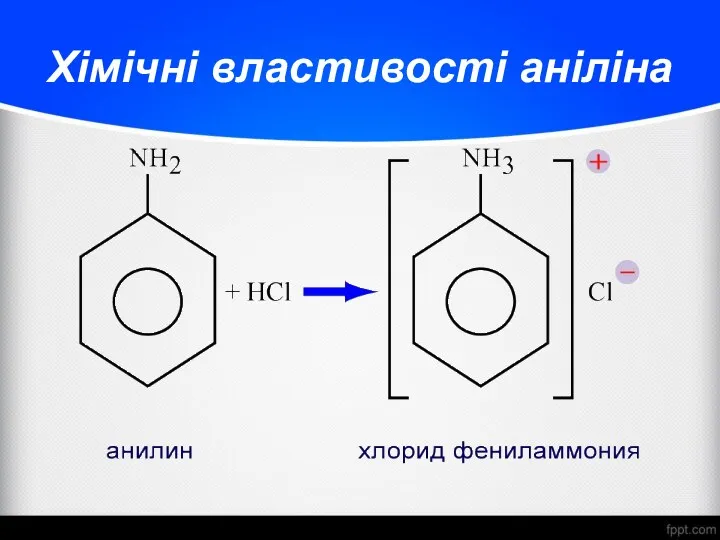
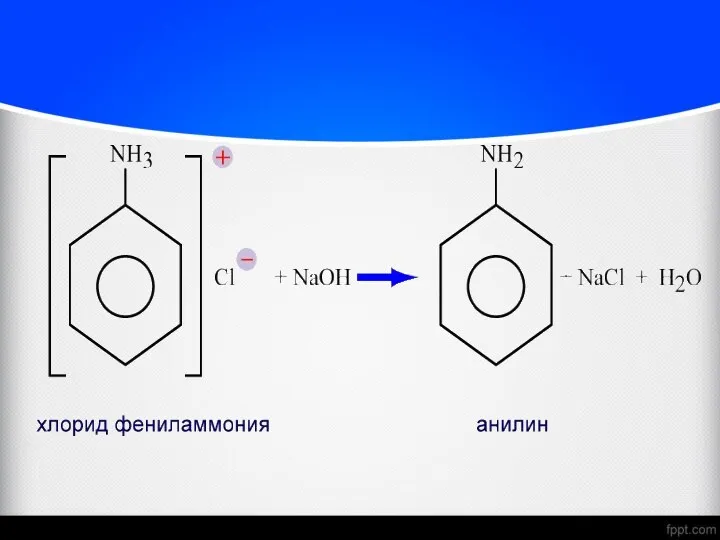
- 27. Хімічні властивості аніліна Анілін хлорид феніламонія
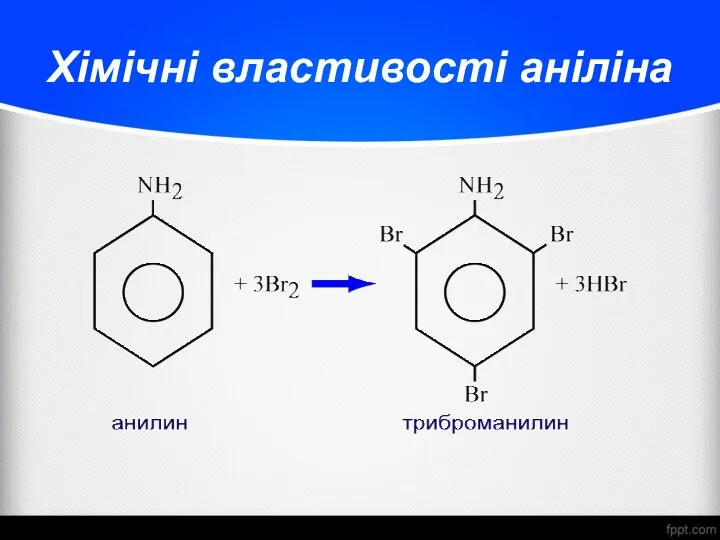
- 28. Хімічні властивості аніліна
- 30. Хімічні властивості аніліна
- 31. Способи одержання амінів CH3CL + 2NH3 CH3 NH2 + NH4CL C6H5 NO2 C6H5 NH2 СН3 -
- 33. Скачать презентацию












 Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов Химический элемент титан
Химический элемент титан Химическая термодинамика
Химическая термодинамика Обзор электродных процессов
Обзор электродных процессов Азотсодержащие органические соединения
Азотсодержащие органические соединения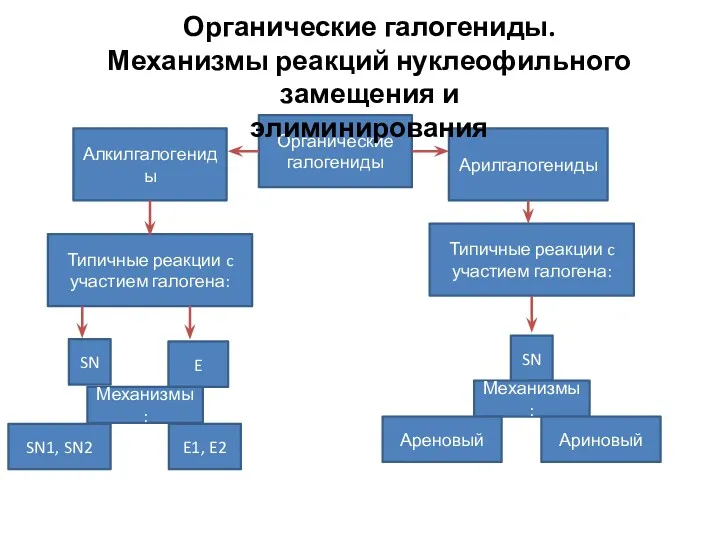
 Никель – тяжелый металл
Никель – тяжелый металл Хром. Строение атома
Хром. Строение атома ЕГЭ по химии. Решение задач 27, 28, 29
ЕГЭ по химии. Решение задач 27, 28, 29 Технология производства бутилкаучука
Технология производства бутилкаучука Катализ кислотами и основаниями. Лекция 3
Катализ кислотами и основаниями. Лекция 3 Силикатное производство
Силикатное производство серная кислота и ее соли 9 класс
серная кислота и ее соли 9 класс Химическая кинетика
Химическая кинетика Арены - ароматические соединения
Арены - ароматические соединения Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Воздух, которым мы дышим
Воздух, которым мы дышим Жуғыш заттардың адам өміріндегі маңызы
Жуғыш заттардың адам өміріндегі маңызы Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии
Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Коррозия металлов
Коррозия металлов Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Кислород. Открытие кислорода
Кислород. Открытие кислорода Lipid metabolism
Lipid metabolism Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение