Содержание
- 2. Антиген - клетка или вещество, несущие признак генетической чужеродности и способные индуцировать иммунный ответ в организме.
- 3. Виды антигенов собственные клетки организма с генетическими мутациями отжившие клетки собственного организма клетки организмов других видов,
- 4. В практике понятие АГ имеет несколько значений первое — это генетически чужеродное для данного организма вещество
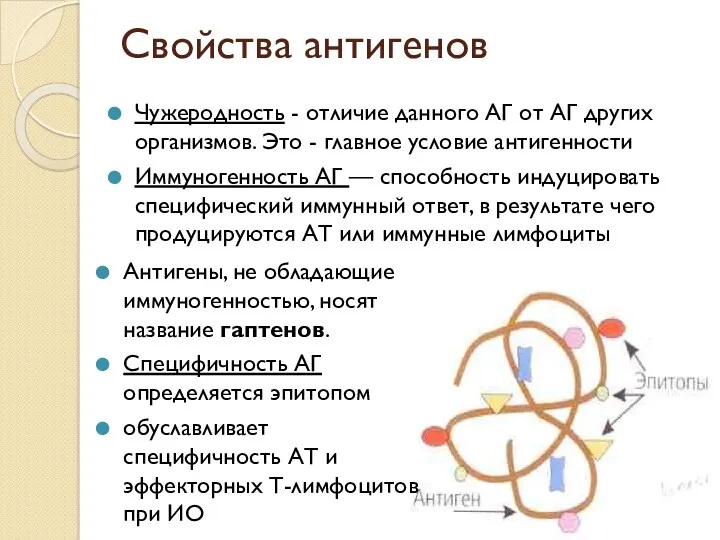
- 5. Свойства антигенов Чужеродность - отличие данного АГ от АГ других организмов. Это - главное условие антигенности
- 6. Антигены по способу распознавания PAMP – патогенассоциированные молекулярные паттерны (образы) – распознаются клетками врожденного ИО Антигенные
- 7. Патогенассоциированные молекулярные паттерны Образы патогенности, или патогенассоциированные молекулярные паттерны (Pathogen-associated molecular patterns— PAMP) — группы молекул,
- 8. Рецепторы, распознающие патогены (PRR) Наибольшее количество и наиболее широкий спектр PRR экспрессируют миелоидные клетки врожденного иммунитета.
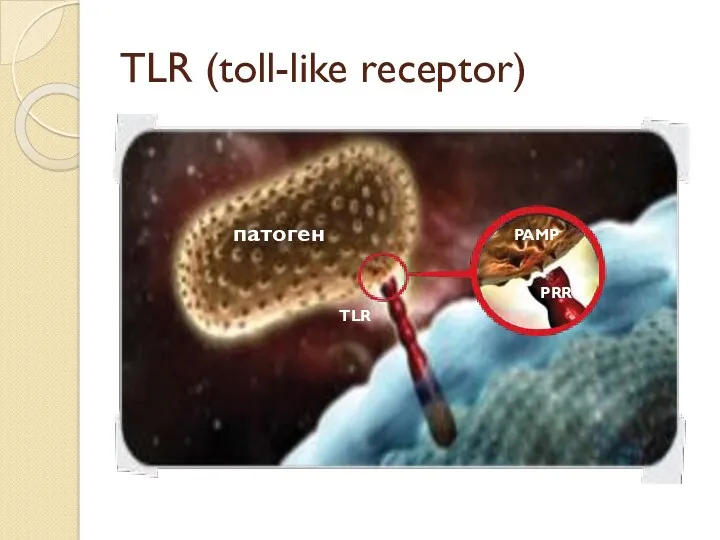
- 9. TLR (toll-like receptor) патоген TLR PAMP PRR
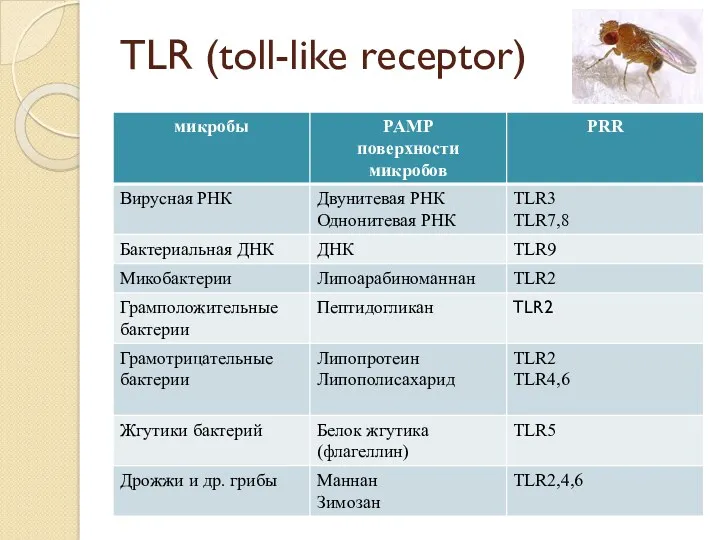
- 10. TLR (toll-like receptor)
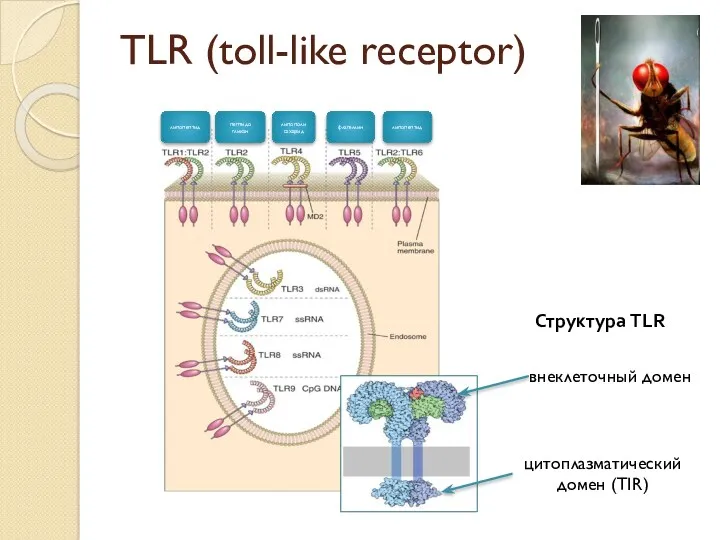
- 11. TLR (toll-like receptor) липопептид липополисахарид флагеллин пептидо гликан липопептид Структура TLR внеклеточный домен цитоплазматический домен (TIR)
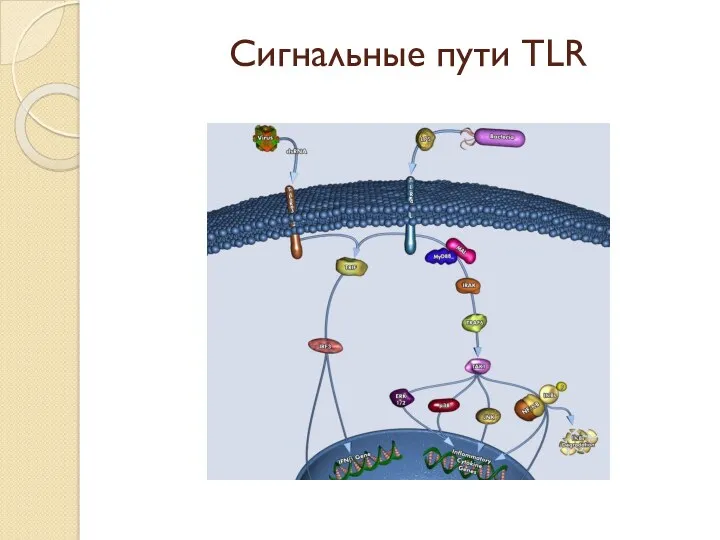
- 12. Сигнальные пути TLR
- 13. Антигенные детерминанты Высокомолекулярные соединения, способны специфически стимулировать иммунокомпетентные лимфоидные клетки и обеспечивать тем самым развитие ИО.
- 14. Антигенраспознающие рецепторы (АRR) представлены только на В- и Т-лимфоцитах. Важная особенность этих рецепторов — гигантская вариабельность
- 15. В-клеточные рецепторы На В-клетках представлены В-клеточные рецепторы (BCR — B-cell reseptors), имеющие иммуноглобулиновую природу При дифференцировке
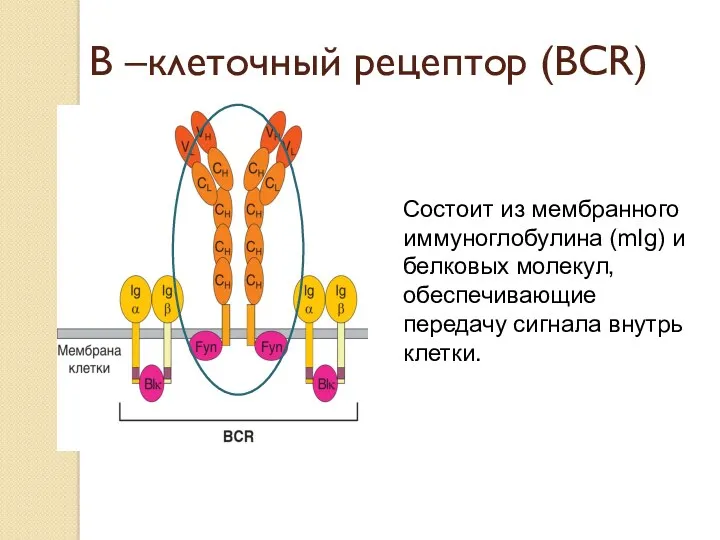
- 16. В –клеточный рецептор (ВСR) Состоит из мембранного иммуноглобулина (mIg) и белковых молекул, обеспечивающие передачу сигнала внутрь
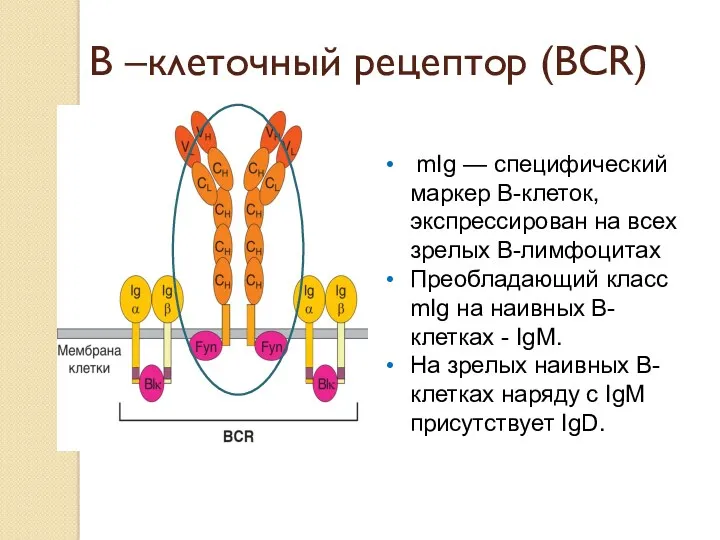
- 17. В –клеточный рецептор (ВСR) mIg — специфический маркер В-клеток, экспрессирован на всех зрелых В-лимфоцитах Преобладающий класс
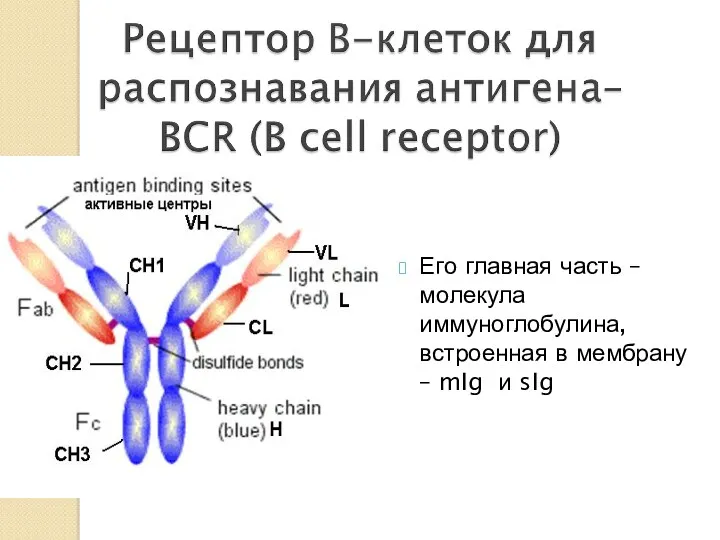
- 18. Его главная часть – молекула иммуноглобулина, встроенная в мембрану – mIg и sIg
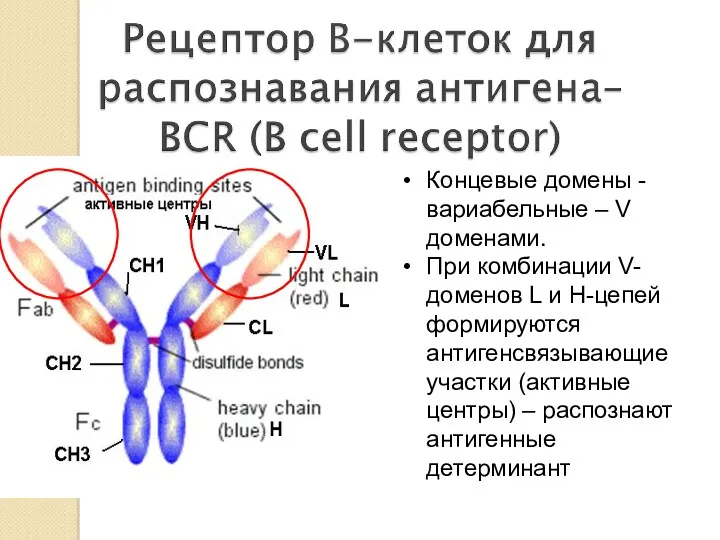
- 19. Концевые домены -вариабельныe – V доменами. При комбинации V-доменов L и H-цепей формируются антигенсвязывающие участки (активные
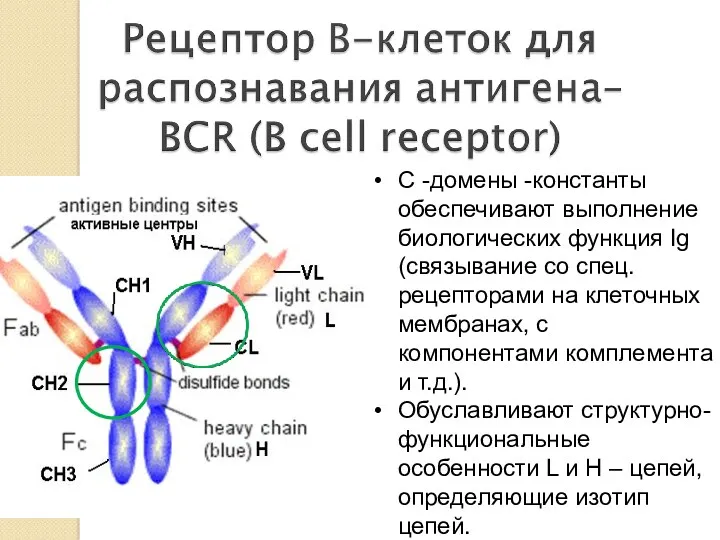
- 20. С -домены -константы обеспечивают выполнение биологических функция Ig (связывание со спец. рецепторами на клеточных мембранах, с
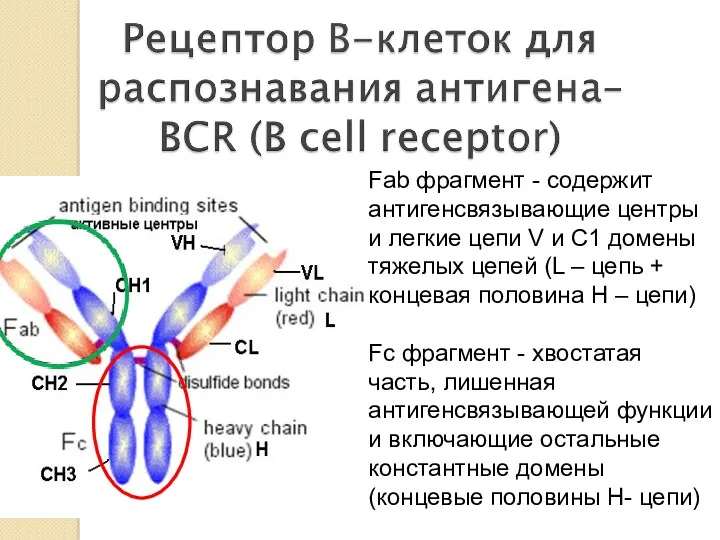
- 21. Fab фрагмент - содержит антигенсвязывающие центры и легкие цепи V и С1 домены тяжелых цепей (L
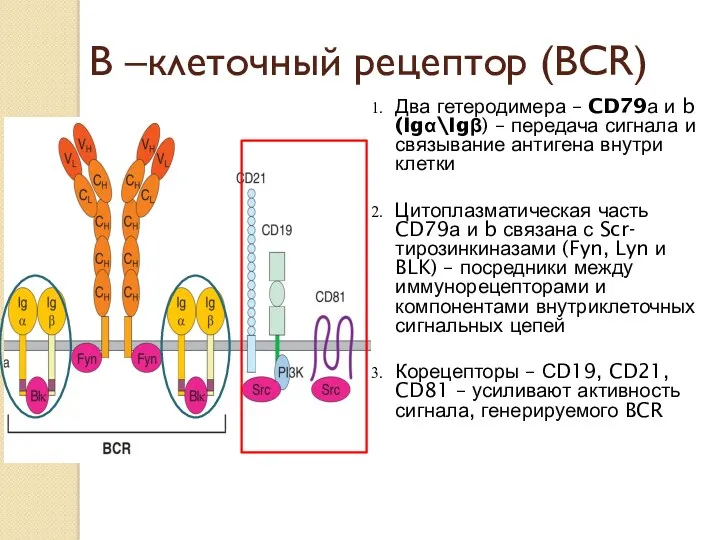
- 22. В –клеточный рецептор (ВСR) Два гетеродимера – CD79а и b (Igα\Igβ) – передача сигнала и связывание
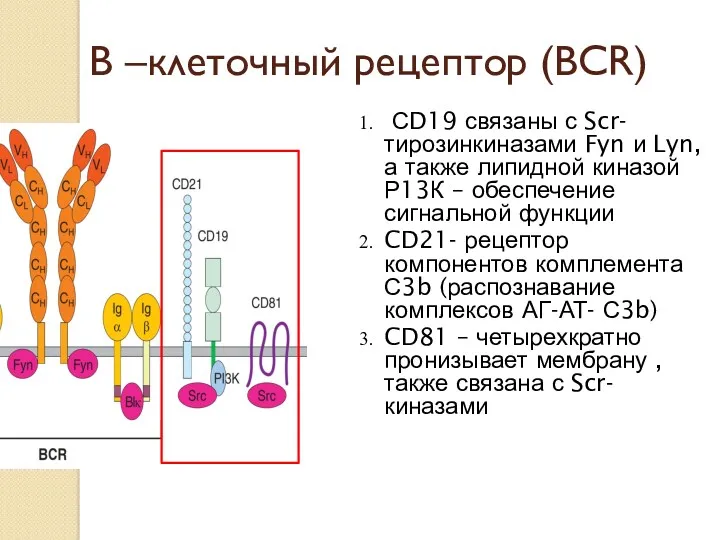
- 23. В –клеточный рецептор (ВСR) СD19 связаны с Scr- тирозинкиназами Fyn и Lyn, а также липидной киназой
- 24. рецепторы равномерно располагаются на поверхности В-лимфоцитов; рецепторы обладают подвижностью и могут перемещаться по поверхности В-лимфоцита (присоединение
- 25. Т-клеточные рецепторы Т-клеточные рецепторы (TCR — T-cell receptor) существуют в двух вариантах. По названию входящих в
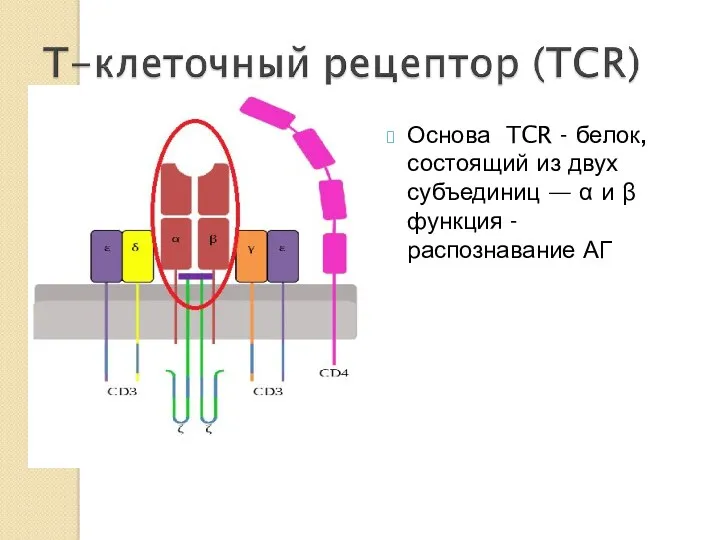
- 26. Основа TCR - белок, состоящий из двух субъединиц — α и β функция - распознавание АГ
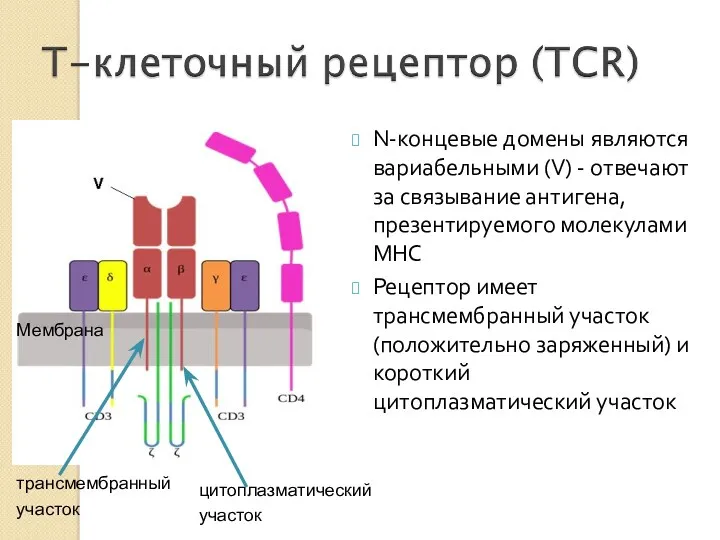
- 27. цитоплазматический участок N-концевые домены являются вариабельными (V) - отвечают за связывание антигена, презентируемого молекулами MHC Рецептор
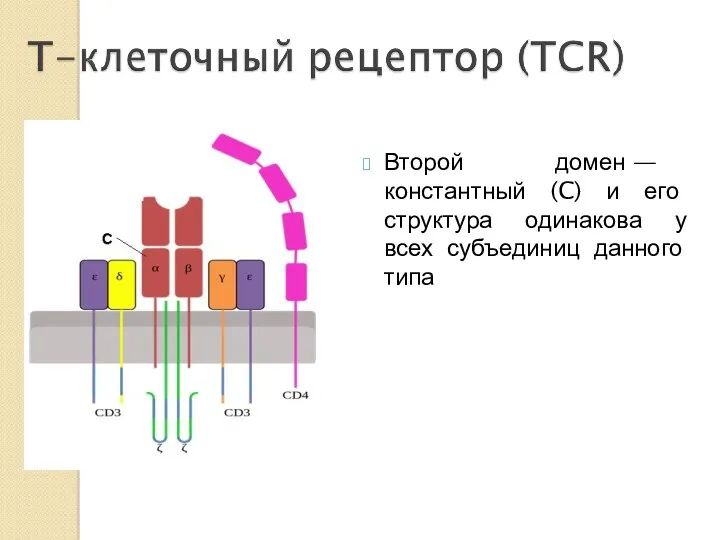
- 28. Второй домен — константный (C) и его структура одинакова у всех субъединиц данного типа
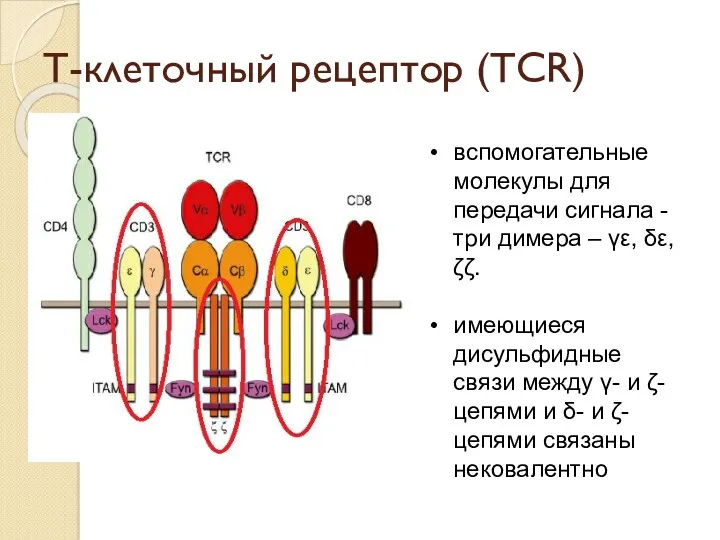
- 29. Т-клеточный рецептор (TCR) вспомогательные молекулы для передачи сигнала -три димера – γε, δε, ζζ. имеющиеся дисульфидные
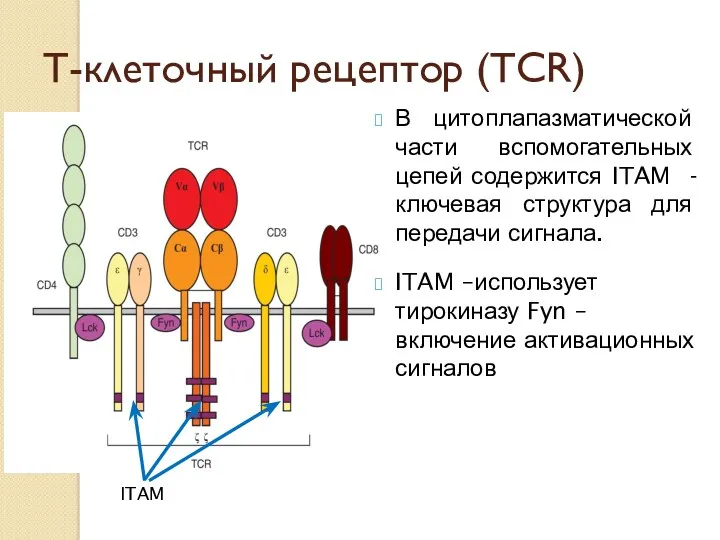
- 30. Т-клеточный рецептор (TCR) В цитоплапазматической части вспомогательных цепей содержится ITAM - ключевая структура для передачи сигнала.
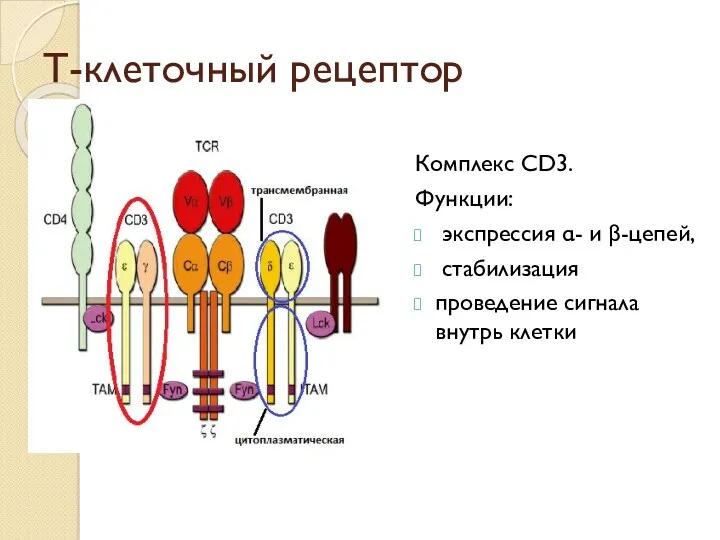
- 31. Т-клеточный рецептор Комплекс CD3. Функции: экспрессия α- и β-цепей, стабилизация проведение сигнала внутрь клетки
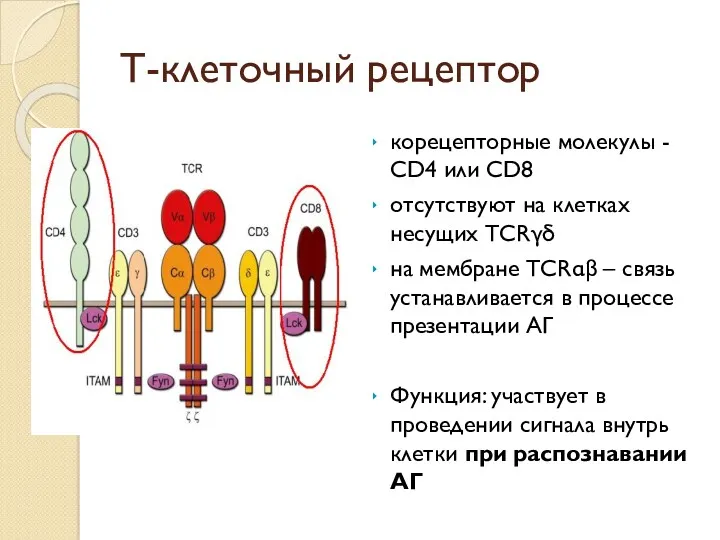
- 32. Т-клеточный рецептор корецепторные молекулы - CD4 или CD8 отсутствуют на клетках несущих TCRγδ на мембране TCRαβ
- 33. Сравнение рецепторов В- и Т-клеток
- 34. Главный комплекс гистосовместимости (MHC) MHC (Major histocompatibility complex) - главный комплекс гистосовместимости HLA ( Human leukocyte
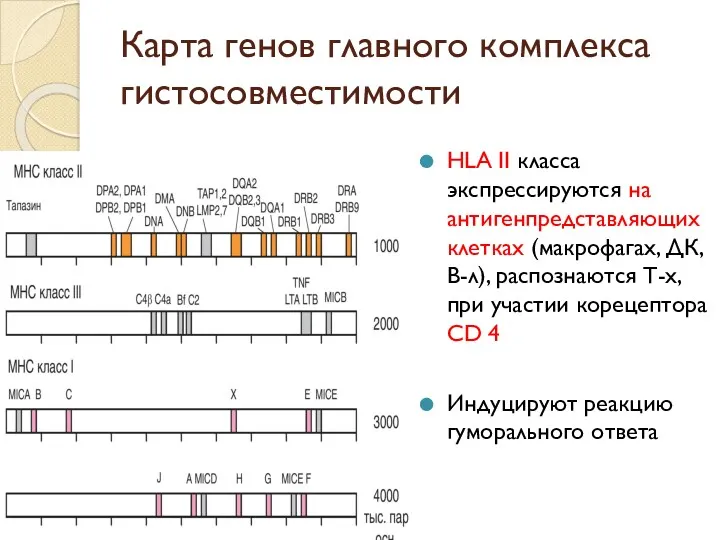
- 35. Карта генов главного комплекса гистосовместимости HLA человека на хромосоме 6 Содержит гены 3-х классов HLA I
- 36. Карта генов главного комплекса гистосовместимости HLA II класса экспрессируются на антигенпредставляющих клетках (макрофагах, ДК, В-л), распознаются
- 37. Карта генов главного комплекса гистосовместимости HLA III класса контролируют некоторые компоненты системы комплемента, цитокины семейства ФНО
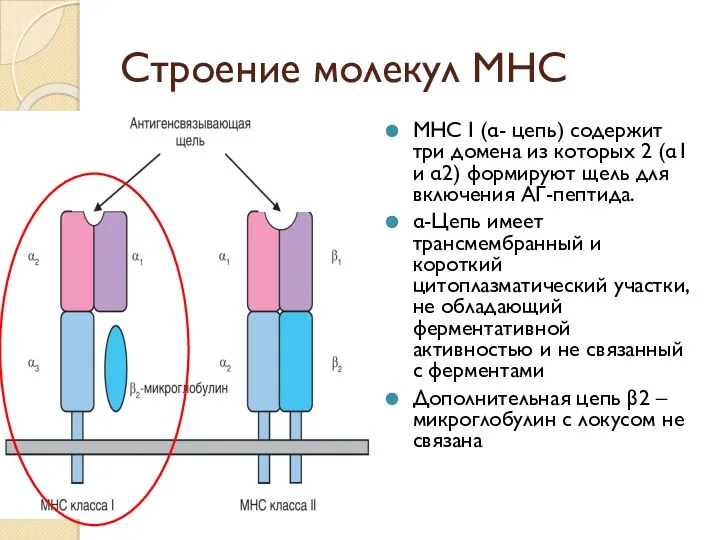
- 38. Строение молекул МНС МНС I (α- цепь) содержит три домена из которых 2 (α1 и α2)
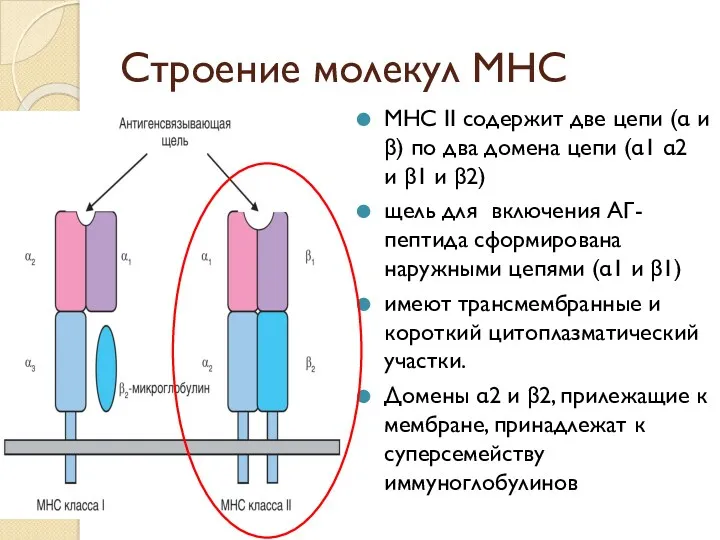
- 39. Строение молекул МНС МНС II содержит две цепи (α и β) по два домена цепи (α1
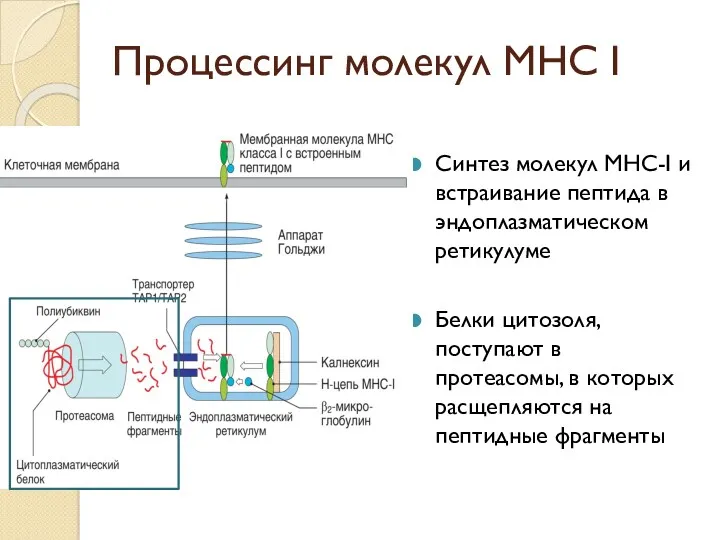
- 40. Процессинг молекул МНС I Синтез молекул MHC-I и встраивание пептида в эндоплазматическом ретикулуме Белки цитозоля, поступают
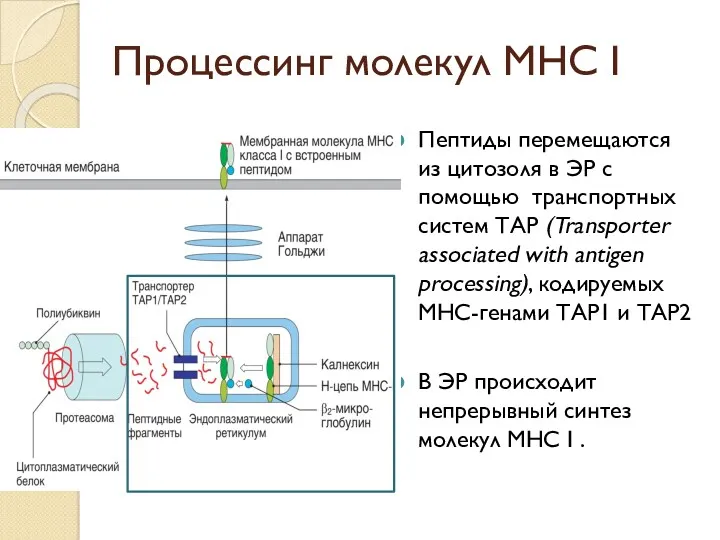
- 41. Процессинг молекул МНС I Пептиды перемещаются из цитозоля в ЭР с помощью транспортных систем ТАР (Transporter
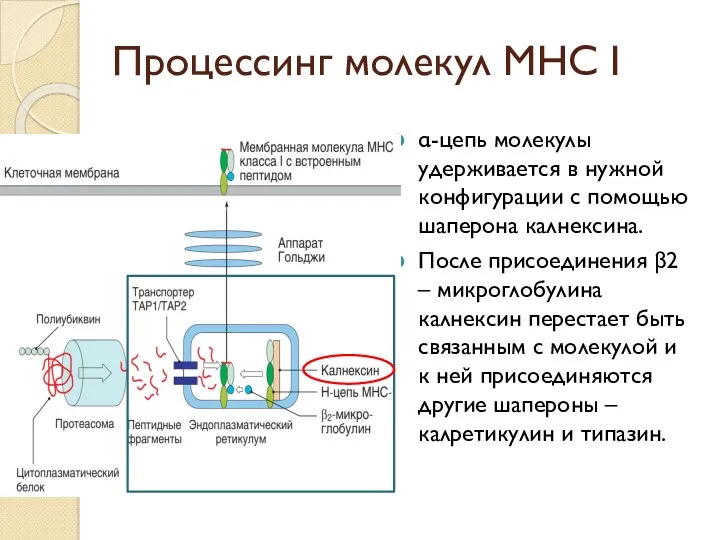
- 42. Процессинг молекул МНС I α-цепь молекулы удерживается в нужной конфигурации с помощью шаперона калнексина. После присоединения
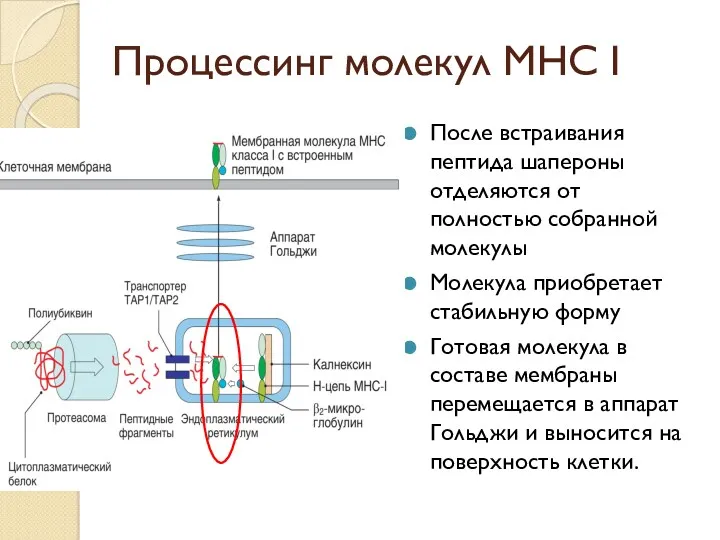
- 43. Процессинг молекул МНС I После встраивания пептида шапероны отделяются от полностью собранной молекулы Молекула приобретает стабильную
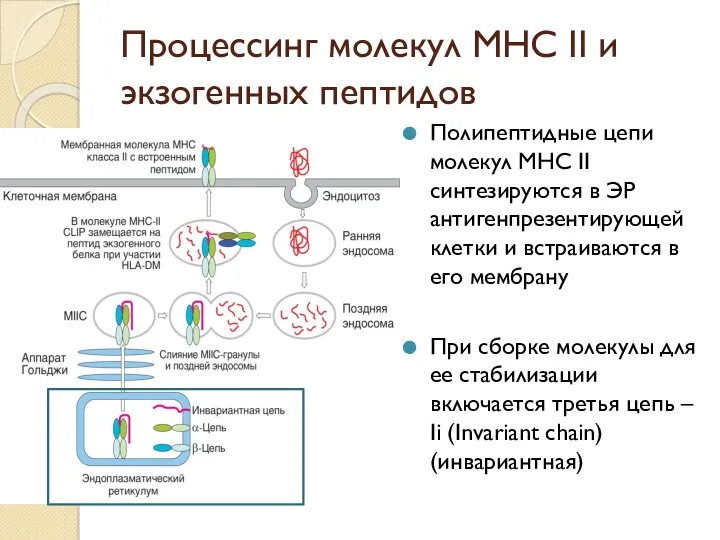
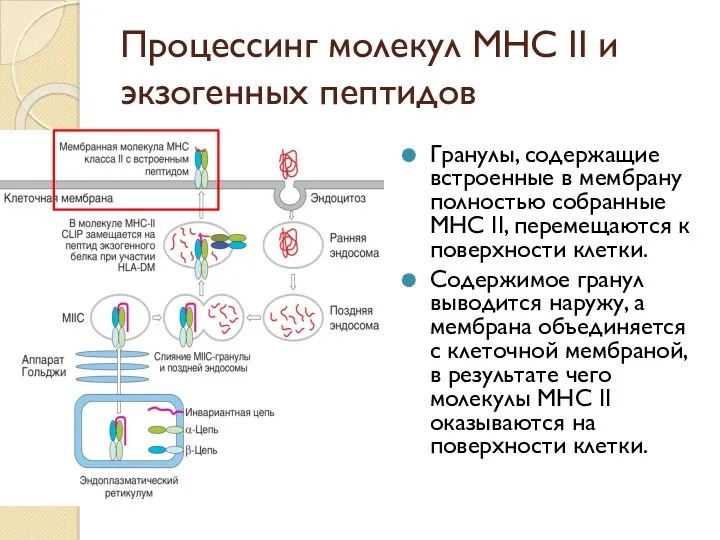
- 44. Процессинг молекул МНС II и экзогенных пептидов Полипептидные цепи молекул МНС II синтезируются в ЭР антигенпрезентирующей
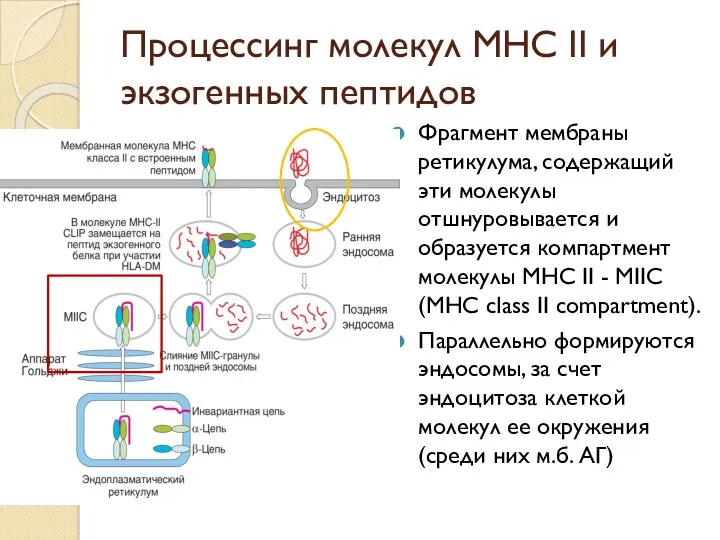
- 45. Процессинг молекул МНС II и экзогенных пептидов Фрагмент мембраны ретикулума, содержащий эти молекулы отшнуровывается и образуется
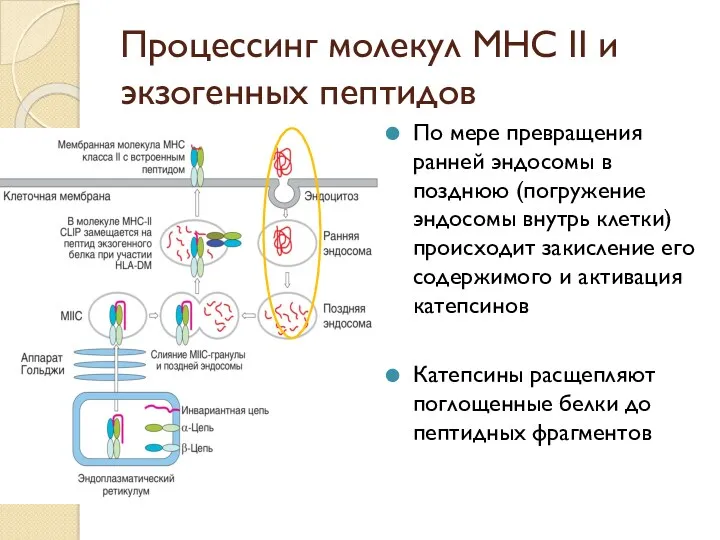
- 46. Процессинг молекул МНС II и экзогенных пептидов По мере превращения ранней эндосомы в позднюю (погружение эндосомы
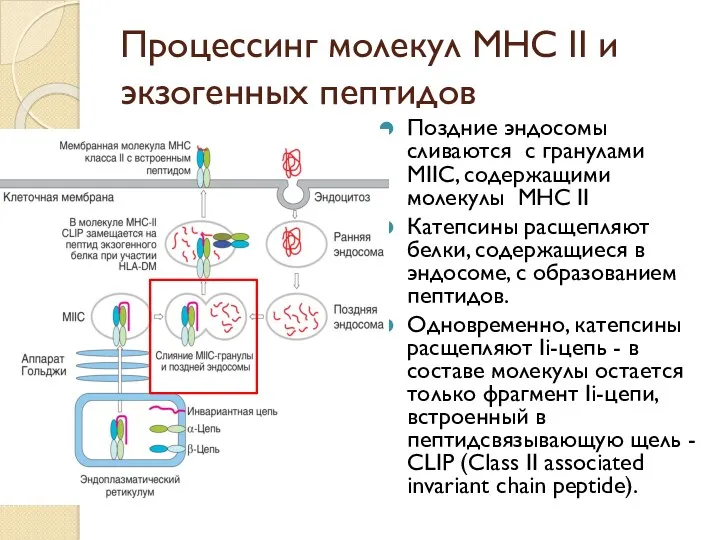
- 47. Процессинг молекул МНС II и экзогенных пептидов Поздние эндосомы сливаются с гранулами МIIС, содержащими молекулы МНС
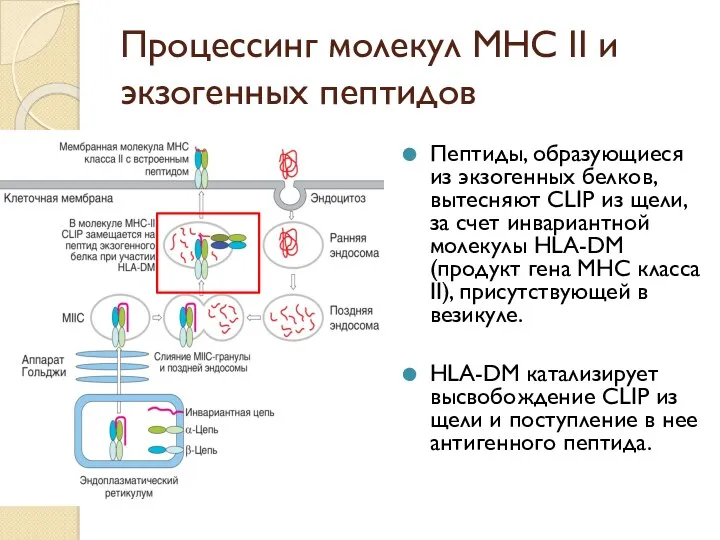
- 48. Процессинг молекул МНС II и экзогенных пептидов Пептиды, образующиеся из экзогенных белков, вытесняют CLIP из щели,
- 49. Процессинг молекул МНС II и экзогенных пептидов Гранулы, содержащие встроенные в мембрану полностью собранные МНС II,
- 50. Суперантигены Суперантигены - продукты патогенов (экзотоксины, белковые компоненты вирусов) распознаются Т-ЛФ с помощью TCR, но без
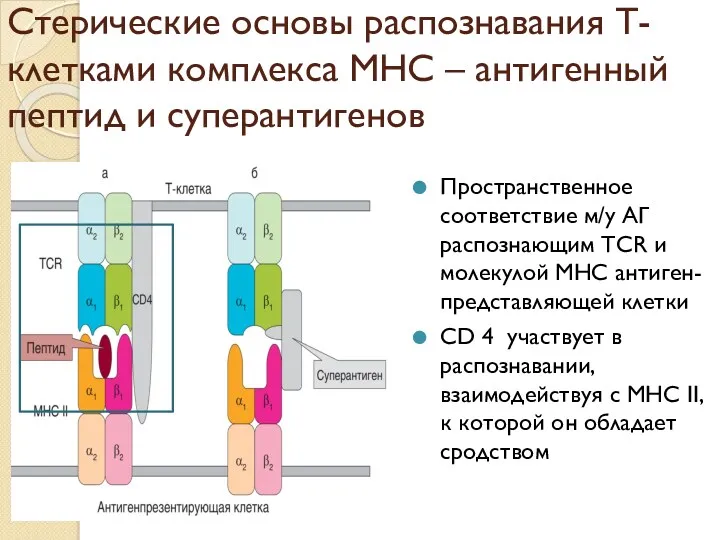
- 51. Стерические основы распознавания Т-клетками комплекса МНС – антигенный пептид и суперантигенов Пространственное соответствие м/у АГ распознающим
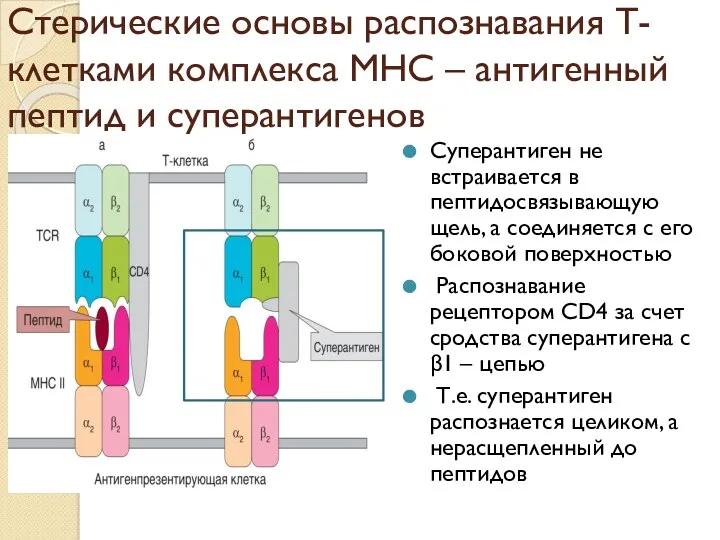
- 52. Стерические основы распознавания Т-клетками комплекса МНС – антигенный пептид и суперантигенов Суперантиген не встраивается в пептидосвязывающую
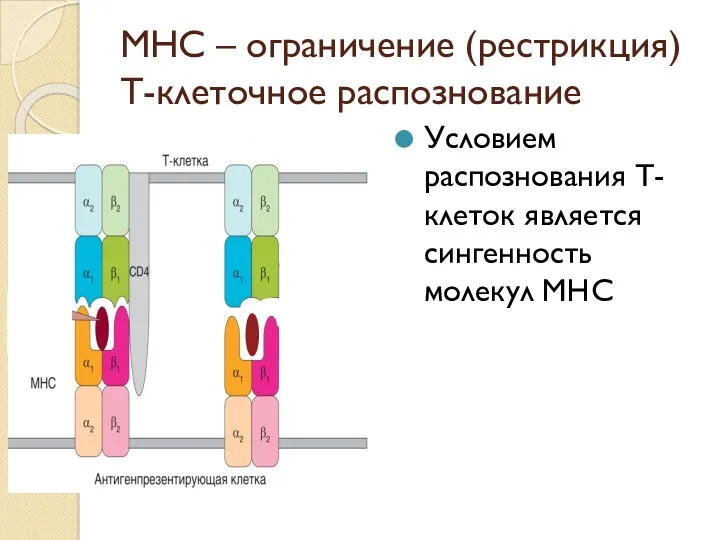
- 53. MHC – ограничение (рестрикция) Т-клеточное распознование Условием распознования Т- клеток является сингенность молекул МНС
- 54. Главный комплекс гистосовместимости (MHC) Выделяют 3 класса генов MHC— I, II и III. В отторжении несовместимых
- 55. Молекулы клеточного стресса Собственные молекулы организма - экспрессируются при клеточном стрессе Предотвращают необратимые повреждения организма Когда
- 56. Молекулы клеточного стресса собственные молекулы организма, экспрессируемые на мембране при клеточном стрессе и сигнализирующие преимущественно об
- 57. Молекулы клеточного стресса Алармины — белки теплового шока (HSP), белок HMGB1 (High mobility group bpx1), мочевая
- 58. Молекулы клеточного стресса Белки теплового шока (heat shock factor ) Hsp60, Hsp70 и Hsp90 относятся к
- 59. Молекулы клеточного стресса Передача сигналов от экзогенных факторов к патогенраспознающими рецепторами (прежде всего TLR), и от
- 60. Рецепторы, распознающие стрессорные молекулы представлены преимущественно на естественных киллерах (NK-клетках), еще на γδT-клетках, реже — на
- 61. Роль антигенов Антигены играют роль инициаторов ИО и активаторов защитных механизмов. Так антигены, прежде всего, непатогенных
- 62. Роль антигенов Контакт с МО способствует становлению ИС, ее развитию, активизации процессов распознавания «Я» и «
- 64. Скачать презентацию

























 Трихомоноз у тварин
Трихомоноз у тварин Медико-социальные проблемы демографических процессов
Медико-социальные проблемы демографических процессов Egyptian legal acts regarding health care of disabled people & children
Egyptian legal acts regarding health care of disabled people & children Тактика лечение язвенной болезни (показания к оперативному лечению)
Тактика лечение язвенной болезни (показания к оперативному лечению) Иммунодиагностика туберкулеза
Иммунодиагностика туберкулеза Грипп и другие ОРВИ
Грипп и другие ОРВИ Дифференциальный диагноз при аритмиях. Клиническая и ЭКГ-диагностика. Принципы лечения и неотложная помощь
Дифференциальный диагноз при аритмиях. Клиническая и ЭКГ-диагностика. Принципы лечения и неотложная помощь Лечение больных туберкулезом. Практическое занятие
Лечение больных туберкулезом. Практическое занятие Көпіртәрізді протездер
Көпіртәрізді протездер Организационно-правовые аспекты оказания первой помощи
Организационно-правовые аспекты оказания первой помощи Признаки раннего детского аутизма
Признаки раннего детского аутизма Қабыну.Анықтамасы.Қабынудың мәні мен биологиялық маңызы, даму заңдылықтары. Қабыну мен иммунитет. Пролифериялық қабыну
Қабыну.Анықтамасы.Қабынудың мәні мен биологиялық маңызы, даму заңдылықтары. Қабыну мен иммунитет. Пролифериялық қабыну Лейкозы, лейкоцитозы, лейкопении
Лейкозы, лейкоцитозы, лейкопении Основы медицинского мониторинга качества окружающей среды
Основы медицинского мониторинга качества окружающей среды Современные подходы к лечению эндометриоидных кист яичников
Современные подходы к лечению эндометриоидных кист яичников Система выделения. Функции почек
Система выделения. Функции почек Туберкулез диагностикасының заманауи әдістері
Туберкулез диагностикасының заманауи әдістері дерматовенерология 7 лекция
дерматовенерология 7 лекция Первая помощь при неотложных состояниях
Первая помощь при неотложных состояниях Итоги работы районной больницы Белорецкая ЦРКБ
Итоги работы районной больницы Белорецкая ЦРКБ Синдромология наркоманий
Синдромология наркоманий Нейрофизиологические основы развития речи
Нейрофизиологические основы развития речи Методы профилактики развития врожденных заболеваний, применяемые до беременности. Применение лекарств во время беременности
Методы профилактики развития врожденных заболеваний, применяемые до беременности. Применение лекарств во время беременности Биологиялық мембраналар. Иондық каналдар. Электрогенез механизімі
Биологиялық мембраналар. Иондық каналдар. Электрогенез механизімі Взвешенность изображений. Импульсные последовательности. Семиотика
Взвешенность изображений. Импульсные последовательности. Семиотика Эндемический зоб
Эндемический зоб Правовое обеспечение медицинской деятельности
Правовое обеспечение медицинской деятельности Программа подготовки медицинского персонала по вопросам проведения медицинских осмотров водителей транспортных средств
Программа подготовки медицинского персонала по вопросам проведения медицинских осмотров водителей транспортных средств