Содержание
- 2. Условие задачи Министерством здравоохранения Республики Беларусь разработаны перечни лекарственных препаратов, которые должны содержаться в аптечках первой
- 3. Этапы работы 1. Классификация лекарственных средств 2. Фармакотерапевтическое действие веществ, указанных в задаче 3. Процессы окисления-восстановления
- 4. Классификация лекарственных средств Лекарство — вещество или смесь веществ природного или синтетического происхождения в виде лекарственной
- 5. Окисление-восстановление Единство двух процессов Окисление – процесс отдачи электронов Восстановитель отдаёт электроны, а сам окисляется Восстановление
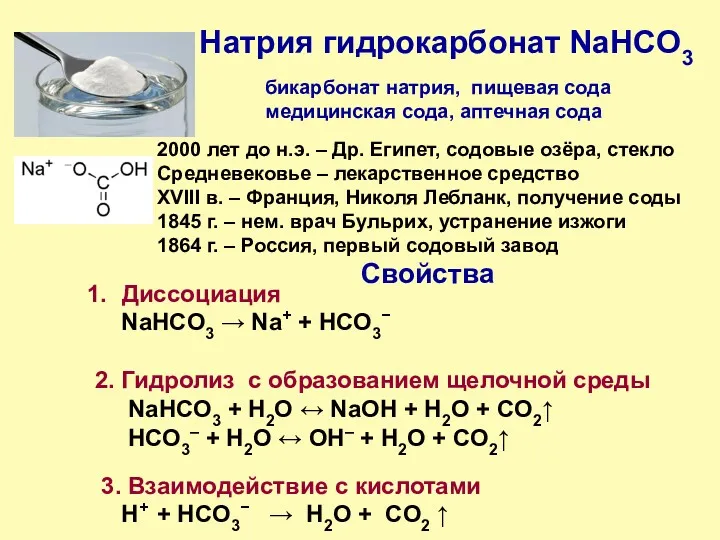
- 6. Натрия гидрокарбонат NaHCO3 Применение Нейтрализующее кислоту средство: H+ + HCO3− → H2О + CO2 ↑ при
- 7. Натрия гидрокарбонат NaHCO3 2000 лет до н.э. – Др. Египет, содовые озёра, стекло Средневековье – лекарственное
- 8. Натрия гидрокарбонат NaHCO3 Практическая часть 1. Образование слабощелочной среды в водном растворе. Индикатор – фенолфталеин 2.
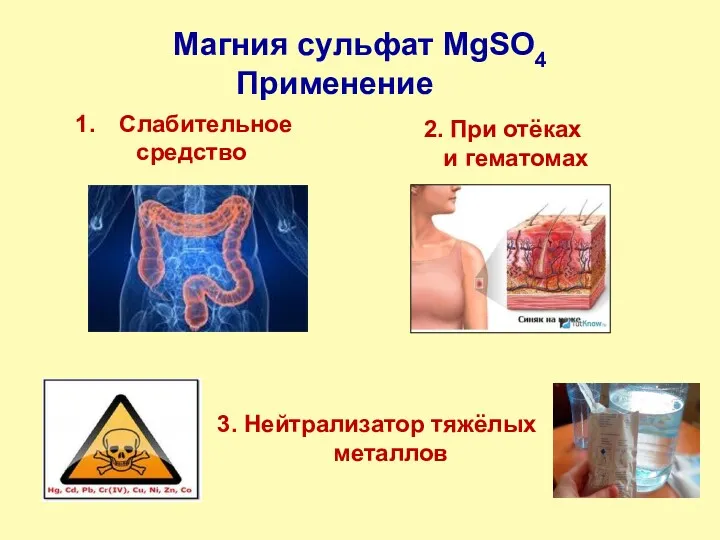
- 9. Магния сульфат MgSO4 Слабительное средство 3. Нейтрализатор тяжёлых металлов 2. При отёках и гематомах Применение
- 10. Магния сульфат MgSO4•7H2O гептагидрат сульфата магния, магнезия, магний сернокислый, горькая соль, английская соль, эпсомит, соль Эпсома
- 11. Магния сульфат MgSO4•7H2O Практическая часть Образование гидрата (на примере CuSO4 • 5H2O) 2. Опыт по осмотическому
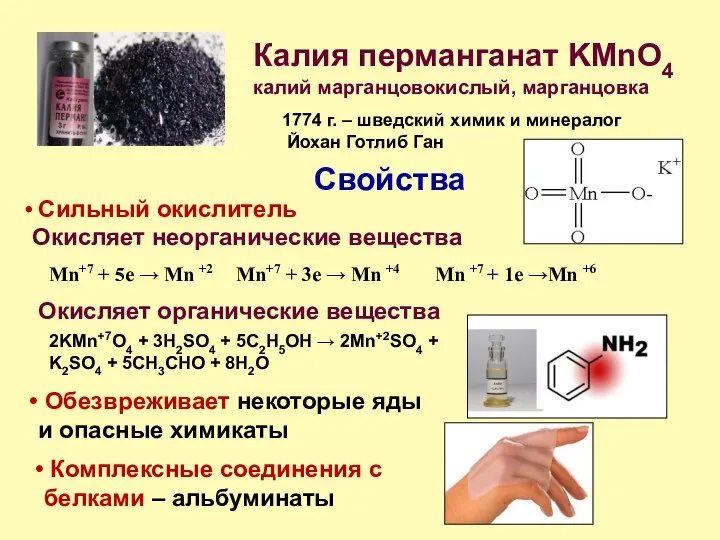
- 12. Калия перманганат KMnO4 Применение 1. Антисептик - полоскание горла, промывание ран, обработка ожогов - промывание желудка
- 13. Калия перманганат KMnO4 1774 г. – шведский химик и минералог Йохан Готлиб Ган Свойства калий марганцовокислый,
- 14. Калия перманганат KMnO4 Практическая часть - в кислой среде до солей марганца в степени окисления +2:
- 15. Калия перманганат KMnO4 Практическая часть Взаимодействие перманганата калия с пероксидом водорода 2KMnO4 + 5H2O2 + 3H2SO4
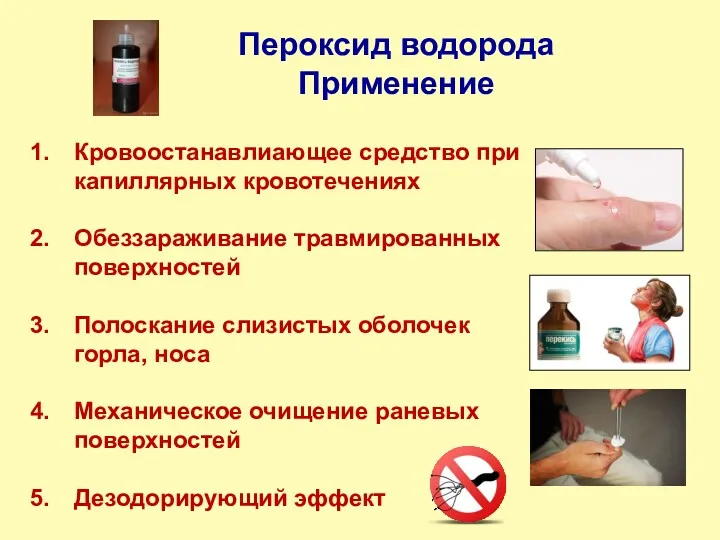
- 16. Пероксид водорода Применение Кровоостанавлиающее средство при капиллярных кровотечениях Обеззараживание травмированных поверхностей Полоскание слизистых оболочек горла, носа
- 17. Пероксид водорода H2O2 перекись водорода, 30 %-й раствор – пергидроль 1818 г. – Луи Жак Тенар,
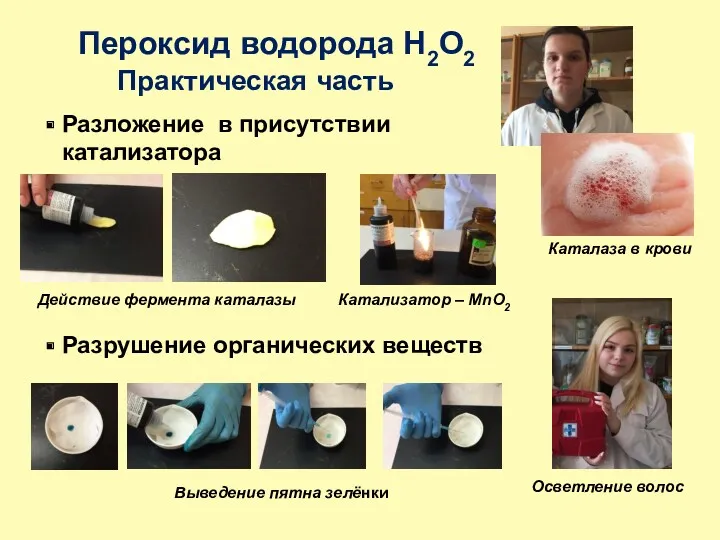
- 18. Пероксид водорода H2O2 Практическая часть Разложение в присутствии катализатора Катализатор – MnO2 Действие фермента каталазы Разрушение
- 19. Йод I2 Применение 1. Наружно: обработка ран, травм, при инфекционно-воспалительных поражениях кожи 2. Местно: тонзилит, ринит,
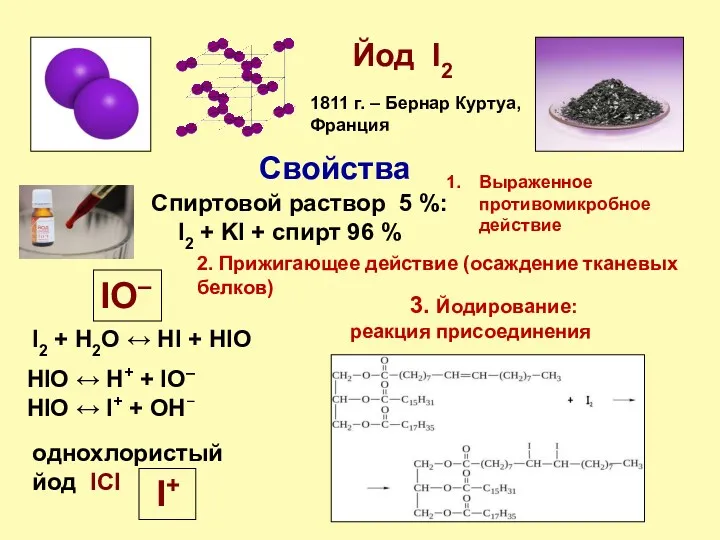
- 20. Йод I2 1811 г. – Бернар Куртуа, Франция Спиртовой раствор 5 %: I2 + KI +
- 21. Йод I2 Практическая часть Взаимодействие раствора йода с растительным маслом
- 22. Выводы На каких свойствах основано применение веществ из аптечки? Сода: реакция нейтрализации с более сильными кислотами,
- 24. Скачать презентацию















 Лимфоидная система, как основа приобретенного антигенспецифического иммунитета
Лимфоидная система, как основа приобретенного антигенспецифического иммунитета Эндокриндік жүйенің қатерлі және қатерсіз ісіктері
Эндокриндік жүйенің қатерлі және қатерсіз ісіктері Фармакотерапия. Пародонт ауру бар науқастарды емдеу қағидалары
Фармакотерапия. Пародонт ауру бар науқастарды емдеу қағидалары Рак гортани. Злокачественное новообразование гортани
Рак гортани. Злокачественное новообразование гортани Структура детской городской клинической поликлиники
Структура детской городской клинической поликлиники Оценка тяжести состояния пациентов с циррозом печени
Оценка тяжести состояния пациентов с циррозом печени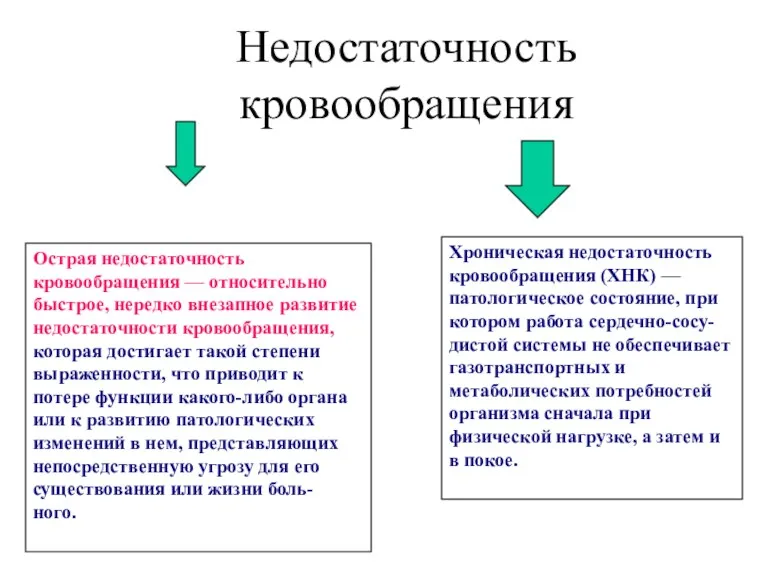 Недостаточность кровообращения
Недостаточность кровообращения Абдоминальная хирургия. Кишечный шов
Абдоминальная хирургия. Кишечный шов Целиакия и Лактазная недостаточность
Целиакия и Лактазная недостаточность Қазақстан республикасының сараптамалық мекемелері
Қазақстан республикасының сараптамалық мекемелері Рентгеновское излучение и его использование в медицине
Рентгеновское излучение и его использование в медицине Паразитарные заболевания внутренних органов
Паразитарные заболевания внутренних органов Заболевания опорно-двигательного аппарата у детей
Заболевания опорно-двигательного аппарата у детей Современные аспекты диагностики и терапии больных парентеральными вирусными гепатитами
Современные аспекты диагностики и терапии больных парентеральными вирусными гепатитами Факторы, влияющие на здоровье человека
Факторы, влияющие на здоровье человека Гиподинамия, гипердинамия
Гиподинамия, гипердинамия Медицина Нового времени. Клиническая медицина
Медицина Нового времени. Клиническая медицина Противовирусная терапия при невропатии лицевого нерва, ассоциированной с вирусом простого герпеса 1-го типа
Противовирусная терапия при невропатии лицевого нерва, ассоциированной с вирусом простого герпеса 1-го типа Эпидемиология туберкулеза
Эпидемиология туберкулеза Гинекологические аспекты заболеваний молочных желёз
Гинекологические аспекты заболеваний молочных желёз Проблема недостатка сна в современном мире
Проблема недостатка сна в современном мире Акушерський травматизм
Акушерський травматизм Диагностика заболеваний сердца
Диагностика заболеваний сердца Добавки для здоровья и долголетия
Добавки для здоровья и долголетия Зуботехнические воски
Зуботехнические воски Компьютерная томография в диагностике повреждений органов живота и таза
Компьютерная томография в диагностике повреждений органов живота и таза Дыхательная недостаточность
Дыхательная недостаточность Интегрированное ведение болезней детского возраста как современная стратегия первичной медико-санитарной помощи детям
Интегрированное ведение болезней детского возраста как современная стратегия первичной медико-санитарной помощи детям