Содержание
- 2. Бактериологический посев на микрофлору это микробиологическое лабораторное исследование биологического материала человека путем его посева на определенные
- 3. Преимущества бактериологического посева Высокая специфичность метода (перекрестных ложных реакций не наблюдается); Возможность исследовать абсолютно любую биологическую
- 4. Недостатки бактериологического посева: Длительность получения результата. Высокие требования к забору материала Определенные требования к квалификации персонала
- 5. ПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ Воспалительные заболевания, особенно постоянно рецидивирующие инфекции, и инфекции плохо поддающиеся антибиотикотерапии
- 6. Правила забора биологического материала для бактериологического посева Воздержаться от половых контактов за день до проведения процедуры!
- 7. Техника забора материала для бактериологического исследования Для забора материала используют стерильную посуду и стерильные инструменты. Взятие
- 8. Техника забора материала для бактериологического исследования Взятие биоматериала на анализ из влагалища : с заднего свода
- 9. Что представляет собой бактериологический посев? Материал для исследования в бактериологической лаборатории помещают на специальные питательные среды,в
- 10. Какие микроорганизмы можно выявить при бакпосеве? Листерия
- 11. Интерпретация результатов При бакпосеве даётся информация: об отсутствии или наличии роста; о количестве выросших в посеве
- 12. Оценка результата бактериологического исследования Колониеобразующая единица (КОЕ) - одна микробная клетка, способная образовать колонию, или видимая
- 13. Определение чувствительности к антибиотикам Определение чувствительности выделенного микроорганизма к тому или иному антибактериальному препарату является важной
- 14. Посев на уреаплазму и микоплазму Mycoplasma hominis и Ureaplasma spp. (Ureaplasma parvum+Ureaplasma urealyticum) условно-патогенные микроорганизмы, передающиеся
- 15. Посев на грибы Подготовка: Желательно проводить исследование до начала лечения противогрибковыми препаратами. Показания: Подозрение на грибковую
- 16. ПЦР-диагностика ПЦР-диагностика (полимеразная цепная реакция) — высокоточный метод диагностики многочисленных инфекций, который основывается на исследовании генетического
- 17. Отличительные характеристики ПЦР: универсальность метода (позволяет обнаруживать любые ДНК и РНК) высокая точность определения типа инфекции;
- 18. Какие инфекции позволяет выявить мазок на ПЦР? хламидиоз; уреплазмоз; кандидоз ; микоплазмоз; бактериальный вагиноз; инфекционный мононуклеоз;
- 19. Показаниями к взятию мазка на ПЦР выявление причин бесплодия; наличие ИППП в острой фазе; тяжело протекающая
- 20. Взятие мазка из влагалища 1)Материал должен быть взят до проведения мануального исследования. Зеркало перед манипуляцией можно
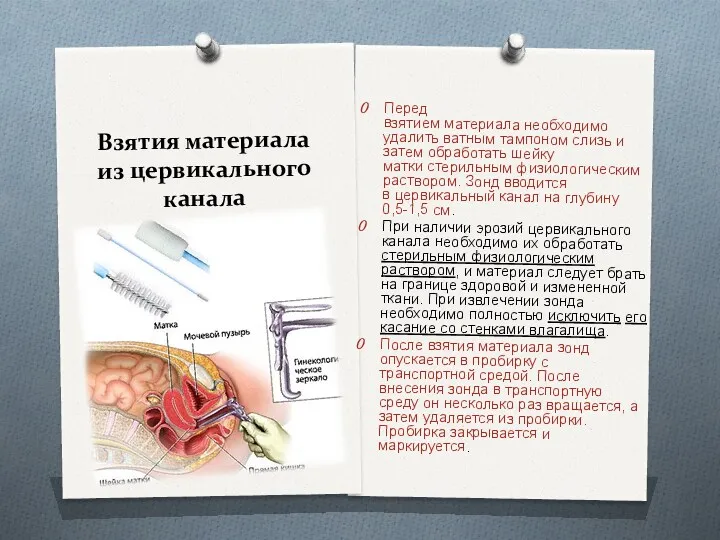
- 21. Взятия материала из цервикального канала Перед взятием материала необходимо удалить ватным тампоном слизь и затем обработать
- 23. Скачать презентацию



















 Стоматологиядағы кірісулер кезіндегі шұғыл көмек
Стоматологиядағы кірісулер кезіндегі шұғыл көмек Половое воспитание. Инфекции, передаваемые половым путём. 9 класс
Половое воспитание. Инфекции, передаваемые половым путём. 9 класс Көпіршікті дерматоздар (пемфигус)
Көпіршікті дерматоздар (пемфигус) Этапы обработки медицинских изделий. Тема 5
Этапы обработки медицинских изделий. Тема 5 Гиперкинетический синдром у детей
Гиперкинетический синдром у детей Бауме бойынша тістесу түрлері
Бауме бойынша тістесу түрлері Жас стоматолог
Жас стоматолог Шизофрения. Признаки шизофрении
Шизофрения. Признаки шизофрении Полуколичественный метод определения ДНК онкогенных типов ВПЧ-Digene-тест, онкоцитологическое исследование ASC-US
Полуколичественный метод определения ДНК онкогенных типов ВПЧ-Digene-тест, онкоцитологическое исследование ASC-US Surgical revascularization of myocardium
Surgical revascularization of myocardium Haemolytic disease of the fetus and newborn. Rh isoimmunization
Haemolytic disease of the fetus and newborn. Rh isoimmunization Рак щитовидной железы
Рак щитовидной железы Відмороження. Визначення поняття “відмороження”
Відмороження. Визначення поняття “відмороження” Артерия гистологиясы
Артерия гистологиясы Трансплантация почки
Трансплантация почки Теория медицинского диагноза и клинико-анатомический анализ летальных исходов. Теория и практика
Теория медицинского диагноза и клинико-анатомический анализ летальных исходов. Теория и практика Современные проблемы диагностики сепсиса
Современные проблемы диагностики сепсиса Искусственное кровообращение
Искусственное кровообращение Острый тонзиллит
Острый тонзиллит Кариес зуба
Кариес зуба Ноотропные препараты
Ноотропные препараты Первая помощь при ожогах и обморожениях
Первая помощь при ожогах и обморожениях Основные приемы классического массажа
Основные приемы классического массажа Зәр шығару жүйесінің сәулелік диагностика әдістері
Зәр шығару жүйесінің сәулелік диагностика әдістері Зерттеу сұрағы мен ақпаратты іздеу
Зерттеу сұрағы мен ақпаратты іздеу Ламбдацизм и методы его исправления
Ламбдацизм и методы его исправления Определение содержания гемоглобина по методу Сали. Лабораторная работа № 3
Определение содержания гемоглобина по методу Сали. Лабораторная работа № 3 Хроническая лучевая болезнь
Хроническая лучевая болезнь