Содержание
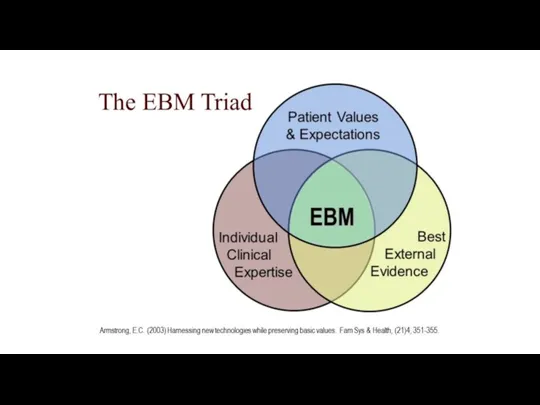
- 2. Доказательная медицина – добросовестное, явное и разумное использование современных научных данных в принятии решений о лечении
- 4. Для чего нужна доказательная медицина ?
- 5. Для чего нужна доказательная медицина ? Принятие клинических решений Clinical decision making Общение с пациентами Clinical
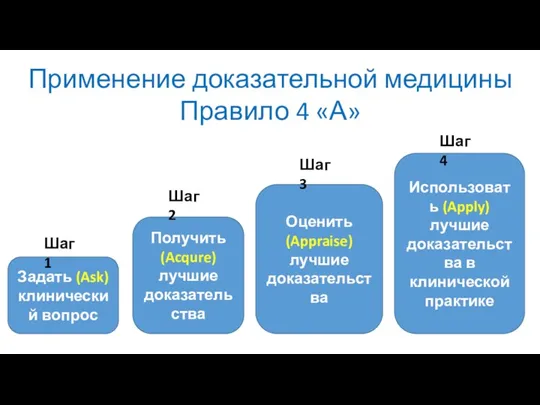
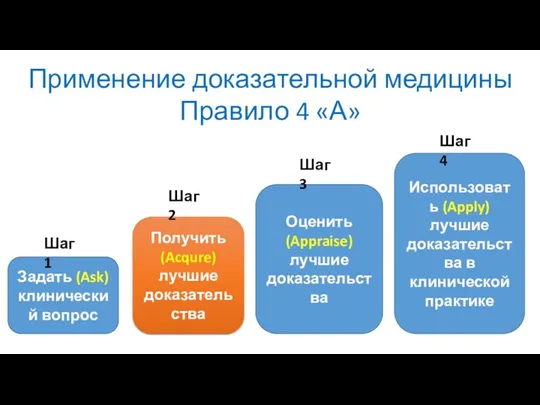
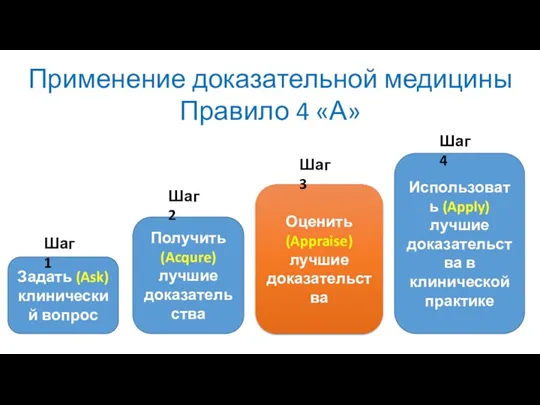
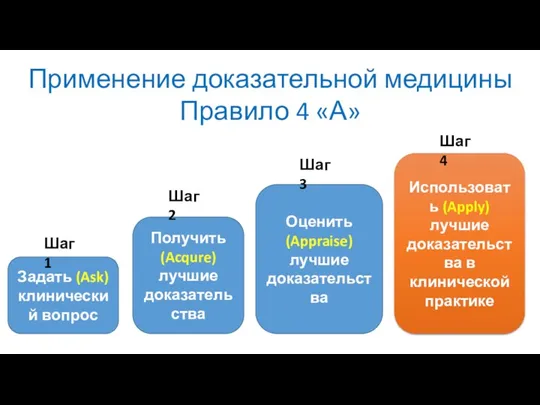
- 6. Применение доказательной медицины Правило 4 «А» Задать (Ask) клинический вопрос Получить (Acqure) лучшие доказательства Оценить (Appraise)
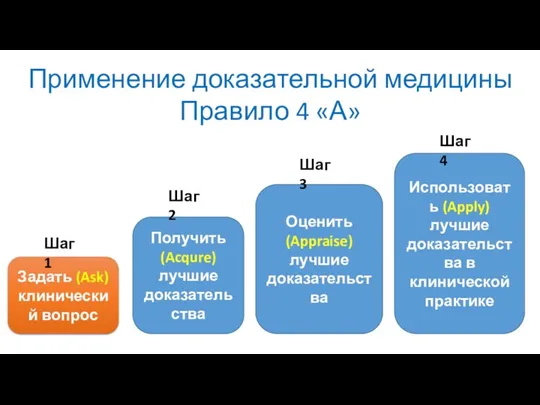
- 7. Применение доказательной медицины Правило 4 «А» Задать (Ask) клинический вопрос Получить (Acqure) лучшие доказательства Оценить (Appraise)
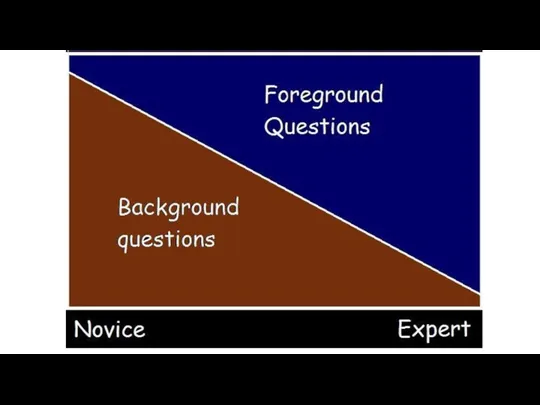
- 8. Типы клинических вопросов
- 9. Мужчина 20 лет. Заболел около 6 часов назад, когда появились сильные боли в эпигастрии, которые спустя
- 10. Типы клинических вопросов
- 12. P.I.C.O. Asking an Answerable Clinical Question
- 13. Применение доказательной медицины Правило 4 «А» Задать (Ask) клинический вопрос Получить (Acqure) лучшие доказательства Оценить (Appraise)
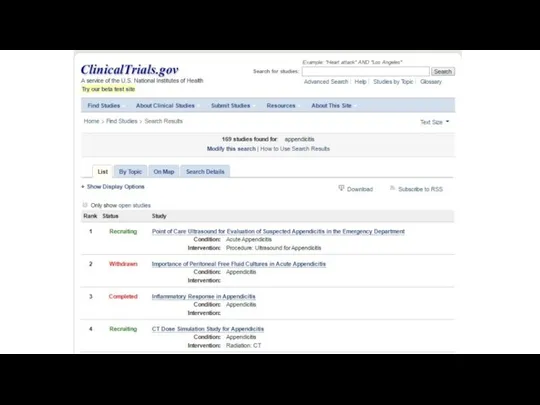
- 14. Где искать доказательства ?
- 16. Схема вопроса При использовании «ИЛИ» в поиске будут отображаться статьи, в названии которых входит первое или
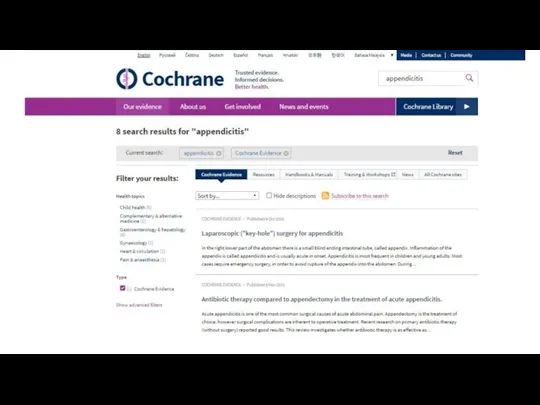
- 17. Pubmed.gov
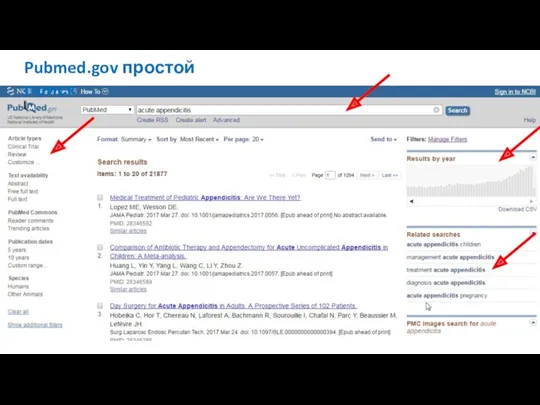
- 18. Pubmed.gov простой поиск
- 19. Pubmed.gov фильтры
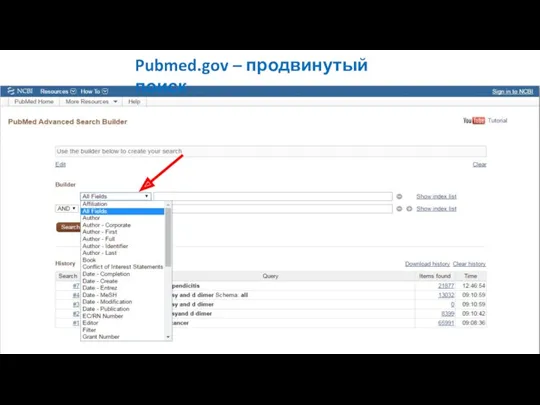
- 20. Pubmed.gov – продвинутый поиск
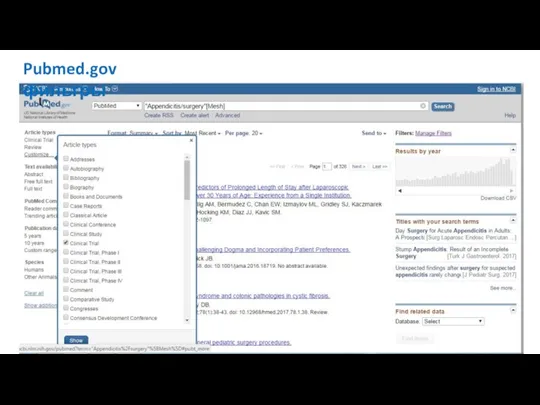
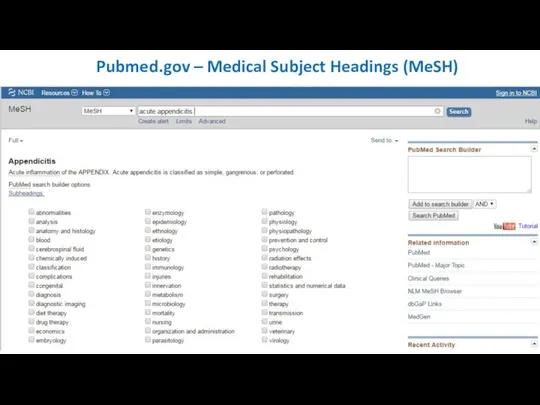
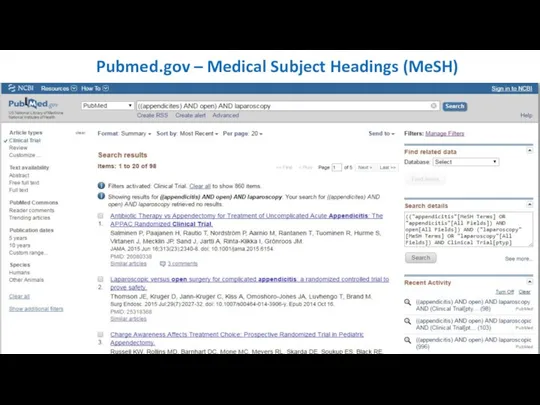
- 21. Pubmed.gov – Medical Subject Headings (MeSH)
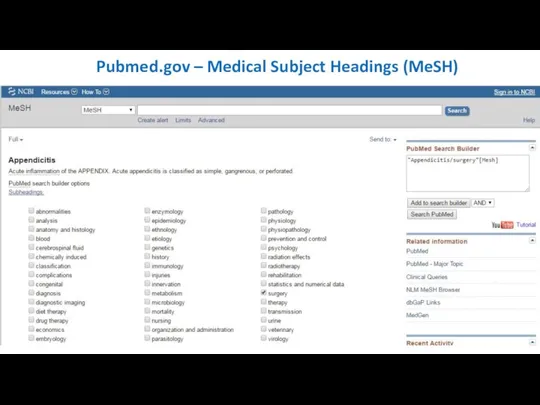
- 22. Pubmed.gov – Medical Subject Headings (MeSH)
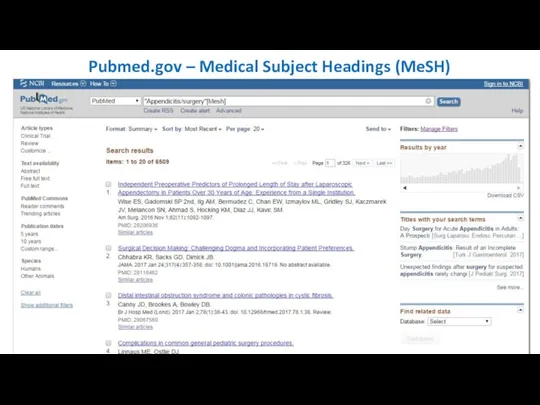
- 23. Pubmed.gov – Medical Subject Headings (MeSH)
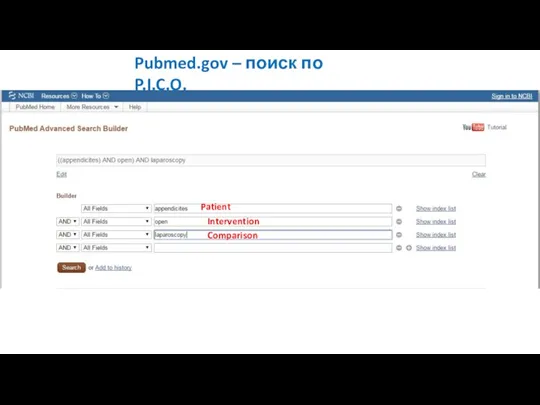
- 24. Pubmed.gov – поиск по P.I.C.O. Patient Intervention Comparison
- 25. Pubmed.gov – Medical Subject Headings (MeSH)
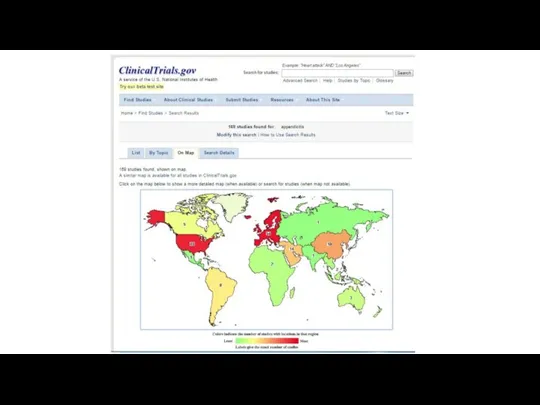
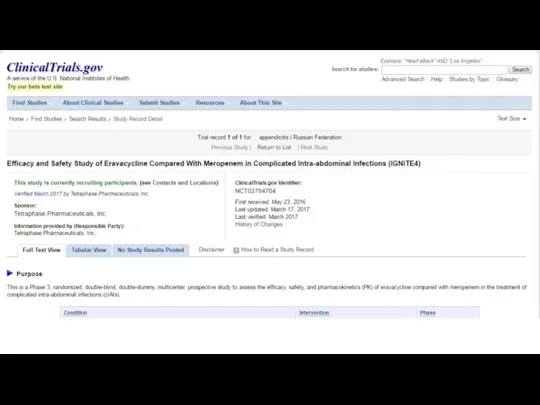
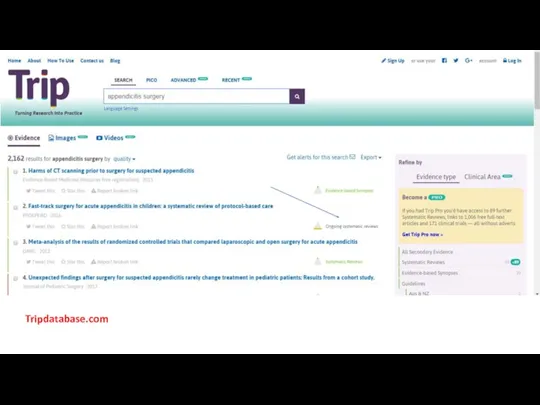
- 30. Tripdatabase.com
- 31. Tripdatabase.com
- 32. Tripdatabase.com
- 33. UpToDate.com
- 34. Embase.com
- 35. Cochrane.org.com Арчибальд Лемон Кокрейн 1909 - 1988
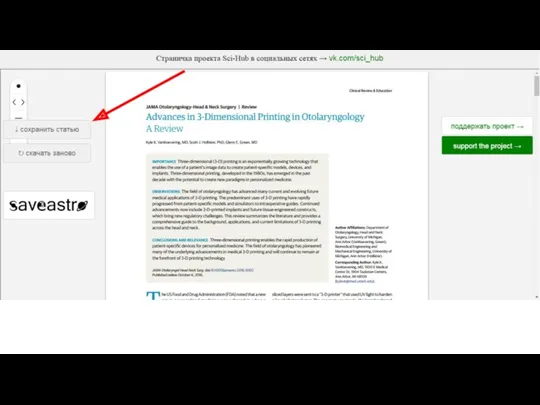
- 37. Я нашел отличное исследования, но надо заплатить по 22 евро. Что делать?
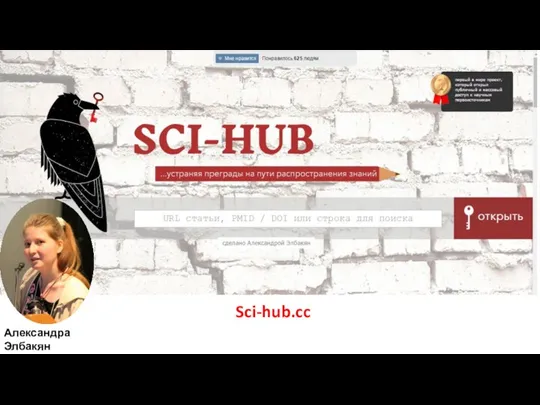
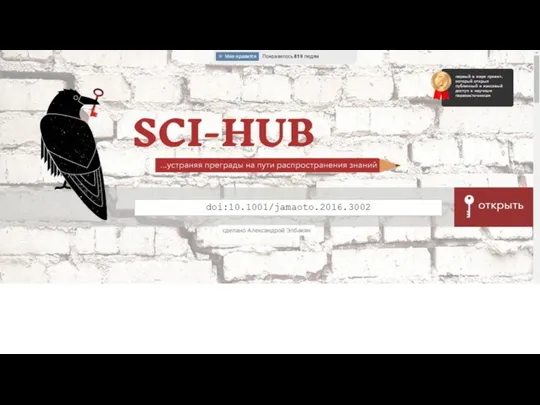
- 38. Sci-hub.cc Александра Элбакян
- 42. Применение доказательной медицины Правило 4 «А» Задать (Ask) клинический вопрос Получить (Acqure) лучшие доказательства Оценить (Appraise)
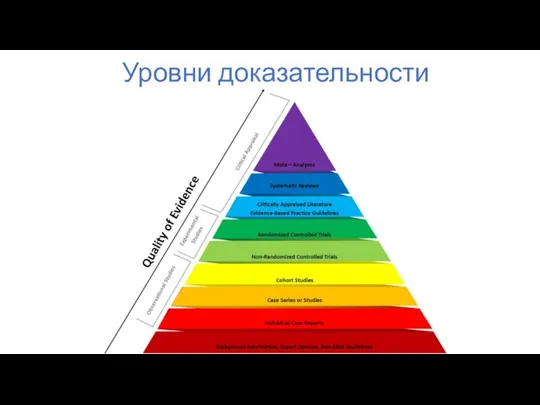
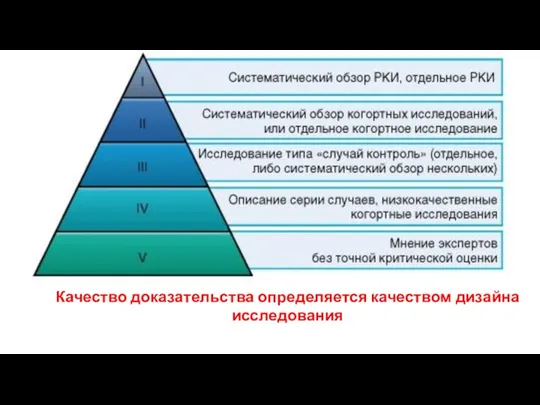
- 43. Уровни доказательности
- 44. Уровни доказательности
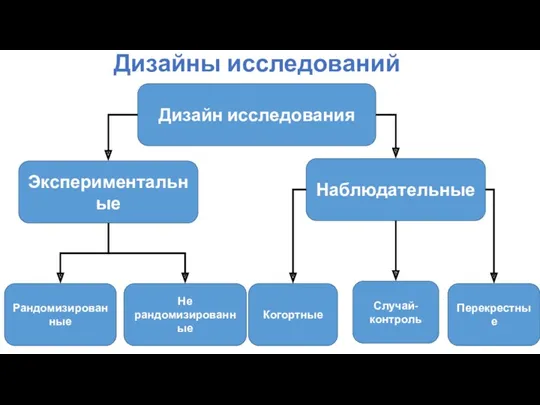
- 45. Дизайны исследований Дизайн исследования Экспериментальные Наблюдательные Рандомизированные Не рандомизированные Когортные Случай-контроль Перекрестные
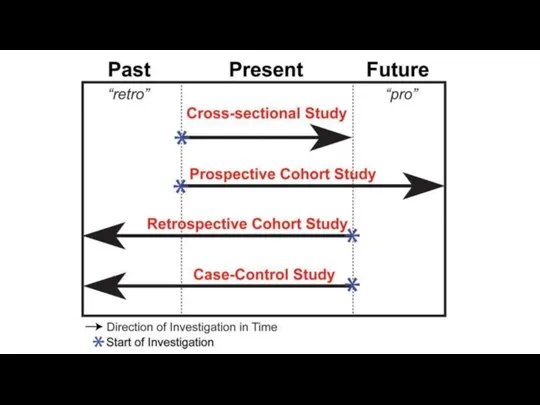
- 46. Клинический вопрос и дизайн исследования
- 47. Наблюдательные исследования Клинические исследование , при котором исследователь обирает данные путём простого наблюдения событий в их
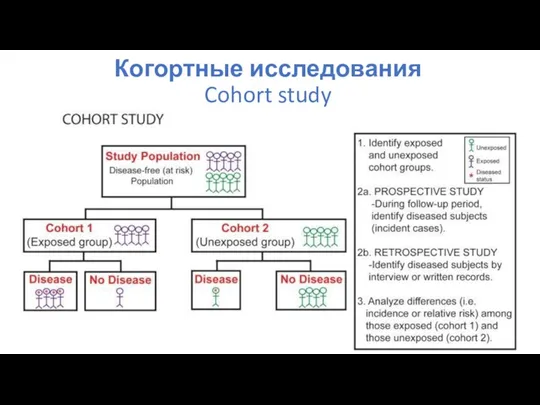
- 49. Когортные исследования Cohort study Когорта – тактическое подразделение армии Римской Империи, одна десятая часть легиона: В
- 50. Am J Public Health Nations Health. 1933 May; 23(5): 426–432.
- 51. Когортные исследования Cohort study
- 52. Когортные исследования Преимущества Сбор данных последовательно: можно установить причину заболевания или состояния; Одновременное исследование множества исходов
- 53. Когортные исследования Недостатки Требуется большое количество наблюдаемых для изучения редких воздействий; Подверженность систематической ошибке отбора;
- 54. Когортные исследования Недостатки Требуется большое количество наблюдаемых для изучения редких воздействий; Подверженность систематической ошибке отбора;
- 55. Частота встречаемости Incidence Rate (IR) Частота встречаемости заболевания в группе, подверженному воздействию A/(A+B) Частота встречаемости заболевания
- 56. Относительный риск Relative Risk (RR)
- 57. Атрибутивный риск Attributable Risk (AR) Атрибутивный риск — дополнительный риск возникновения неблагоприятного исхода в связи с
- 58. Атрибутивный риск для популяции Population Attributable Risk (PAR) Частота встречаемости заболевания в популяции Частота встречаемости заболевания
- 60. Syed S Mahmood, MD et al. Lancet 2014
- 61. Syed S Mahmood, MD et al. Lancet 2014 Франклин Рузвельт
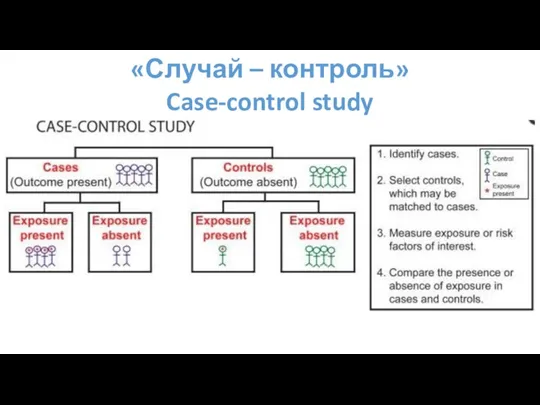
- 62. «Случай – контроль» Case-control study Отличительные черты: Заболевание и воздействие уже произошли до начала исследования; Ретроспективно
- 63. Остин Брэдфорд Хилл Ричард Долл
- 64. «Случай – контроль» Case-control study
- 65. «Случай – контроль» Преимущества Хорошо подходят для изучения редких заболеваний, или заболеваний с длительным периодом развития;
- 66. «Случай – контроль» Недостатки Восприимчивы к информационным системным ошибкам; Трудно проверить информацию Сложно правильно выбрать группу
- 67. Частота воздействия Exposure Rate (ER) Частота воздействия в группе «Случай» A/(A+C) Частота воздействия в группе «Контроль»
- 68. Шанс Odd Шанс в группе «Случай» = A/C Шансе в группе «Контроль» = B/D
- 69. Отношение шансов Odds Ratio (OR) Мера силы взаимосвязи между фактором риска и заболеванием. Основано на трех
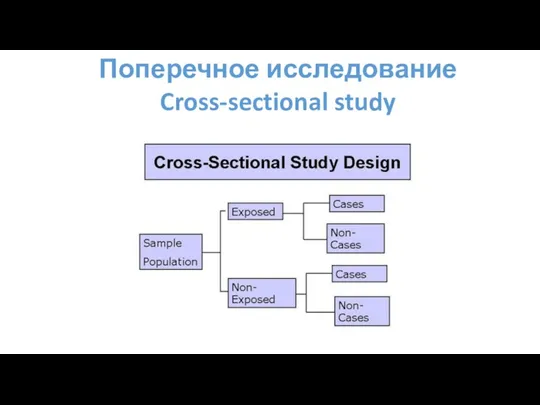
- 70. Поперечное исследование Cross-sectional study Отличительные черты: «Моментальный снимок» популяции; Одновременная оценка воздействия и результата в определенный
- 71. Поперечное исследование Cross-sectional study
- 72. Поперечное исследование Преимущества Быстро; Недорого; Можно оценить распространенность в популяции заболеваний и факторов риска; Возможность трансформации
- 73. Поперечное исследование Недостатки Подверженность систематическим ошибкам отбора (selection bias) Не подходит для редких заболеваний; Нельзя оценить
- 74. Распространенность Prevalence Ratio (PR)
- 75. Как оценить наблюдательные исследования?
- 76. www.strobe-statement.org
- 77. Чек-лист Содержит 22 пункта; 18 пунктов являются общими для 3 дизайнов наблюдательных исследований; 4 пункта являются
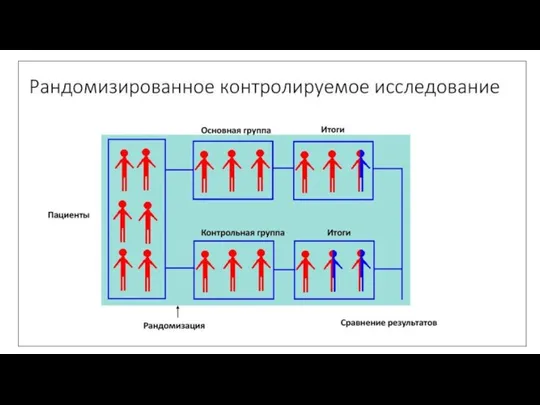
- 78. Рандомизированные клинические исследования Рандомизированное контролируемое испытание — тип научного (часто медицинского) эксперимента, при котором его участники
- 79. Первое в мире рандомизированное клиническое исследование
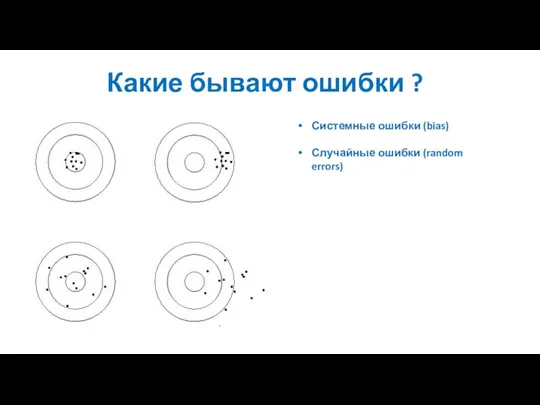
- 81. Какие бывают ошибки ?
- 82. Какие бывают ошибки ? Системные ошибки (bias) Случайные ошибки (random errors)
- 83. Системные ошибки (bias) Даниел Канеман р. 1934 Лауреат Нобелевской премии по экономике 2002 г.
- 84. Виды системных ошибок
- 85. Критическая оценка рандомизированных клинических исследований Рандомизация (Randomization) Ослепление (Blinding) Период наблюдения (Follow-up) Результаты (Outcomes) Анализ результатов
- 86. Гипотеза Нулевая гипотеза – это та гипотеза, которую мы должны опровергнуть в исследовании. (как правило гипотеза
- 87. Размер выборки Sample size Ошибка первого рода; Ошибка второго рода; Размер эффекта лечения; Дизайн исследования; Равноценность
- 88. Ошибки первого и второго рода Ошибка первого рода ( альфа-ошибка) – мы находим связь там,где ее
- 89. Дизайн рандомизированного клинического исследования
- 90. Размер эффекта лечения Чем меньше разница эффекта, тем больше размер выборки
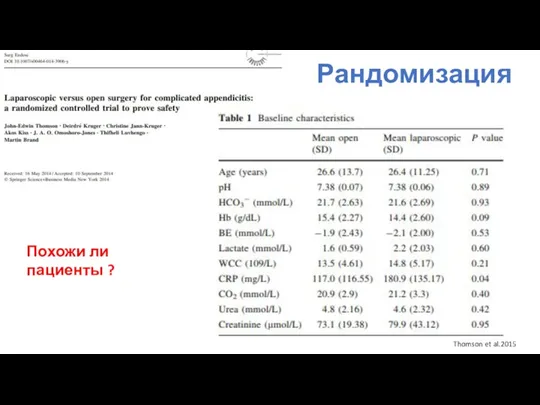
- 91. 1.Рандомизация Рандомизация – это процесс случайного распределения пациентов в экспериментальную или контрольную группу. Цель рандомизации –
- 92. Рандомизация Thomson et al.2015 Похожи ли пациенты ?
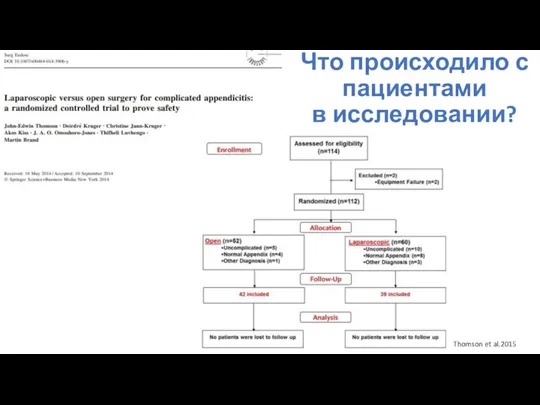
- 93. Что происходило с пациентами в исследовании? consort-statement.org
- 94. Что происходило с пациентами в исследовании? Thomson et al.2015
- 95. 2. Ослепление (Blinding) Открытое исследование (Open-label) Одиночное слепое исследование (Single-blind) Двойное слепое исследование (Double-blind) Тройное слепое
- 96. Результаты: достигли ли мы конечной точки ?
- 97. Конечная точка End-point Конечная точка – это та характеристика , на которую должно влиять экспериментальное воздействие,
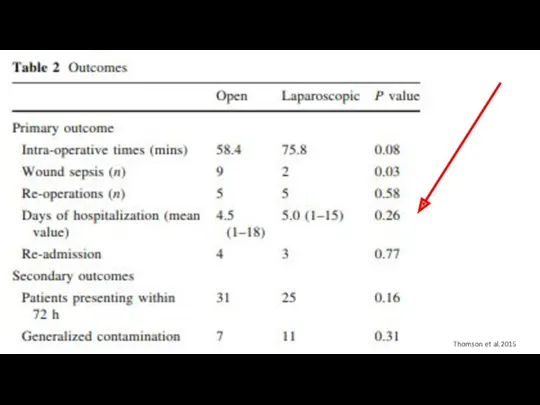
- 98. Thomson et al.2015 Primary end point - летальность
- 99. Thomson et al.2015
- 100. Измерение результатов исследований Относительный риск ( Relative Risk) Снижение абсолютного риска (Absolute risk reduction) Снижение относительного
- 101. Относительный риск Relative Risk (RR) RR говорит нам во сколько раз больше вероятность того, что событие
- 102. Снижение абсолютного риска Absolute Risk Reduction (ARR) ARR говорит нам, что абсолютная разница в вероятности результата
- 103. Снижение относительного риска Relative Risk Reduction (RRR) RRR говорит нам о снижении вероятности исхода в группе
- 104. Количество необходимое для лечения Number Needed to Treat (NNT) NNT показывает среднее число пациентов, которых необходимо
- 105. Количество необходимое для развития осложнения/побочного действия Number Needed to Harm (NNH) NNH показывает среднее число пациентов,
- 106. Применение результатов для популяции P – значение (p value) = 0,05 Доверительный интервал ( confidence interval)
- 107. Intention to treat analysis Анализ пациента происходит в той группе, куда он был изначально рандомизирован
- 109. consort-statement.org
- 110. Систематический обзор и мета-анализ Статистический синтез данных из разных, но подобных, т.е. сопоставимых исследований, итог которого
- 111. prisma-statement.org
- 113. Клинические рекомендации (Clinical Guidelines)
- 114. Качество доказательства определяется качеством дизайна исследования
- 115. Применение доказательной медицины Правило 4 «А» Задать (Ask) клинический вопрос Получить (Acqure) лучшие доказательства Оценить (Appraise)
- 116. Применение доказательств Вопросы: Возможно ли данное лечение в моих условиях? Отличаются ли мои пациенты от тех,
- 117. Похожи ли мои пациенты ? Факторы: Возраст Сопутствующие заболевания Приверженность лечению (следование указаниям врача) Прочие факторы,
- 118. Возможно ли данное лечение в моих условиях ? Исследование проводилось в другой стране или среди другой
- 119. Какие существуют альтернативы?
- 120. Какие существуют альтернативы? «F метод» позволяет оценить риск для вашего пациента. Если Ваш пациент в 2
- 121. Что думает об этом пациент? Рассказать обо всех возможных вариантах лечения? Рассказать о достоинствах и недостатках
- 123. Как ежедневно использовать принципы доказательной медицины? 1.Задавать клинические вопросы по P.I.C.O.; 2. Вести список клинических вопросов
- 125. Скачать презентацию


































































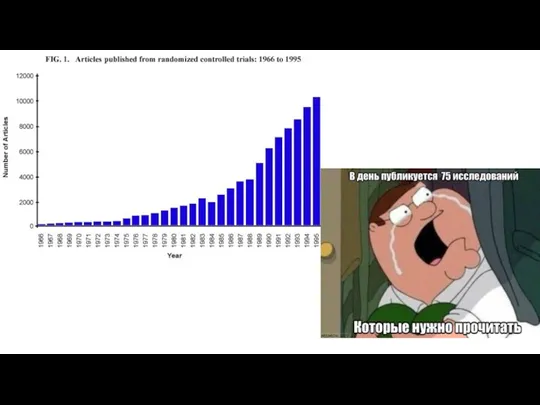









 Гипопитуитаризм – группа синдромов эндокринной недостаточности
Гипопитуитаризм – группа синдромов эндокринной недостаточности Анатомия коронарных артерий
Анатомия коронарных артерий Лекарственные средства
Лекарственные средства Жартылай пластиналы протезбен ортопедиялық емдеу. 4-ші клиникалық кезеңі
Жартылай пластиналы протезбен ортопедиялық емдеу. 4-ші клиникалық кезеңі Опыт применения препарата Хинофуцин у женщин с цервикальной интраэпителиальной неоплазией в ассоциации с бактериальным вагинозом
Опыт применения препарата Хинофуцин у женщин с цервикальной интраэпителиальной неоплазией в ассоциации с бактериальным вагинозом Заболевания кишечника. Современные методы лечения
Заболевания кишечника. Современные методы лечения Эпилепсия: основные направления терапии
Эпилепсия: основные направления терапии Функциональная анатомия органов мужской половой системы
Функциональная анатомия органов мужской половой системы Кинетические дисфункции костей черепа
Кинетические дисфункции костей черепа Медико-социальные аспекты совершенствования профилактики сахарного диабета среди сельских жителей Южно-Казахстанской области
Медико-социальные аспекты совершенствования профилактики сахарного диабета среди сельских жителей Южно-Казахстанской области Жоғарғы интенсивті лазерлік сәулелердің биологиялық ұлпаларға әсерінің механизмі
Жоғарғы интенсивті лазерлік сәулелердің биологиялық ұлпаларға әсерінің механизмі Титановые магнитные браслеты “Тяньши”
Титановые магнитные браслеты “Тяньши” Стресс: понятия, симптомы и способы защиты. Депрессия: ее виды и проявления. Суицид
Стресс: понятия, симптомы и способы защиты. Депрессия: ее виды и проявления. Суицид Дифференциальная диагностика бронхиальной астмы (ХОБЛ, и обструктивными синдромами) на этапе ПМСП
Дифференциальная диагностика бронхиальной астмы (ХОБЛ, и обструктивными синдромами) на этапе ПМСП Хронический бронхит. ХОБЛ: диагностика и выбор оптимальной терапии
Хронический бронхит. ХОБЛ: диагностика и выбор оптимальной терапии Бронхиальная астма
Бронхиальная астма Пневмония у детей. Этиология. Принципы лечения
Пневмония у детей. Этиология. Принципы лечения Нарушения кислотно-основного состояния. Методы коррекции
Нарушения кислотно-основного состояния. Методы коррекции Отдел функциональной диагностики
Отдел функциональной диагностики Анатомия и физиология мочевыделительной системы человека
Анатомия и физиология мочевыделительной системы человека Введение в медицинскую микологию. Кандидозы
Введение в медицинскую микологию. Кандидозы Актуальные проблемы антимикробной терапии. Микробиологические аспекты
Актуальные проблемы антимикробной терапии. Микробиологические аспекты Доброкачественные органоспецифические опухоли челюстей, лица, шеи
Доброкачественные органоспецифические опухоли челюстей, лица, шеи Жедел коронарлы синдром
Жедел коронарлы синдром 1 декабря - Всемирный день борьбы со СПИДом
1 декабря - Всемирный день борьбы со СПИДом Последствия нейротравмы
Последствия нейротравмы Тромботические микроангиопатии. Большая проблема или интересная задача
Тромботические микроангиопатии. Большая проблема или интересная задача Переломи і опіки
Переломи і опіки