Содержание
- 2. Лекарственное обеспечение VS рациональная фармакотерапия
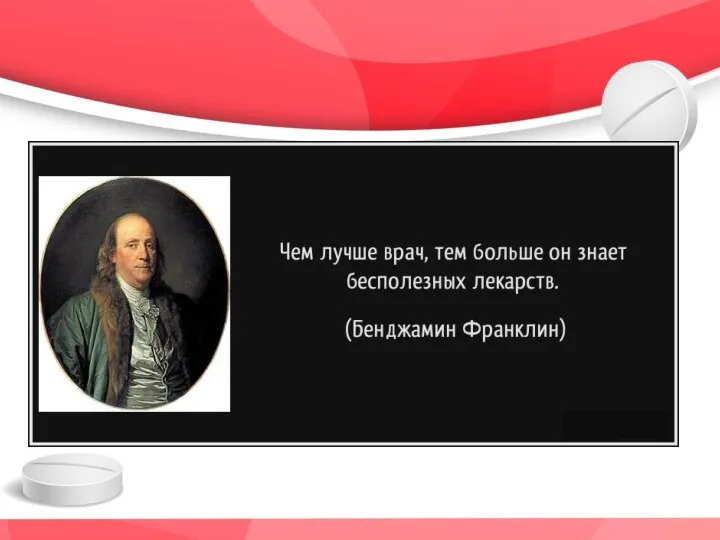
- 3. «Что было- уже есть, чему быть – уже было» Экклесиаст
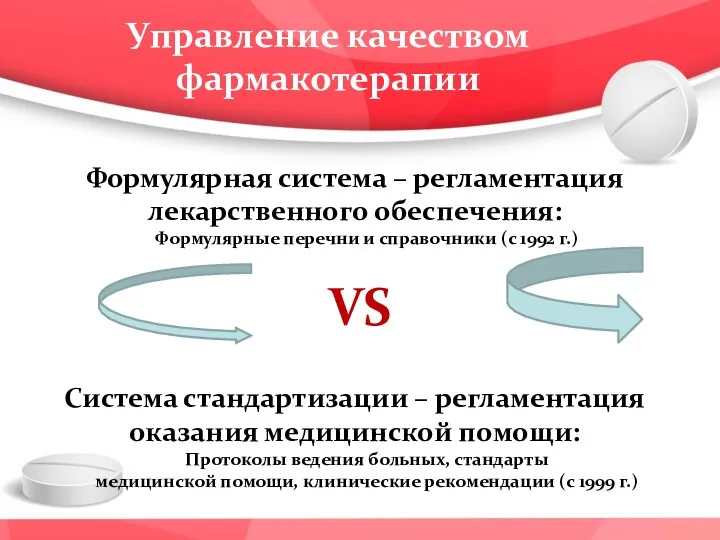
- 4. Формулярная система – регламентация лекарственного обеспечения: Формулярные перечни и справочники (с 1992 г.) Система стандартизации –
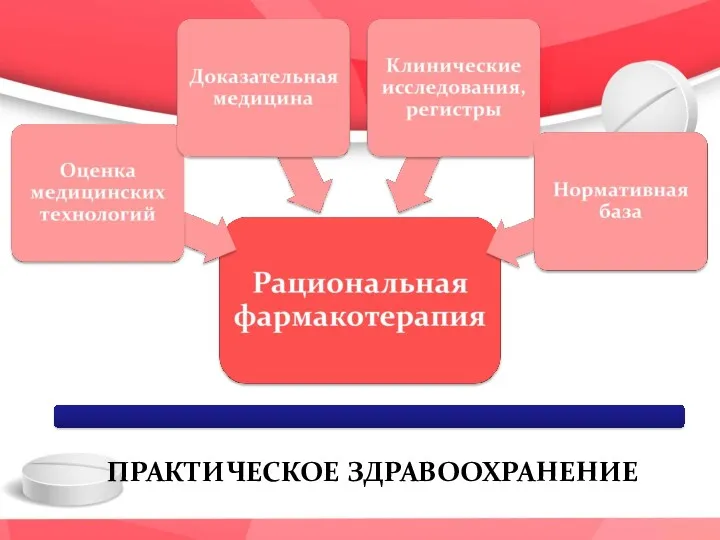
- 5. Рациональная фармакотерпия
- 6. ПРАКТИЧЕСКОЕ ЗДРАВООХРАНЕНИЕ
- 7. Нормативная база Сектор обращения лекарственных средств -наиболее регулируемая сфера экономических отношений в подавляющем большинстве случаев решение
- 8. Что изменилось в России за последние годы: фокус на «импортозамещение»: Правительством РФ поставлена цель к 2018г.
- 9. Референтный лекарственный препарат «Лекарственный препарат, который впервые зарегистрирован в РФ, качество, эффективность и безопасность которого доказаны
- 10. Воспроизведенный лекарственный препарат «Лекарственный препарат, который имеет такой же качественный состав и количественный состав действующих веществ
- 11. Биоаналог «Биоаналоговый [биоподобный] лекарственный препарат [биоаналог] – биологический лекарственный препарат, схожий по параметрам качества, эффективности и
- 12. Взаимозаменяемый лекарственный препарат «Лекарственный препарат с доказанной терапевтической эквивалентностью или биоэквивалентностью в отношении референтного лекарственного препарата,
- 13. Взаимозаменяемость лекарственных препаратов Определяется комиссией экспертов ФГБУ «Научный центр экспертизы средств медицинского применения», по заданию Минздрава.
- 14. … к 10 января 2017 г. разработать и реализовать комплекс мер по инвентаризации госреестра лекарственных средств
- 15. Стратегия лекарственного обеспечения населения Российской Федерации до 2025 года Лекарственное обеспечение является одной из важнейших социальных
- 16. Механизмы сдерживания государственных расходов на лекарственные средства
- 17. Лекарственное обеспечение населения Доступность лекарств для населения Рациональность государственных затрат
- 18. Доступность лекарственных средств Четыре основных причины роста цен на лекарства: замена старых дешевых лекарств новыми, более
- 19. Эффективность новых ЛП повышается на %%, при этом цена возрастает в разы, а иногда в 100
- 20. Стоимость Эффективность С 2001 по 2004 гг. расходы на лечение онкологических заболеваний увеличились на 9% За
- 21. Федеральная национальная онкологическая программа в России действовала с 2009г. до конца 2014г. в 64-х субъектах России
- 22. Оценка медицинских технологий в онкологии Польша: 2007 –2010, проведена оценка 149 ЛС [из них 39 –
- 23. Фармакоэкономика Отрасль экономики здравоохранения, изучающая клинические и экономические преимущества лекарственных препаратов и схем лекарственной терапии. Область
- 24. Фармакоэкономика эффективный инструмент Анализ затрат на лекарственную терапию на различных уровнях управления Обоснование включения ЛП в
- 25. Использование экономической оценки как элемента принятия решений
- 26. Расходы на здравоохранение в % от ВВП Рейтинг стран World Health Organization: National Health Account Statistics,
- 27. Объем и прогноз роста мирового фармацевтического рынка в денежном выражении [млн. долл.] IMS Health Consulting, 2013
- 28. Потребление лекарств на душу населения [долл. США] DSM Group, 2013
- 29. Лекарственные средства – это главная мишень экономии бюджетных затрат на здравоохранение из-за размера лекарственного бюджета и
- 30. Медицина и бизнес Стоимость лекарственных препаратов Выдуманные болезни Реклама Манипуляции результатами клинических исследований Бесполезные лекарства
- 31. В США страховые компании отказались частично или полностью оплачивать затраты на сунитиниб. В конце 2008 NICE,
- 32. Органы здравоохранения КНР принудили снизить цены на 3 лекарственных препарата: препарат для лечения рака легкого Iressa
- 33. Социальная ответственность бизнеса Руководство фармацевтического гиганта GlaxoSmithKline [вторая по объему мирового рынка] официально признало, что большинство
- 34. Современные тенденции в фармацевтической индустрии Более 65% новых молекулярных субстанций относится к препаратам особой категории, предназначенным
- 35. В 2016 году в ЕС зарегистрирован генетический препарат Strimvelis [компании GlaxoSmithKline]. Лекарственное средство предназначено для лечения
- 36. Финансовое влияние редких медицинских технологий на бюджет в развитых странах Доля расходов на редко применяемые препараты
- 37. Редкие медицинские технологии и орфанные препараты Недостаток эпидемиологических данных о распространенности редких болезней Недостаток научных данных
- 38. Скрининг новорожденных [обязательное генетическое обследование] проводится: Россия – 5 заболеваний [муковисцидоз, галактоземия, адреногенитальный синдром, врожденный гипотиреоз,
- 39. Расширение неонатального скрининга - высокозатратное мероприятие: например, чтобы выявить у одного ребенка фенилкетонурию, необходимо выполнить диагностические
- 40. Лекарственное обеспечение пациентов с орфанными заболеваниями со временем появляются новые нозологии, разрабатываются и регистрируются инновационные лекарственные
- 41. 75% лекарственных препаратов, используемых при лечении у детей, не имеют одобрения на применение их в педиатрической
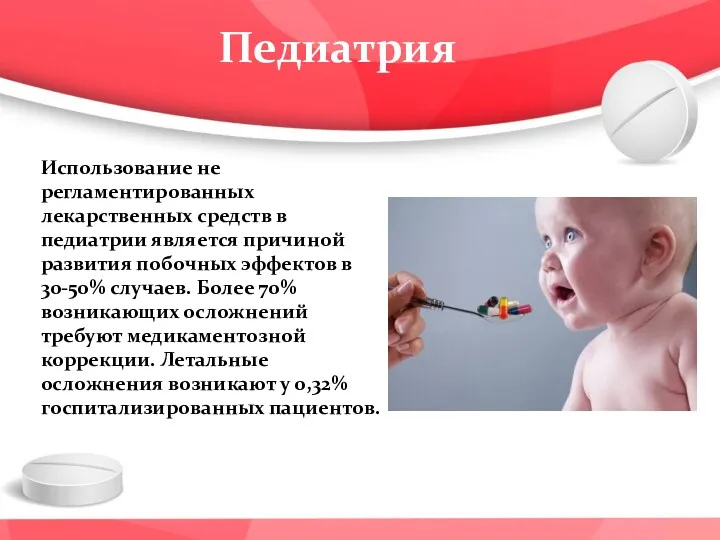
- 42. Педиатрия Использование не регламентированных лекарственных средств в педиатрии является причиной развития побочных эффектов в 30-50% случаев.
- 43. Частота не регламентированных назначений ЛС в педиатрии составляет, в среднем, 70% [Label-off]: ~50% в стационарах ~20%
- 44. Диалектика По конвенции ВОЗ каждый человек имеет право на адекватное лечение. И она разрешает использовать препараты,
- 45. Приказ МЗ и СР №494 от 09.08.2005 г. О порядке применения ЛС у больных по жизненным
- 46. ПОСТАНОВЛЕНИЕ ПРАВИТЕЛЬСТВА РФ №771 от 29 сентября 2010г. О порядке ввоза лекарственных средств для медицинского применения
- 47. Регистр больных Разработка специальных протоколов по диагностике редких болезней и применению редких лекарств Перечень орфанных препаратов
- 48. Бесполезные лекарства и выдуманные болезни Ноотропные препараты Гепатопротекторы Иммуномодуляторы Противогриппозные препараты Витамины Хондропротекторы Антиоксиданты Антигипоксанты и
- 49. Доказательная медицина Крупнейшая американская политическая газета выносит на первую страницу результаты только что закончившегося рандомизированного контролируемого
- 52. Что называют «иммуномодуляторами» в цивилизованных странах мира? Препараты, влияющие на иммунную систему [обычно с супрессивным действием]
- 53. Действующее вещество Состав Форма выпуска Показания, противопоказания Применение при беременности Побочные эффекты Способ применения и дозы
- 54. Заболевания передающиеся половым путем [ЗППП] в т.ч. у беременных [ВПЧ, герпес, хламидиоз и другие], многие гинекологические
- 55. Клинические исследования противовирусных препаратов [2009г] [2014]
- 56. Использование критериев «доказательной медицины» применительно к иммунотропным препаратам – это общая задача не только иммунологов, но
- 57. Что такое доказательная медицина? Зачем нужны клинические исследования? Как быть уверенным в том, что новое лечение
- 58. Доказательная медицина [Evidence-based medicine]* - медицина, основанная на доказательствах устранение из оценок результата вмешательства препарата человеческой
- 59. Статистика – «совокупность методов для принятия мудрых решений перед лицом неопределённости» Wallis W.A. et al. Statistiks,
- 60. уменьшение числа врачебных ошибок, облегчение процесса принятия решения для администрации лечебных учреждений , юристов, снижение и
- 61. данные, полученные в РКИ, ложатся в первую очередь в основу современных клинических рекомендаций, которые трансформируют результаты
- 62. Какой должна быть доказательная медицина PATHWAY-2: гипотензивное действие спиронолакторна более выражено, чем действие бисопролола и доксазозина.
- 63. PARADIGM-HF: ингибитор рецепторов ангиотензина/неприлизина LCZ696 [комбинация вальсартана и сакубитрила] эффективнее эналаприла в отношении снижения риска смерти
- 64. Доказано, что финансирование научных исследований представителями фармацевтических компаний чаще всего приводит к получению результатов, указывающих исключительно
- 65. Клинические исследования в РФ часто не соответствуют дизайну современных требований, не проходят этической экспертизы и не
- 66. Регистры пациентов – новая возможность для доказательной медицины EORP [EURObservational Research Programme]: около 20 пилотных и
- 67. CLARIFY [Prospective observational Longitudinal Registry of patients with stable coronary artery disease]: пациенты, наблюдавшиеся в течение
- 68. Решение проблемы рационального использования лекарств на уровне медицинских специалистов Ограничение количества применяемых препаратов за счет исключения
- 69. Задачи Переход на формулярную систему Реализация образовательных программ для практических врачей Создание системы контроля рациональной фармакотерапии
- 70. Клинические фармакологи Определение лекарственного формуляра Участие в формировании протоколов и стандартов лечения Регистрация и анализ побочных
- 72. Скачать презентацию







![Биоаналог «Биоаналоговый [биоподобный] лекарственный препарат [биоаналог] – биологический лекарственный препарат,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-10.jpg)














![Объем и прогноз роста мирового фармацевтического рынка в денежном выражении [млн. долл.] IMS Health Consulting, 2013](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-26.jpg)
![Потребление лекарств на душу населения [долл. США] DSM Group, 2013](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-27.jpg)









![Скрининг новорожденных [обязательное генетическое обследование] проводится: Россия – 5 заболеваний](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-37.jpg)













![Заболевания передающиеся половым путем [ЗППП] в т.ч. у беременных [ВПЧ,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-53.jpg)
![Клинические исследования противовирусных препаратов [2009г] [2014]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-54.jpg)


![Доказательная медицина [Evidence-based medicine]* - медицина, основанная на доказательствах устранение](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-57.jpg)




![PARADIGM-HF: ингибитор рецепторов ангиотензина/неприлизина LCZ696 [комбинация вальсартана и сакубитрила] эффективнее](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/191039/slide-62.jpg)







 Сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания Иммунодефициты. Определение иммунодефицита
Иммунодефициты. Определение иммунодефицита Лечение хронического гастрита и гастрдуоденита
Лечение хронического гастрита и гастрдуоденита Нестероидные противовоспалительные средства
Нестероидные противовоспалительные средства Острый коронарный синдром
Острый коронарный синдром Арнайы дайындалған диеталық тағамдар
Арнайы дайындалған диеталық тағамдар Электрокардиографические признаки инфаркта миокарда
Электрокардиографические признаки инфаркта миокарда Дифференциальная диагностика первичных злокачественных опухолей костей — сарком
Дифференциальная диагностика первичных злокачественных опухолей костей — сарком Общие принципы определения показаний к удалению отдельных зубов
Общие принципы определения показаний к удалению отдельных зубов Профилактика и диагностика врожденных патологий плода
Профилактика и диагностика врожденных патологий плода План курса Общая нейрофизиология
План курса Общая нейрофизиология Өкпенің созылмалы обструктивті ауруы
Өкпенің созылмалы обструктивті ауруы Острый вирусный гепатит В (VHB )
Острый вирусный гепатит В (VHB ) Отек легких
Отек легких Экстренная специфическая профилактика инфекционных болезней
Экстренная специфическая профилактика инфекционных болезней Екстракtи рідкі, густі та сухі
Екстракtи рідкі, густі та сухі Фармацевтическая опека пациентов при аллергии
Фармацевтическая опека пациентов при аллергии Новые подходы к лечению обструктивных заболеваний легких
Новые подходы к лечению обструктивных заболеваний легких Лор ағзалардың құрылымы мен топографиясының жасқа байланысты ерекшеліктері.Лор ағзалардың патологиясындағы маңызы
Лор ағзалардың құрылымы мен топографиясының жасқа байланысты ерекшеліктері.Лор ағзалардың патологиясындағы маңызы Лечебная гимнастика и массаж при вибрационной болезни
Лечебная гимнастика и массаж при вибрационной болезни Психология детей с нарушениями опорно-двигательного аппарата (ДЦП)
Психология детей с нарушениями опорно-двигательного аппарата (ДЦП) Растения, содержащие вещества, действующие на сердечно-сосудистую систему
Растения, содержащие вещества, действующие на сердечно-сосудистую систему Вербальный этикет. Этика и деонтология медицинской сестры
Вербальный этикет. Этика и деонтология медицинской сестры Заболевания глазницы
Заболевания глазницы Лекция 9. Снотворные, противоэпилептические и противопаркинсонические средства
Лекция 9. Снотворные, противоэпилептические и противопаркинсонические средства Медико – біологічні основи паразитизму. Найпростіші - паразити людини. Лекція 11
Медико – біологічні основи паразитизму. Найпростіші - паразити людини. Лекція 11 Босанған әйелдің гигиена және диетасы
Босанған әйелдің гигиена және диетасы Левый желудочек
Левый желудочек