Содержание
- 2. Врожденный (неспецифический) иммунитет слизистых. Гуморальное звено. Барьерные белки (мукус)-муцины Дефензины α Дефензины β Кателицидины Лектины -коллектины
- 3. Врожденный (неспецифический) иммунитет слизистых. Клеточное звено. Дендритные клетки Моноциты/макрофаги Интраэпителиальные Т-лимфоциты Нейтрофилы Тучные клетки Эозинофилы Естественные
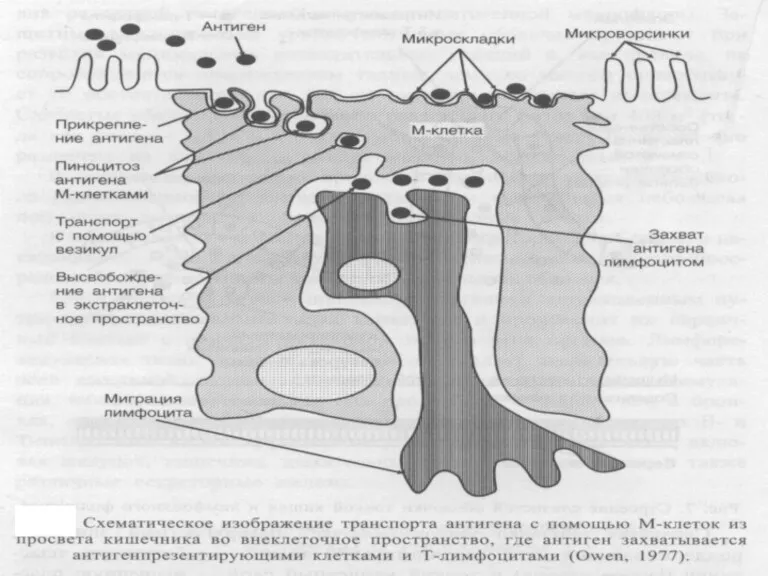
- 4. Приобретенный (специфический) иммунитет слизистых характеризуется: 1. Наличием специфических эпителиальных клеток для специфического захвата антигена, т.н. М-клетки.
- 5. Продолжение: 4. Наличием В-лимфоцитов – предшественников IgA-секретирующих плазматических клеток, которые примируются на территории фолликулов. 5. Способностью
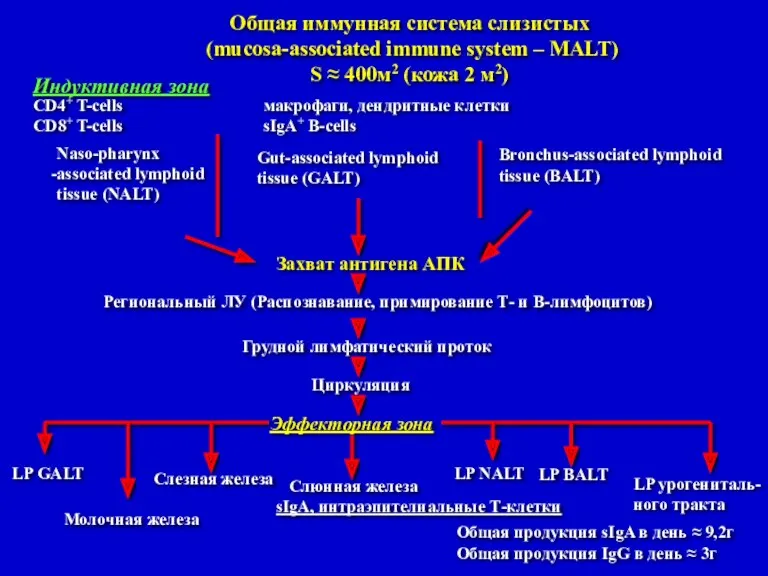
- 6. Индуктивная зона CD4+ T-cells макрофаги, дендритные клетки CD8+ T-cells sIgA+ B-cells Общая иммунная система слизистых (mucosa-associated
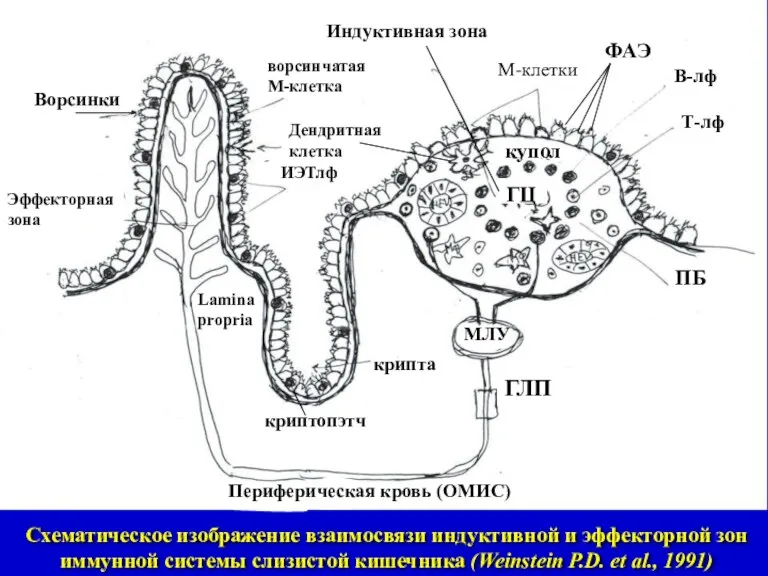
- 7. Схематическое изображение взаимосвязи индуктивной и эффекторной зон иммунной системы слизистой кишечника (Weinstein P.D. et al., 1991)
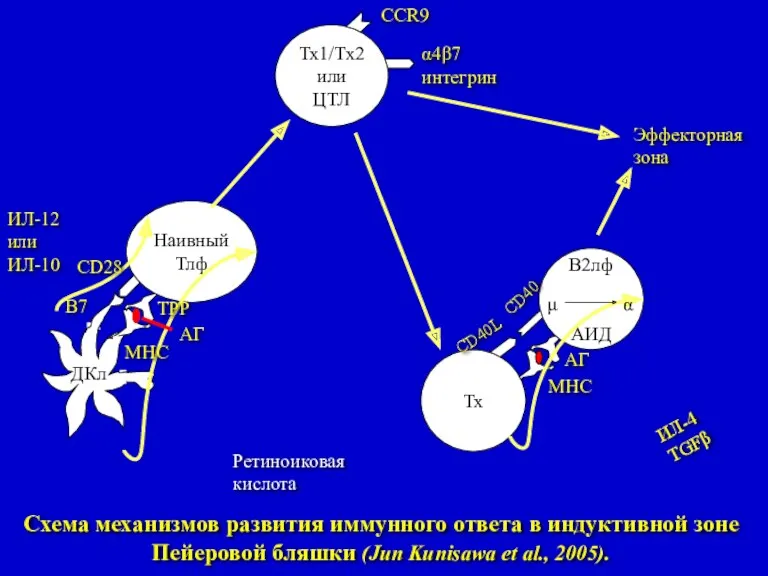
- 9. Наивный Тлф Тх В2лф АИД Тх1/Тх2 или ЦТЛ α μ ИЛ-4 TGFβ АГ МНС CD40L CD40
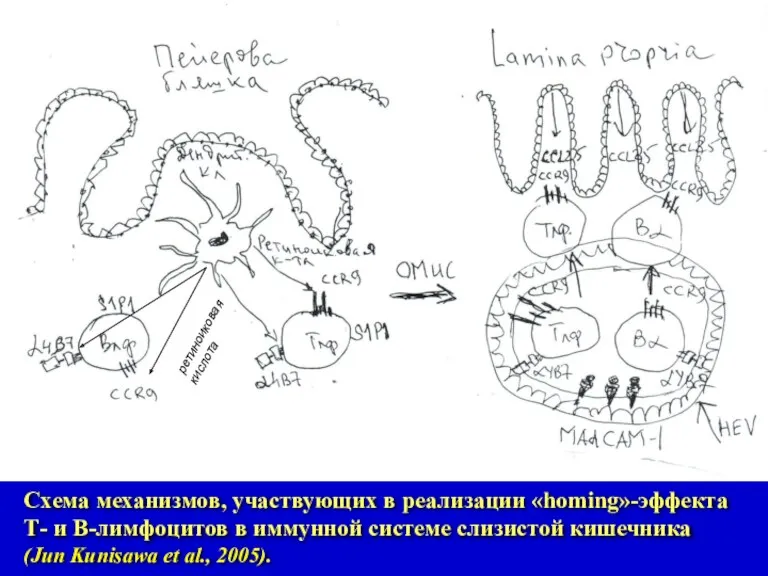
- 10. Схема механизмов, участвующих в реализации «homing»-эффекта Т- и В-лимфоцитов в иммунной системе слизистой кишечника (Jun Kunisawa
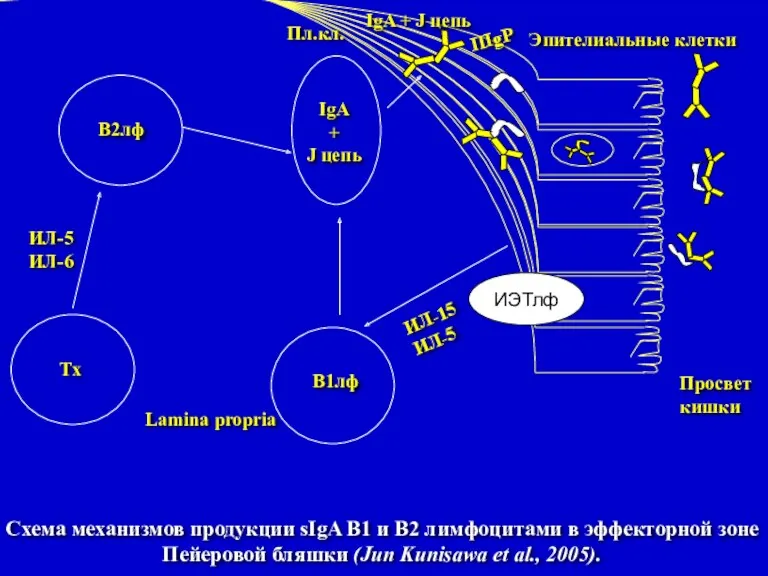
- 11. Схема механизмов продукции sIgA В1 и В2 лимфоцитами в эффекторной зоне Пейеровой бляшки (Jun Kunisawa et
- 12. секреторный IgA; мукозальные цитотоксические СД8+ αβ Т-лимфоциты (распознавание мишени за счет молекул ГКГ класса I); интраэпителиальные
- 13. МИКРОБИОТА
- 14. Благодаря работам И.И. Мечникова и Л. Пастера стало понятным, что нормальная микрофлора (микробиота) пищеварительного канала играет
- 15. Основные эффекты физиологической микрофлоры 1) Колонизационная резистентность колонизация эпителиальной зоны; межмикробный антагонизм (снижение жизнеподдерживающего субстрата и/или
- 16. 2) детоксикация (инактивация энтерокиназы, щелочной фосфатазы); 3)ферментативная функция (гидролиз продуктов метаболизма белков, липидов, углеводов); 4) пищеварительная
- 17. Важная роль взаимодействия физиологической микрофлоры и иммунной системы 1. Формирование и последующее поддержание иммунной системы слизистых
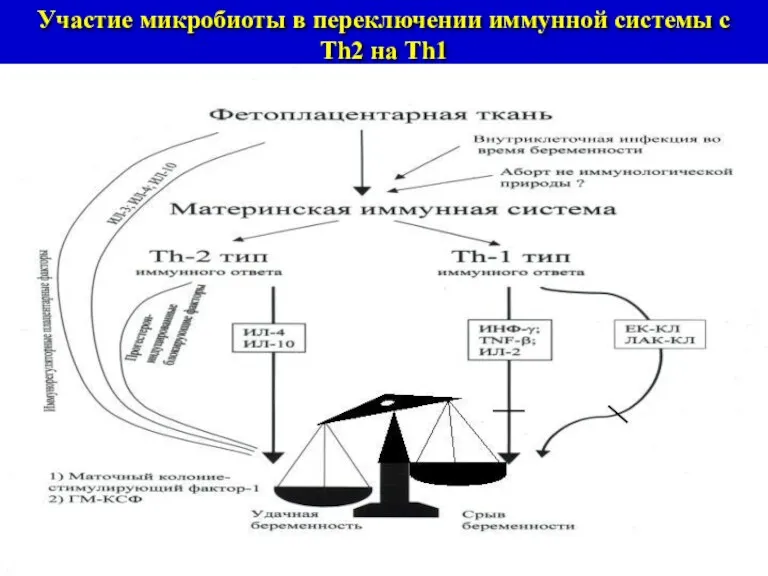
- 18. Участие микробиоты в переключении иммунной системы с Th2 на Тh1
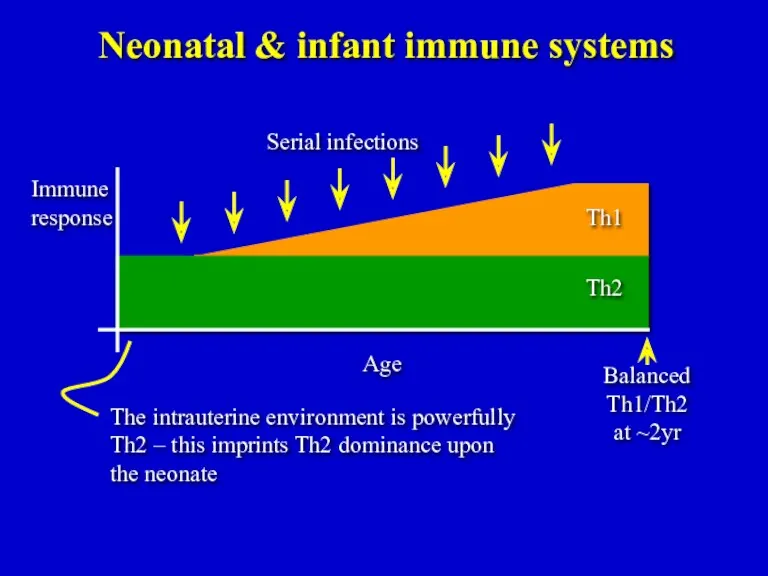
- 19. Balanced Th1/Th2 at ~2yr Neonatal & infant immune systems The intrauterine environment is powerfully Th2 –
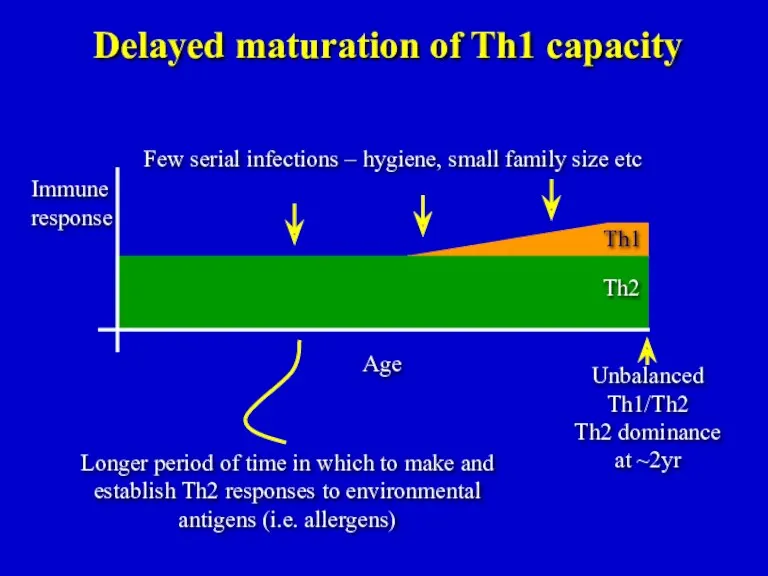
- 20. Th1 Th2 Unbalanced Th1/Th2 Th2 dominance at ~2yr Delayed maturation of Th1 capacity Few serial infections
- 21. Создание и поддержание толерантности к пищевым и микробным антигенам
- 22. Макромолекулы преодолевают кишечный барьер через: Межэпителиальные промежутки, особенно при «открытии» зон смыкания. Межэпителиальный транспорт приводит к
- 23. Оральная толерантность – такая форма толерантности, при которой зрелые лимфоциты локальной и периферической лимфоидной ткани теряют
- 24. Механизмы оральной толерантности. Клональная делеция – гибель Т-лимфоцитов под влиянием высоких доз антигена. 2. Клональная анергия
- 25. Иммунологический парадокс (Война и мир на поверхности слизистых) (Sansonetti, 2007) В организме человека сосуществуют ТОЛЕРАНТНОСТЬ к
- 26. Механизмы поддержания «физиологического воспаления» и толерантности. Микробы комменсалы образуют биопленки в слизи, что обеспечивает дистанцию от
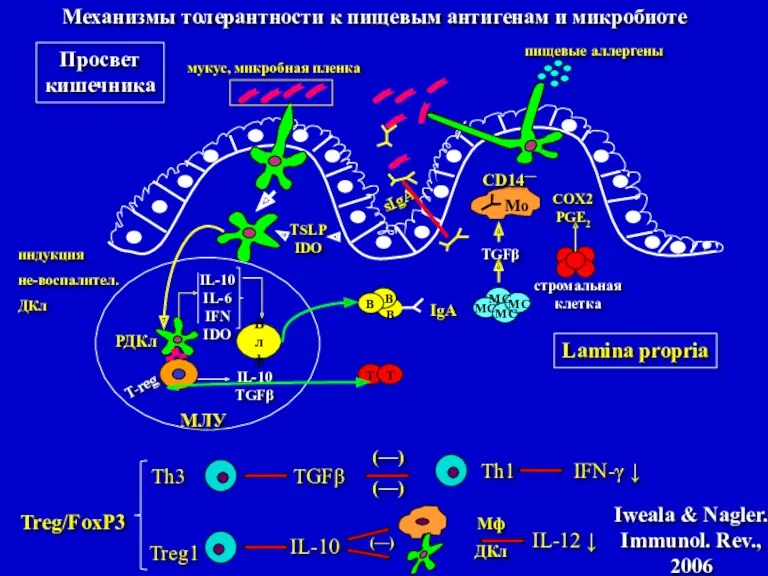
- 27. пищевые аллергены sIgA мукус, микробная пленка Просвет кишечника Влф IL-10 IL-6 IFN IDO T-reg РДКл IL-10
- 28. Относительная толерантность эпителиоцитов к комменсалам связана с двумя механизмами: пассивный – комменсалы и их продукты не
- 29. Относительная толерантность иммунной системы слизистых к микробиоте обеспечивает «физиологический» характер перманентного воспаления.
- 30. Управление провоспалительными механизмами
- 31. Пероксисомального пролифератора-активатора рецептор γ (PPARγ) принадлежит к семейству ядерных транскрипционных факторов, был открыт в 1993 году
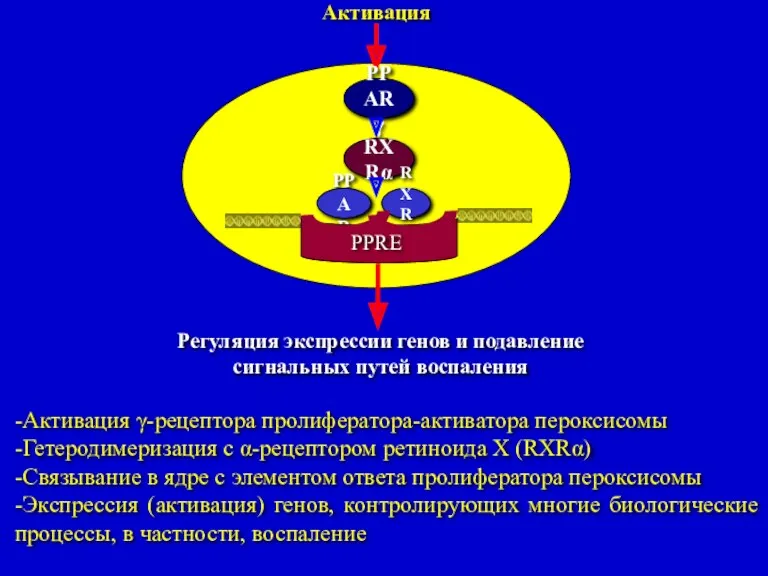
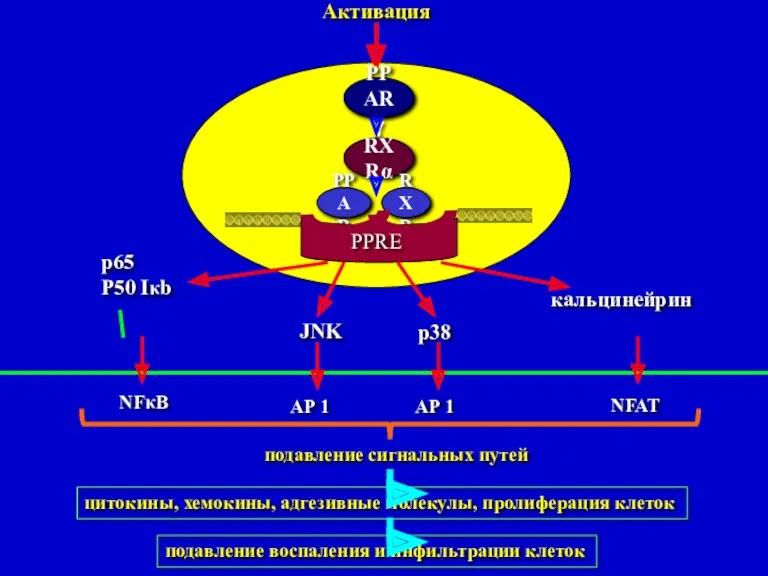
- 32. Активация PPARγ RXRα PPAR RXRα PPRE Регуляция экспрессии генов и подавление сигнальных путей воспаления -Активация γ-рецептора
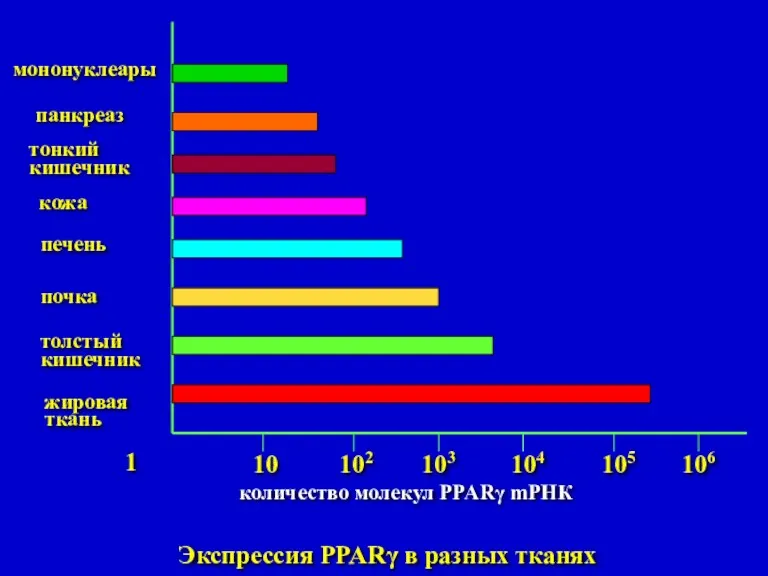
- 33. 1 10 102 103 104 105 106 мононуклеары панкреаз тонкий кишечник кожа печень почка толстый кишечник
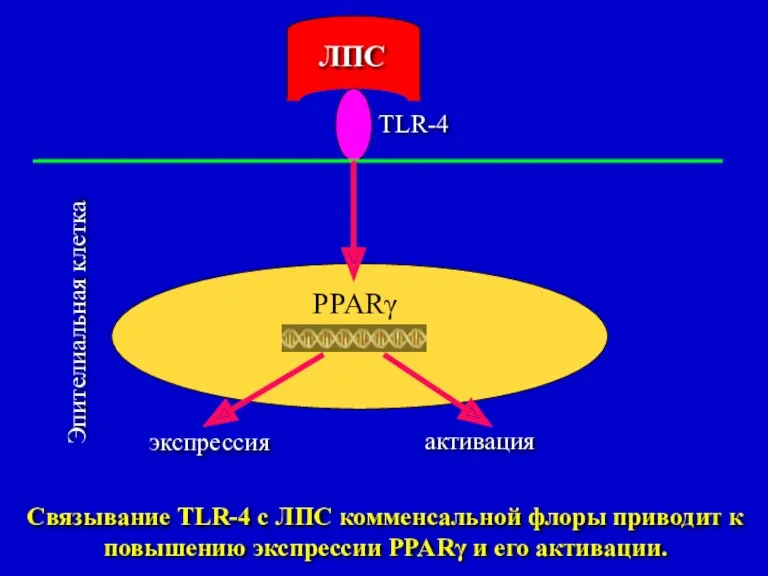
- 34. PPARγ ЛПС Эпителиальная клетка TLR-4 экспрессия активация Связывание TLR-4 с ЛПС комменсальной флоры приводит к повышению
- 35. Экспрессия PPARγ зависит от LPS, который принадлежит комменсальной флоре. Отсутствие PPARγ на поверхности эпителиальных клеток кишечника
- 36. Активация PPARγ RXRα PPAR RXR PPRE p65 P50 Iκb JNK p38 кальцинейрин NFκB AP 1 AP
- 37. ПРОБИОТИКИ
- 38. Идея употребления в пищу живых молочнокислых бактерий, оказывающих благоприятный эффект на организм человека, принадлежит И.И.Мечникову (1908),
- 39. Основные эффекты пробиотиков. 1. Нормализация барьерной функции эпителия (tight junction, zona occludens). 2. Улучшение микроэкологии кишечника
- 40. В контексте пробиотических продуктов питания определение «пробиотик» звучит следующим образом: «продукт, содержащий живые микроорганизмы в достаточном
- 41. Компания Данон создала пробиотический продукт Actimel, который содержит 2 обычно используемых пробиотических йогуртовых штамма, а также
- 42. -ингибирует ротавирусную инфекцию; -индуцирует секреторную активность клеток Панета; -подавляет увеличение индуцированной энтеропатогенными кишечными палочками парацеллюлярной проницаемости;
- 43. L.casei IMUNITASS (DEFENSIS): -модулирует врожденный клеточно-опосредованный иммунный ответ во время интенсивных физических нагрузок (Pujol P. и
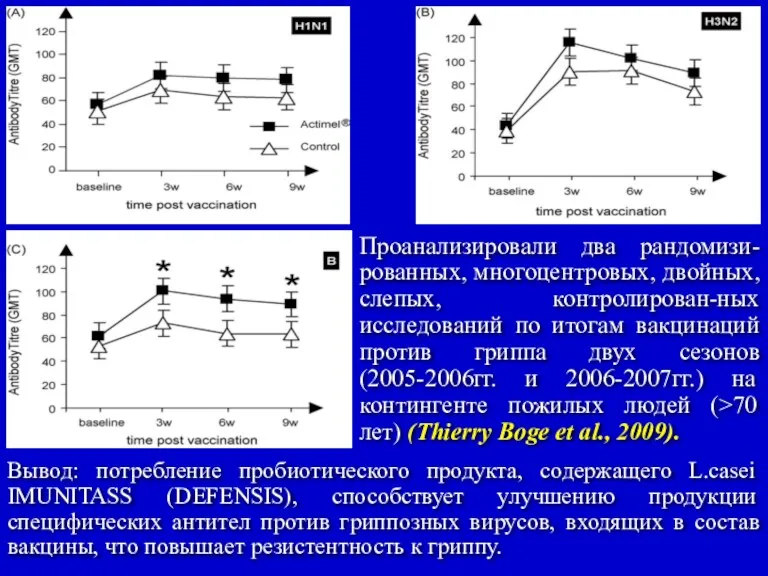
- 44. -усиливает иммунный ответ против гриппозной вакцины у пожилый людей (Aubin J.T. et al., 2007); -способствует более
- 45. Проанализировали два рандомизи-рованных, многоцентровых, двойных, слепых, контролирован-ных исследований по итогам вакцинаций против гриппа двух сезонов (2005-2006гг.
- 46. Положительный эффект пробиотиков доказан при следующих заболеваниях (состояниях). Диарея, ассоциированная с применением антибиотиков. Непереносимость лактозы. Атопический
- 47. Есть данные по эффективности пробиотиков при: Воспалительные заболевания желудочно-кишечного тракта (болезнь Крона, неспецифический язвенный колит). Рак
- 48. Факторы риска при приеме пробиотиков. Большие: 1. Тяжелые иммунодефициты, включая наличие опухолей. 2. Недоношенность. Малые: Диарея,
- 49. «Дисбиоз – обязательный спутник любых стрессовых воздействий на организм. Одним из важнейших условий сохранения здоровья является
- 51. Скачать презентацию

































 Аритмия. Нарушения ритма сердца
Аритмия. Нарушения ритма сердца Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар
Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар Гипоталамо-гипофизарлы семіздіктің визуалды диагностикасы
Гипоталамо-гипофизарлы семіздіктің визуалды диагностикасы Реабилитация недоношенных детей: особенности оценки физического развития и питания после выписки из стационара
Реабилитация недоношенных детей: особенности оценки физического развития и питания после выписки из стационара Organizations of different kinds of therapeutic-and-prophylactic help to population
Organizations of different kinds of therapeutic-and-prophylactic help to population Typhoid
Typhoid Meningococcal infection
Meningococcal infection Преднизолон. Фармакотерапевтическая группа
Преднизолон. Фармакотерапевтическая группа Протоколы реабилитации коленного сустава: от предоперационной подготовки до возврата к прежнему уровню спортивной активности
Протоколы реабилитации коленного сустава: от предоперационной подготовки до возврата к прежнему уровню спортивной активности Статеві гормони. Гормони наднирників. Гормони щитовидної залози. Гормони нейрогипофиза
Статеві гормони. Гормони наднирників. Гормони щитовидної залози. Гормони нейрогипофиза Инфекционные и неинфекционные заболевания. Профилактика
Инфекционные и неинфекционные заболевания. Профилактика Исследование мочи: физические и химические свойства
Исследование мочи: физические и химические свойства Сестринский уход за недоношенными детьми
Сестринский уход за недоношенными детьми Инфекционная безопасность в гибкой эндоскопии
Инфекционная безопасность в гибкой эндоскопии Рекомбинантные белки как лекарственные средства
Рекомбинантные белки как лекарственные средства Питающие устройства. Виды питающих устройств. Дозаторы.Питатели. Транспортные устройства и механизмы подачи
Питающие устройства. Виды питающих устройств. Дозаторы.Питатели. Транспортные устройства и механизмы подачи Расстройства кровообращения
Расстройства кровообращения Сестринский процесс при ревматоидном артрите, деформирующем остеоартрозе
Сестринский процесс при ревматоидном артрите, деформирующем остеоартрозе Пневмонии новорожденных. Этиология, патогенез, классификация, клиника
Пневмонии новорожденных. Этиология, патогенез, классификация, клиника Инфузионно-трансфузионная терапия. Показания и противопоказания
Инфузионно-трансфузионная терапия. Показания и противопоказания Ортодонтиялық емдеудің негізгі принциптер
Ортодонтиялық емдеудің негізгі принциптер Тыныс алу жүйесінің өмірге қауіпті зақымдануларының диагностикасы және жедел көмек көрсету алгоритмі
Тыныс алу жүйесінің өмірге қауіпті зақымдануларының диагностикасы және жедел көмек көрсету алгоритмі Особенности питания беременных женщин
Особенности питания беременных женщин Остановка наружного кровотечения
Остановка наружного кровотечения Системы здравоохранения. Задачи законодательства Российской Федерации об охране здоровья граждан
Системы здравоохранения. Задачи законодательства Российской Федерации об охране здоровья граждан Семиотика и диагностика заболеваний женской половой системы
Семиотика и диагностика заболеваний женской половой системы Glomerulonephritis in children chronic kidney failure
Glomerulonephritis in children chronic kidney failure Генные заболевания
Генные заболевания