Содержание
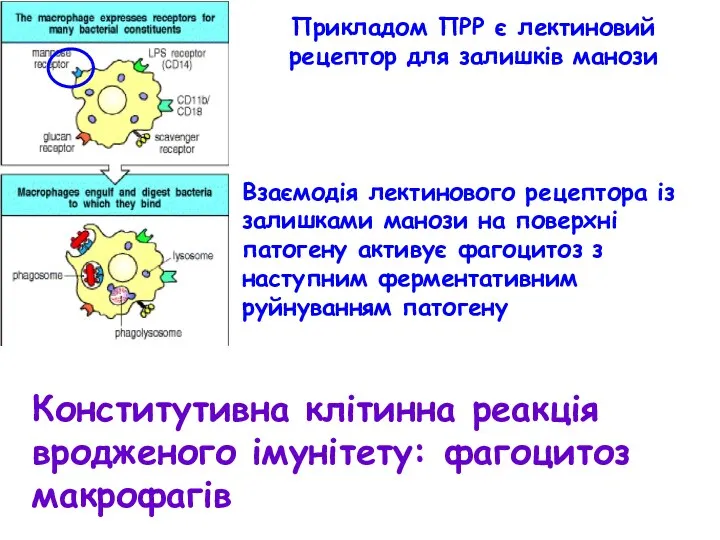
- 2. Конститутивна клітинна реакція вродженого імунітету: фагоцитоз
- 3. Диференціювання, фенотипово-функціональна характеристика фагоцитів
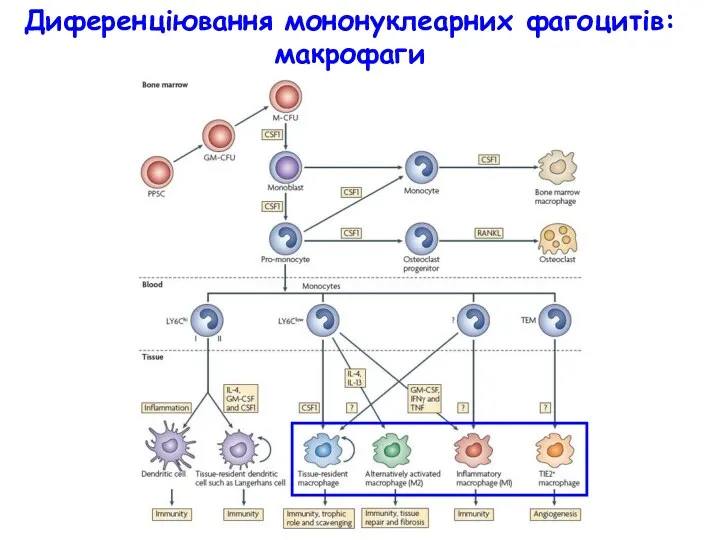
- 4. Диференціювання мононуклеарних фагоцитів: макрофаги
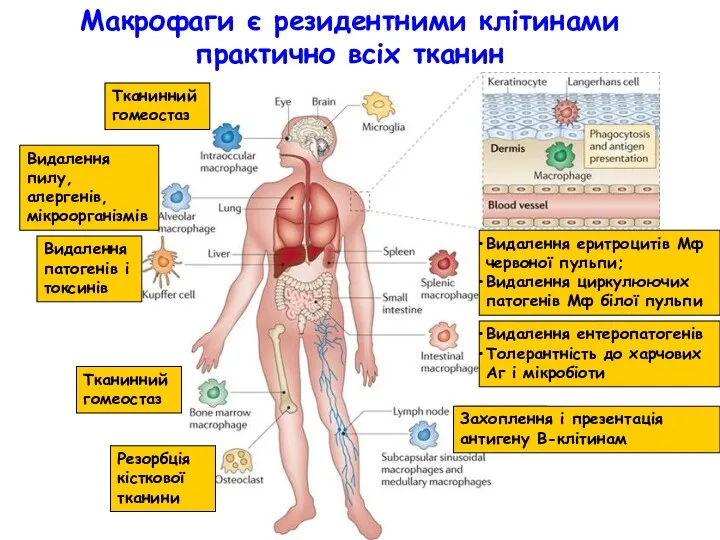
- 5. Макрофаги є резидентними клітинами практично всіх тканин Видалення пилу, алергенів, мікроорганізмів Видалення патогенів і токсинів Резорбція
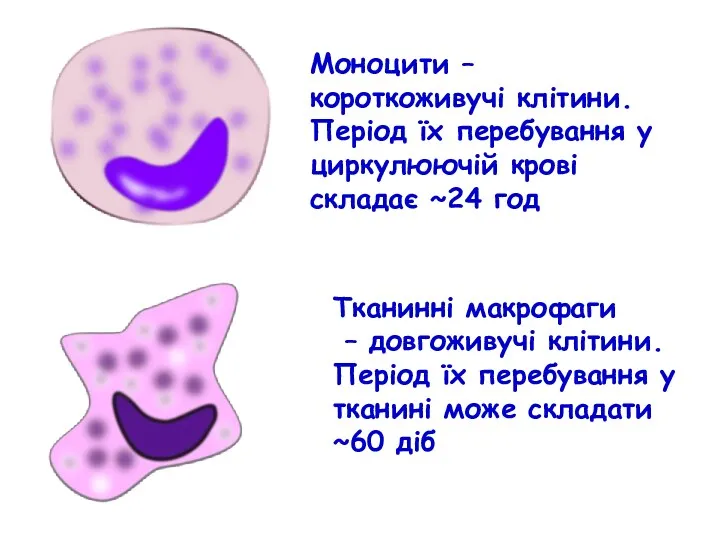
- 6. Моноцити – короткоживучі клітини. Період їх перебування у циркулюючій крові складає ~24 год Тканинні макрофаги –
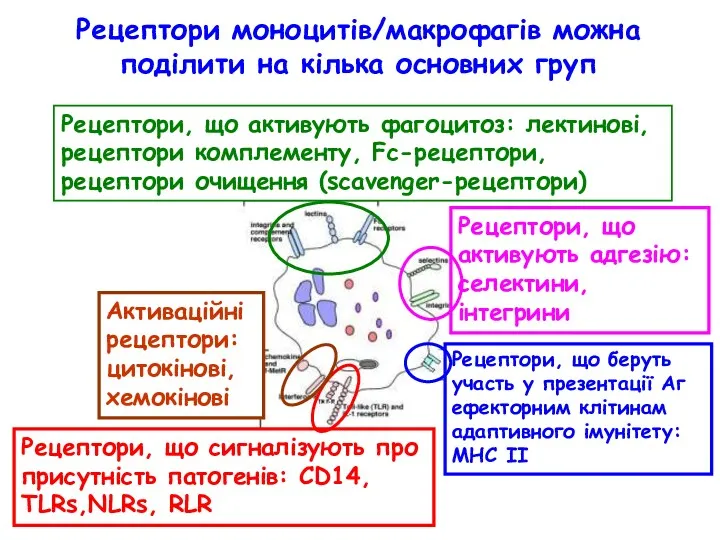
- 7. Рецептори моноцитів/макрофагів можна поділити на кілька основних груп Рецептори, що активують фагоцитоз: лектинові, рецептори комплементу, Fc-рецептори,
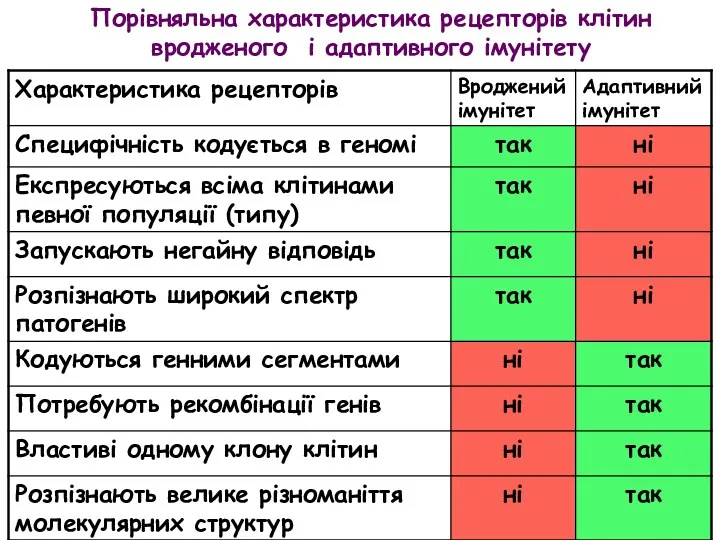
- 8. Порівняльна характеристика рецепторів клітин вродженого і адаптивного імунітету
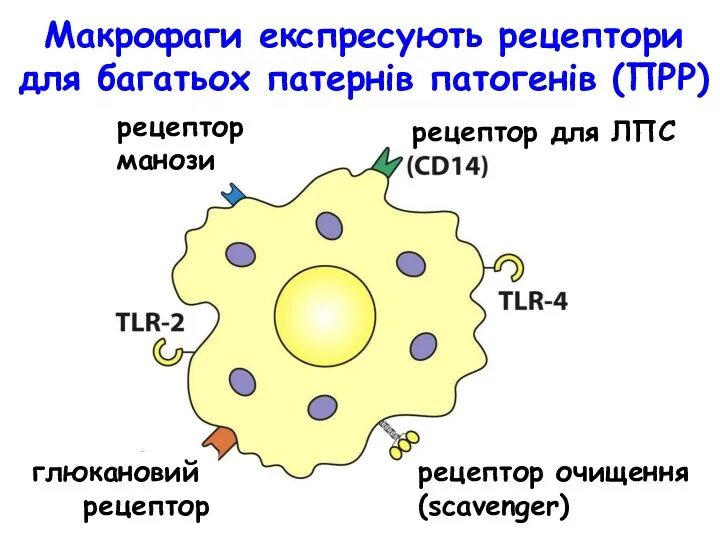
- 9. Макрофаги експресують рецептори для багатьох патернів патогенів (ПРР) рецептор манози рецептор для ЛПС ло глюкановий рецептор
- 10. Прикладом ПРР є лектиновий рецептор для залишків манози Взаємодія лектинового рецептора із залишками манози на поверхні
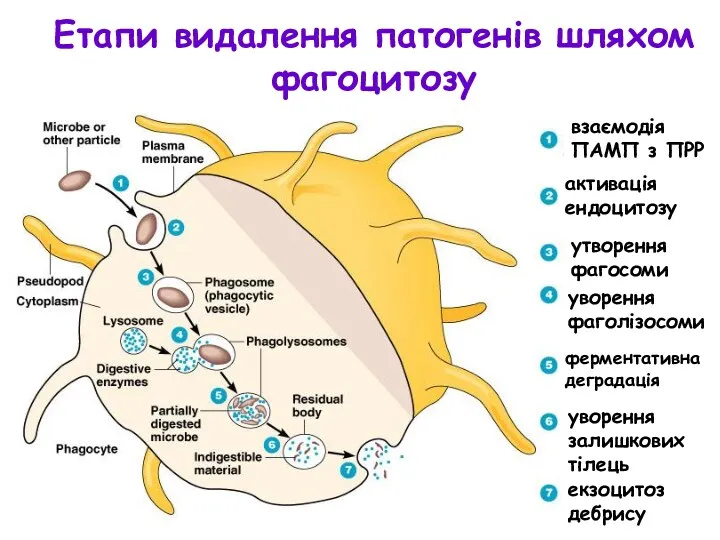
- 11. Етапи видалення патогенів шляхом фагоцитозу взаємодія ПАМП з ПРР активація ендоцитозу утворення фагосоми уворення фаголізосоми ферментативна
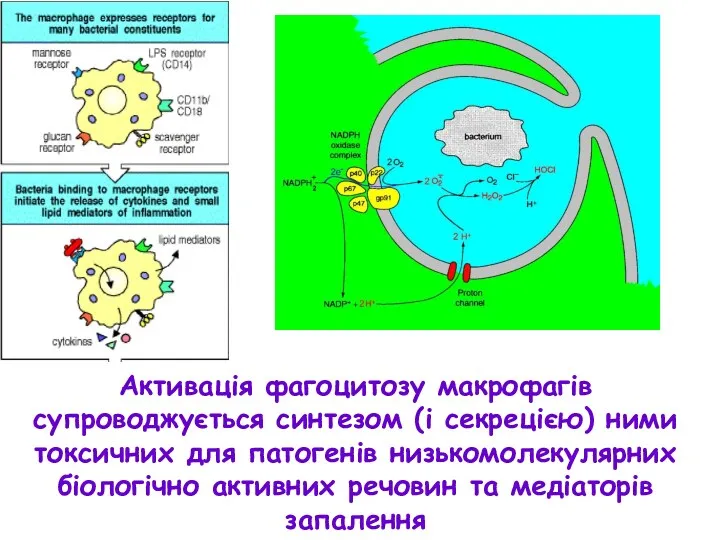
- 12. Активація фагоцитозу макрофагів супроводжується синтезом (і секрецією) ними токсичних для патогенів низькомолекулярних біологічно активних речовин та
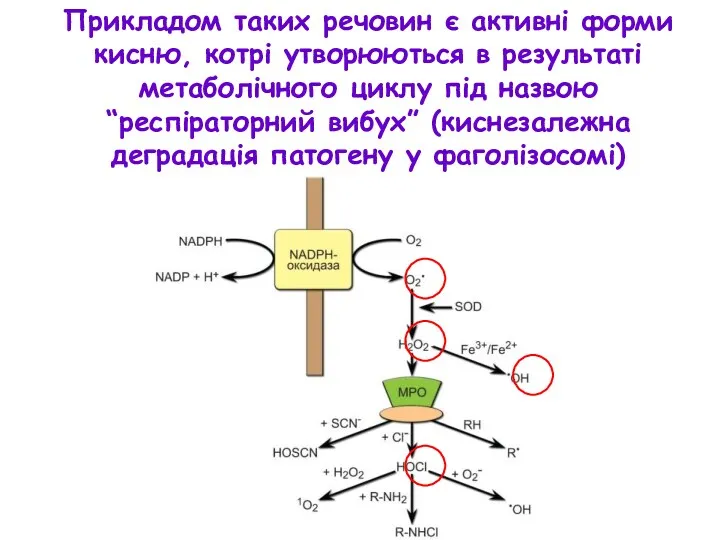
- 13. Прикладом таких речовин є активні форми кисню, котрі утворюються в результаті метаболічного циклу під назвою “респіраторний
- 14. Перелік біологічно активних речовин, виділення яких активується при лігуванні ПРР макрофагів
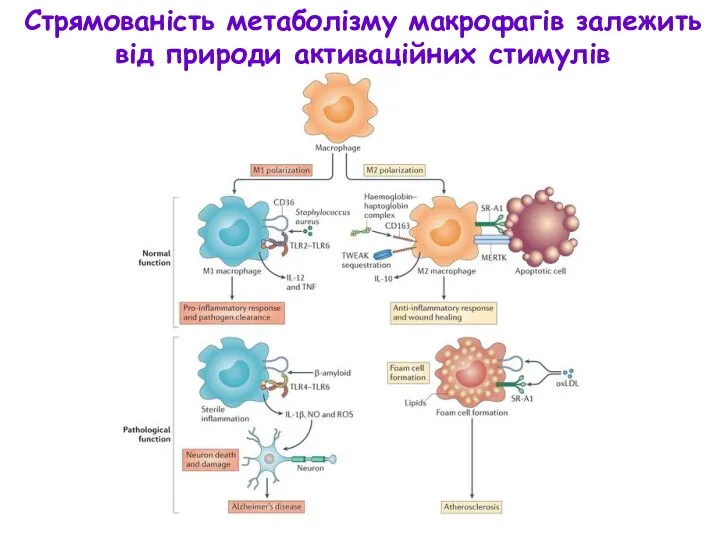
- 15. Стрямованість метаболізму макрофагів залежить від природи активаційних стимулів
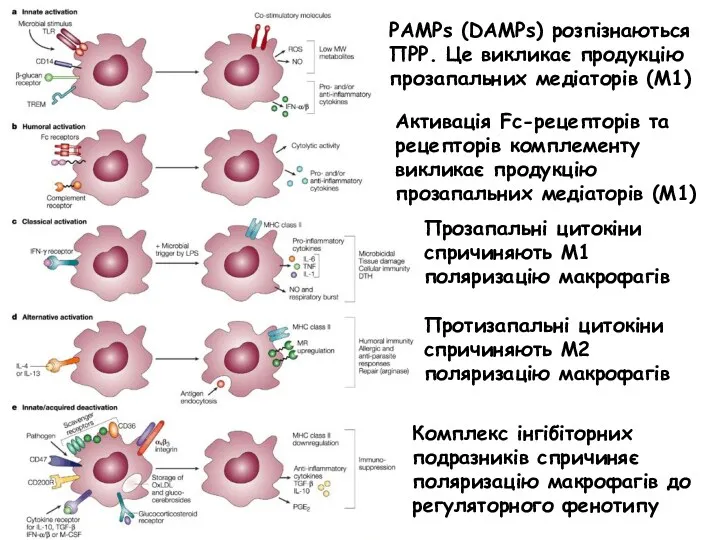
- 16. PAMPs (DAMPs) розпізнаються ПРР. Це викликає продукцію прозапальних медіаторів (М1) Активація Fc-рецепторів та рецепторів комплементу викликає
- 17. Clasters of Differentiation (designation), CD – номенклатура диференційних антигенів лейкоцитів людини. Застосовується для ідентифікації і дослідження
- 18. Зважаючи на функціональну пластичність макрофагів, виділяють кілька груп їх фенотипових маркерів, залежно від метаболічної поляризації цих
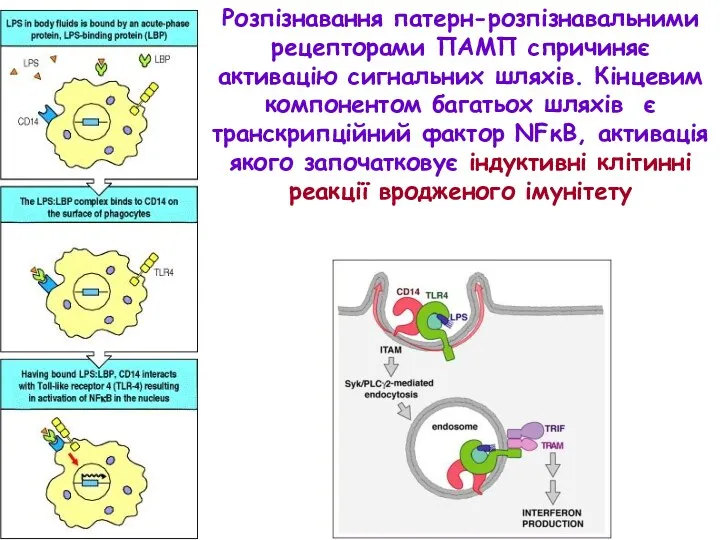
- 19. Розпізнавання патерн-розпізнавальними рецепторами ПАМП спричиняє активацію сигнальних шляхів. Кінцевим компонентом багатьох шляхів є транскрипційний фактор NFκB,
- 20. Індуктивні клітинні реакції вродженого імунітету
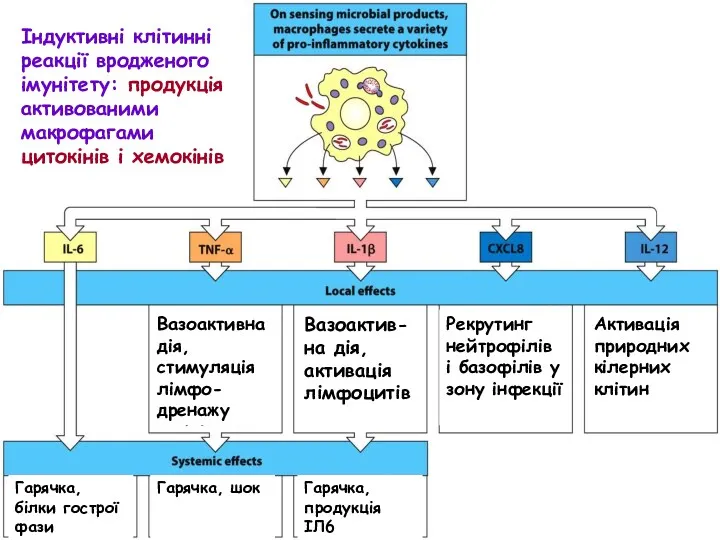
- 21. Індуктивні клітинні реакції вродженого імунітету: продукція активованими макрофагами цитокінів і хемокінів Вазоактивна дія, стимуляція лімфо-дренажу Вазоактив-на
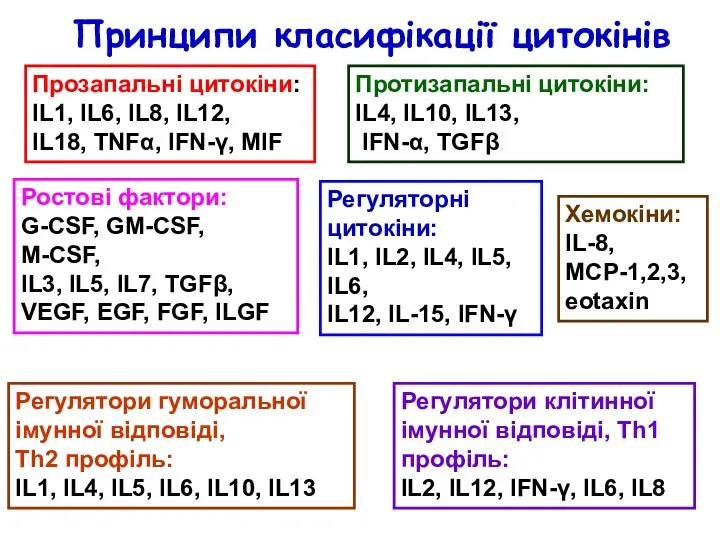
- 22. Цитокіни – низькомолекулярні (~30кДа) інформаційні молекули білкової природи, які регулюють міжклітинні та міжсистемні взаємодії (виживаність, проліферацію,
- 23. Ростові фактори: G-CSF, GM-CSF, M-CSF, IL3, IL5, IL7, TGFβ, VEGF, EGF, FGF, ILGF Прозапальні цитокіни: IL1,
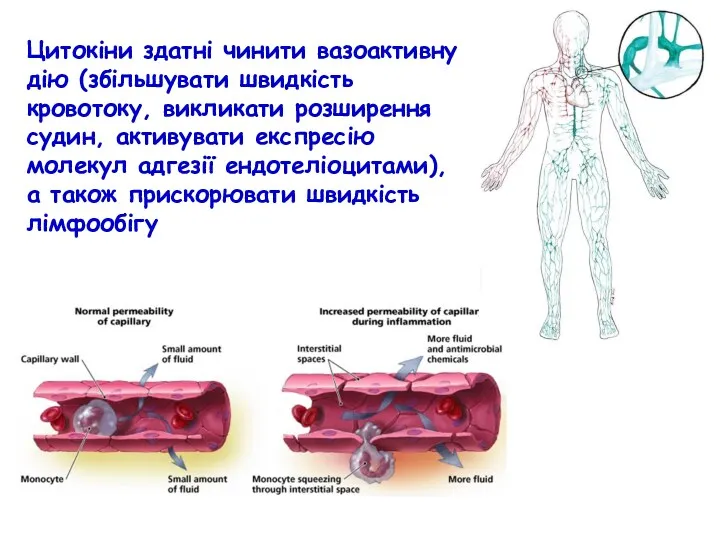
- 24. Цитокіни здатні чинити вазоактивну дію (збільшувати швидкість кровотоку, викликати розширення судин, активувати експресію молекул адгезії ендотеліоцитами),
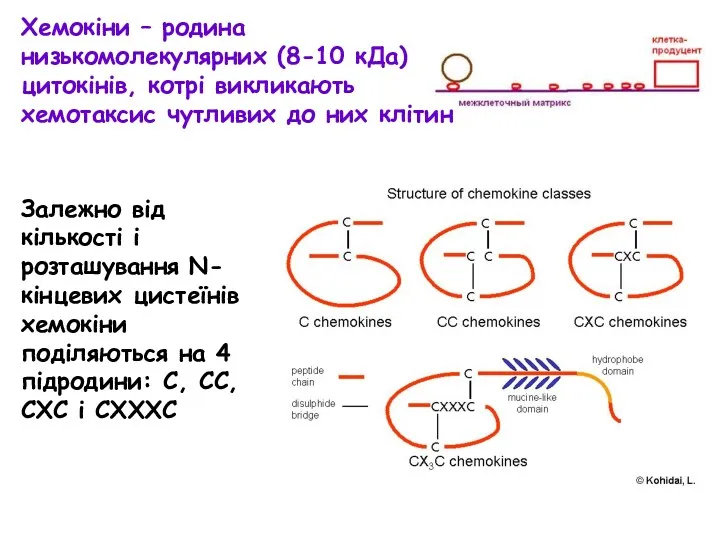
- 25. Хемокіни – родина низькомолекулярних (8-10 кДа) цитокінів, котрі викликають хемотаксис чутливих до них клітин Залежно від
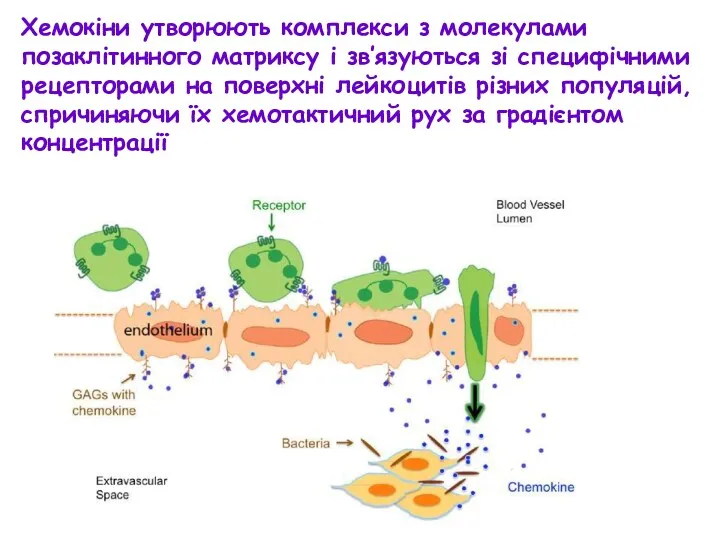
- 26. Хемокіни утворюють комплекси з молекулами позаклітинного матриксу і зв’язуються зі специфічними рецепторами на поверхні лейкоцитів різних
- 27. Взаємодія ПРР з ПАМП, а також дія цитокінів викликає активацію метаболізму арахідонової кислоти – основного субстрату
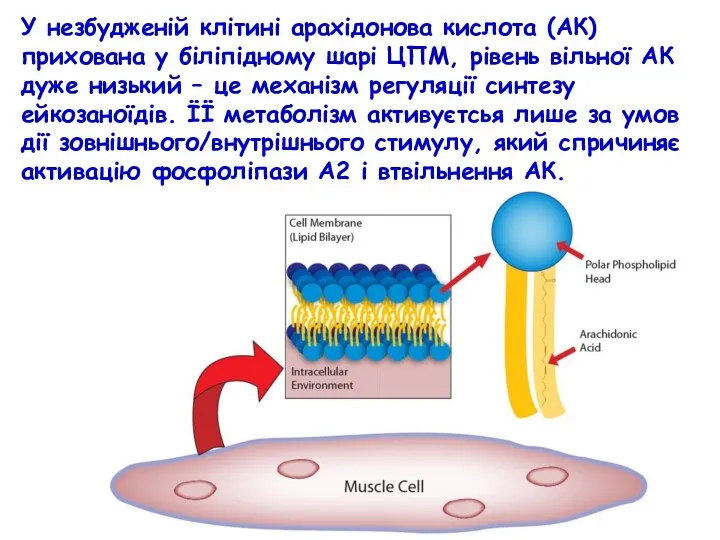
- 28. У незбудженій клітині арахідонова кислота (АК) прихована у біліпідному шарі ЦПМ, рівень вільної АК дуже низький
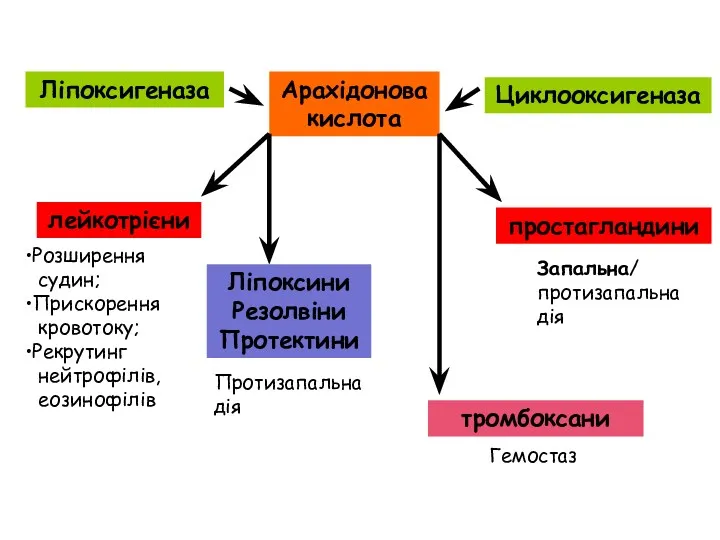
- 29. Арахідонова кислота Ліпоксигеназа лейкотрієни Розширення судин; Прискорення кровотоку; Рекрутинг нейтрофілів, еозинофілів Ліпоксини Резолвіни Протектини Протизапальна дія
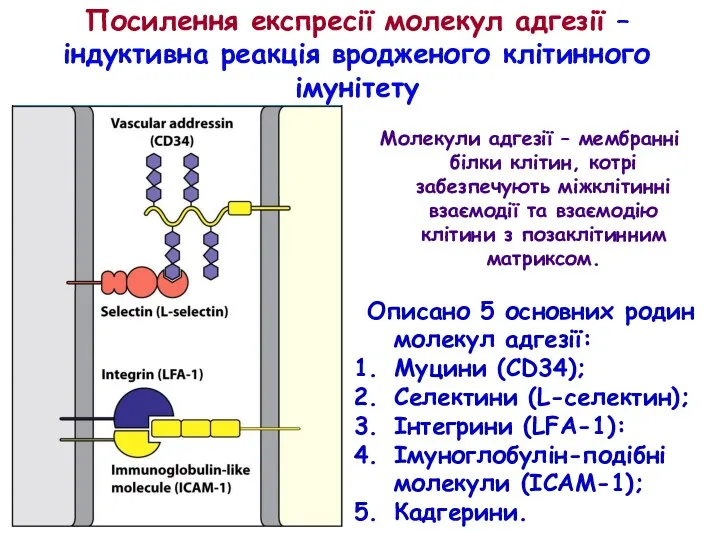
- 30. Описано 5 основних родин молекул адгезії: Муцини (CD34); Селектини (L-селектин); Інтегрини (LFA-1): Імуноглобулін-подібні молекули (ICAM-1); Кадгерини.
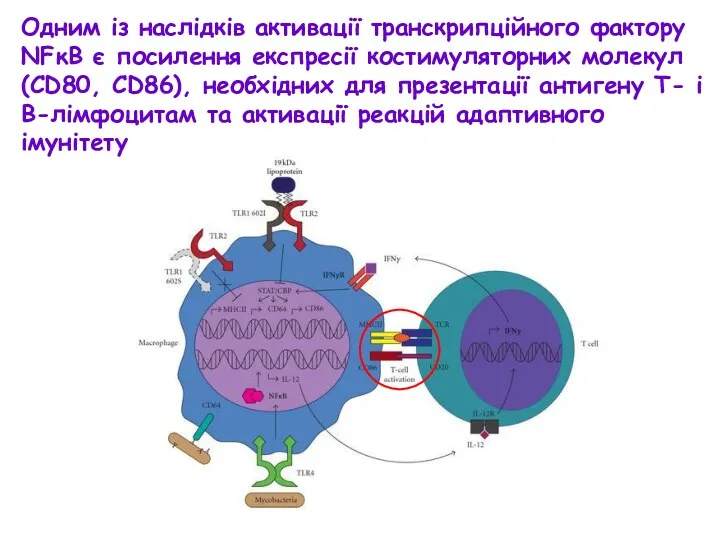
- 31. Одним із наслідків активації транскрипційного фактору NFκB є посилення експресії костимуляторних молекул (CD80, CD86), необхідних для
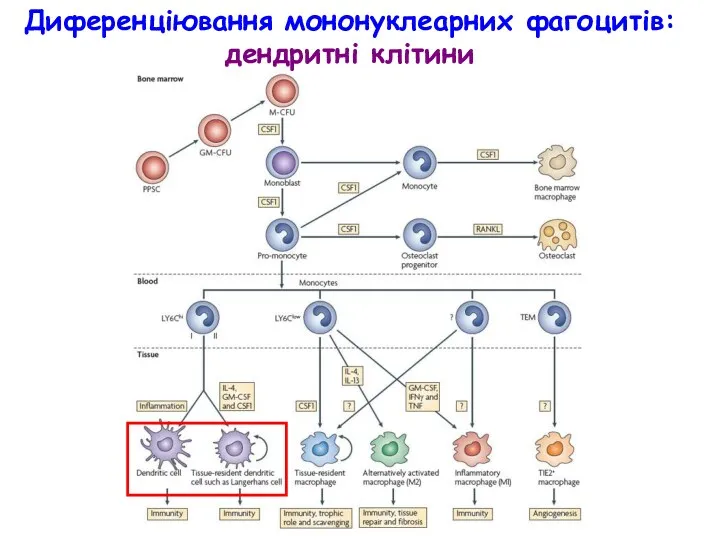
- 32. Диференціювання мононуклеарних фагоцитів: дендритні клітини
- 33. Мієлоїдні vs плазмоцитоїдні дендритні клітини
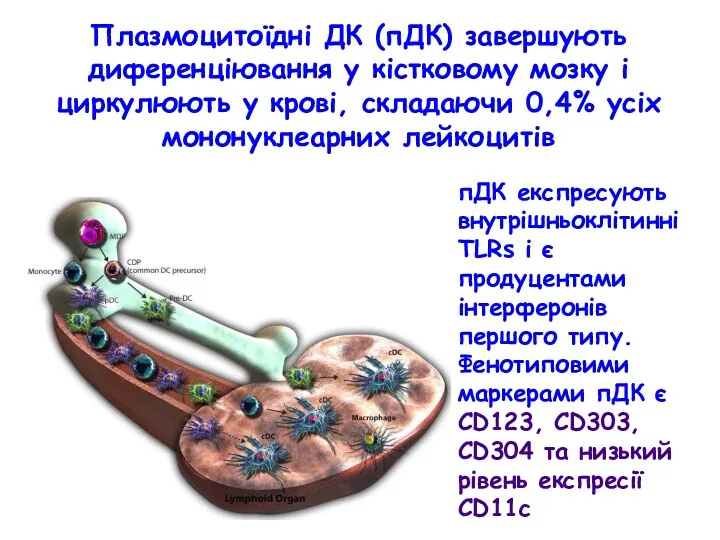
- 34. Плазмоцитоїдні ДК (пДК) завершують диференціювання у кістковому мозку і циркулюють у крові, складаючи 0,4% усіх мононуклеарних
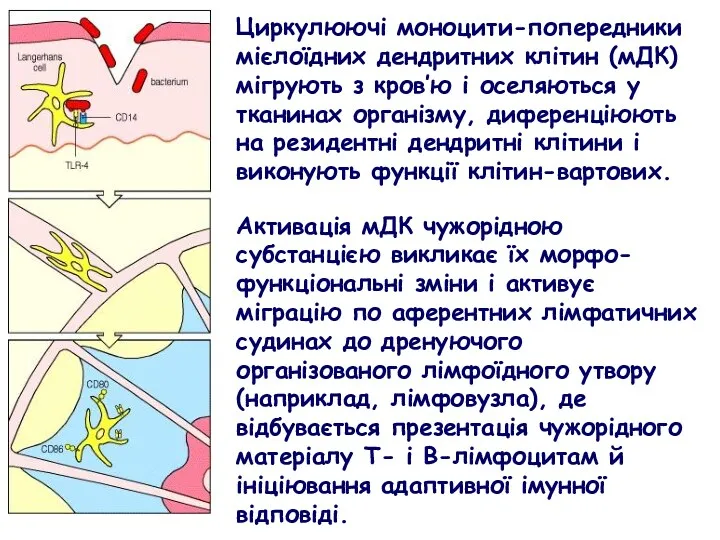
- 35. Циркулюючі моноцити-попередники мієлоїдних дендритних клітин (мДК) мігрують з кров’ю і оселяються у тканинах організму, диференціюють на
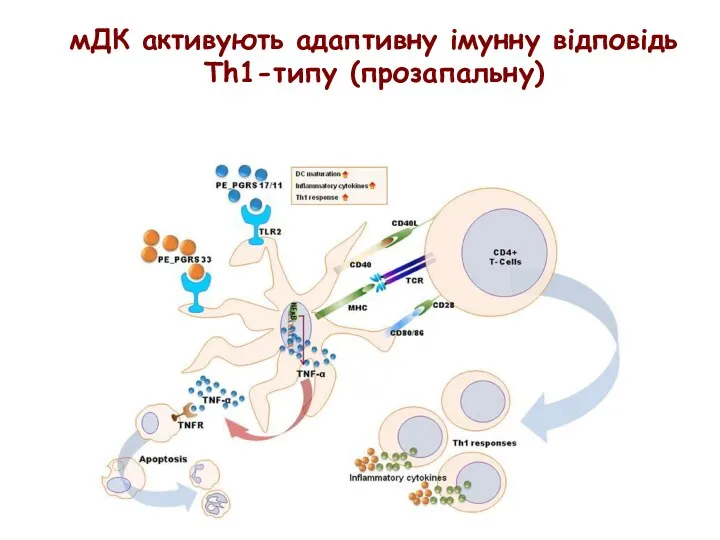
- 36. мДК активують адаптивну імунну відповідь Th1-типу (прозапальну)
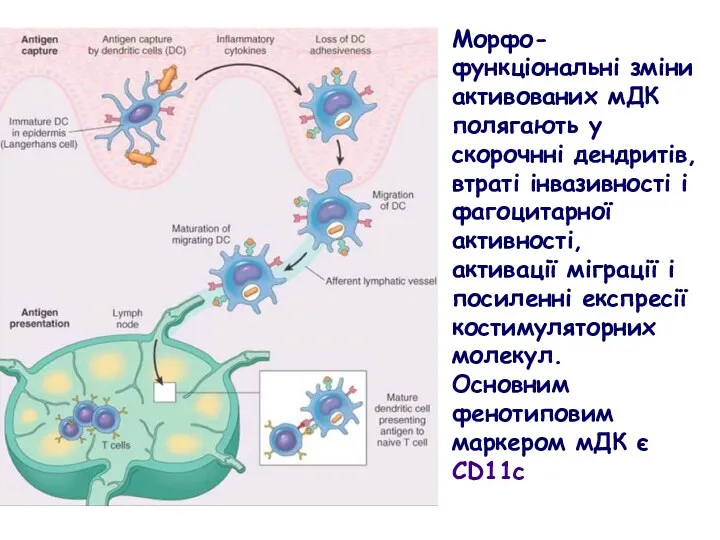
- 37. Морфо-функціональні зміни активованих мДК полягають у скорочнні дендритів, втраті інвазивності і фагоцитарної активності, активації міграції і
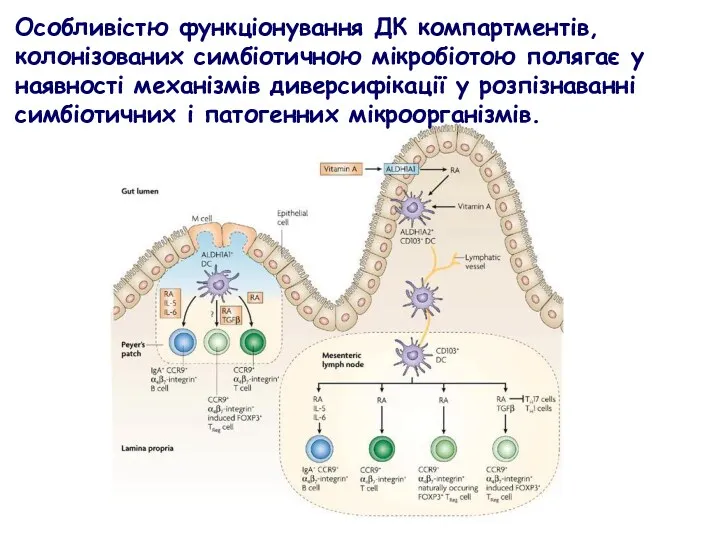
- 38. Особливістю функціонування ДК компартментів, колонізованих симбіотичною мікробіотою полягає у наявності механізмів диверсифікації у розпізнаванні симбіотичних і
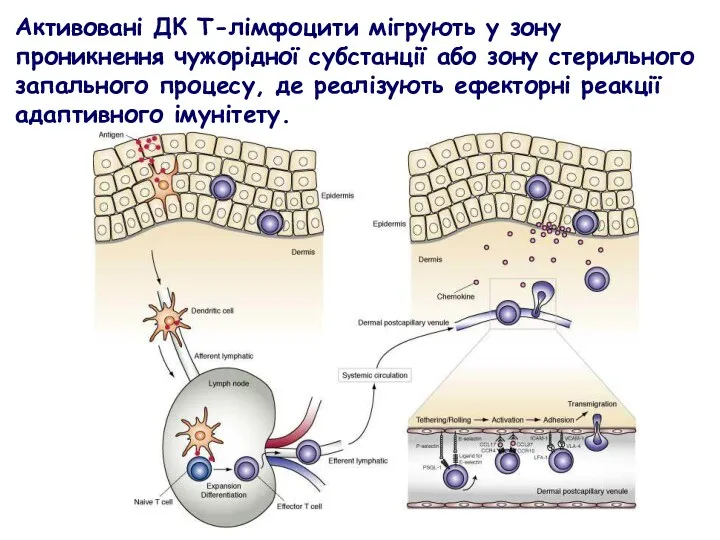
- 39. Активовані ДК Т-лімфоцити мігрують у зону проникнення чужорідної субстанції або зону стерильного запального процесу, де реалізують
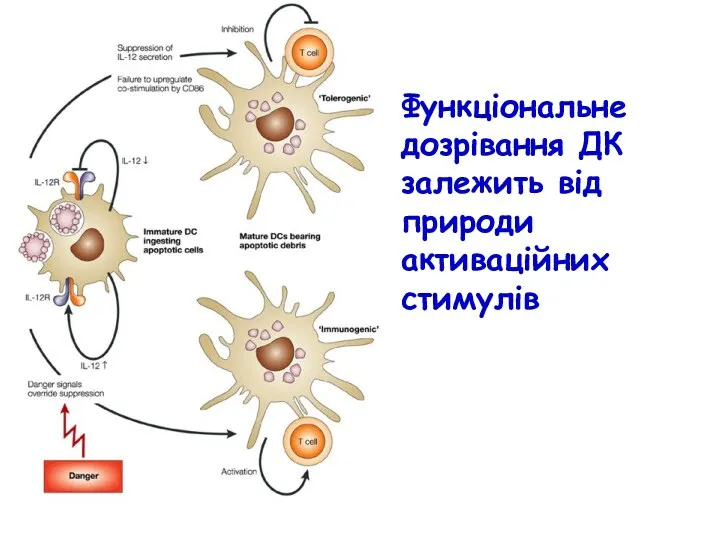
- 40. Функціональне дозрівання ДК залежить від природи активаційних стимулів
- 41. До індукованих реакцій вродженого імунітету належить рекрутинг і активація нейтрофілів (поліморфноядерних нейтрофільних гранулоцитів) короткоживучих фагоцитів, котрі
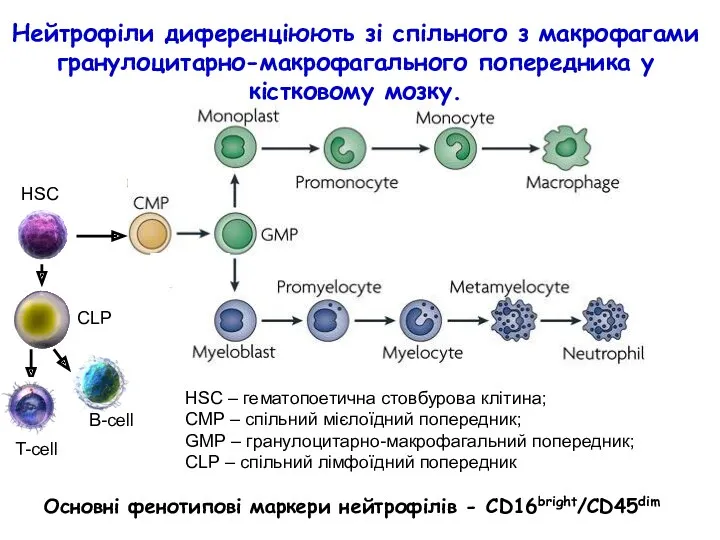
- 42. Нейтрофіли диференціюють зі спільного з макрофагами гранулоцитарно-макрофагального попередника у кістковому мозку. T-cell B-cell CLP HSC HSC
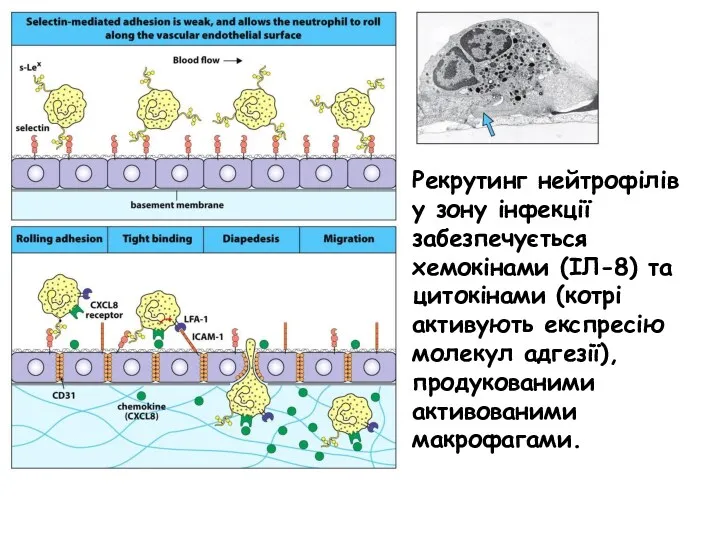
- 43. Рекрутинг нейтрофілів у зону інфекції забезпечується хемокінами (ІЛ-8) та цитокінами (котрі активують експресію молекул адгезії),продукованими активованими
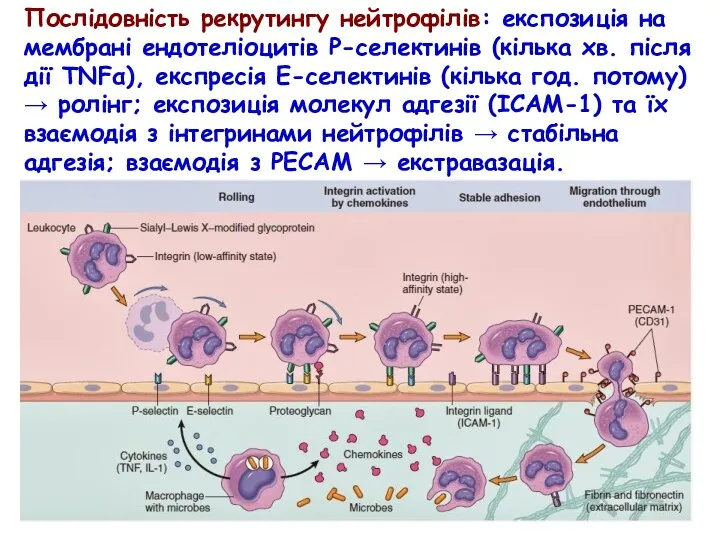
- 44. Послідовність рекрутингу нейтрофілів: експозиція на мембрані ендотеліоцитів Р-селектинів (кілька хв. після дії TNFα), експресія Е-селектинів (кілька
- 45. Нейтрофіли експресують широкий спектр ПРР, здатні до ендоцитозу інфекційних чинників з наступною їх деградацією у фаголізосомі,
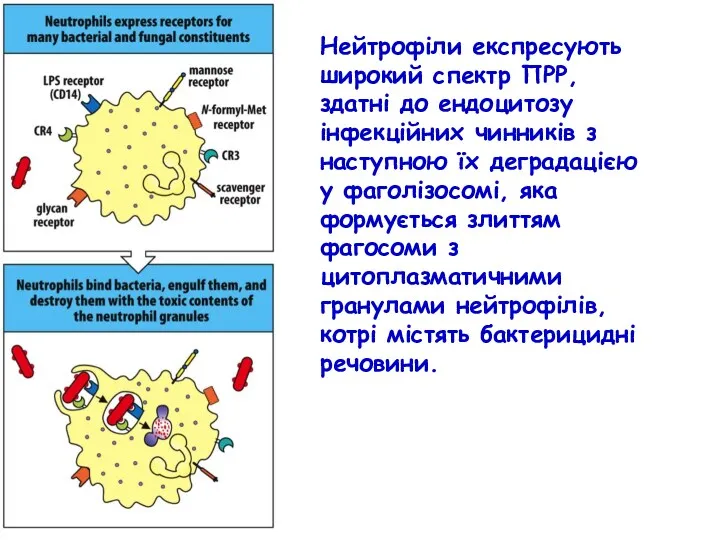
- 46. Нейтрофілам, як і макрофагам, властива продукція реактивних форм кисню
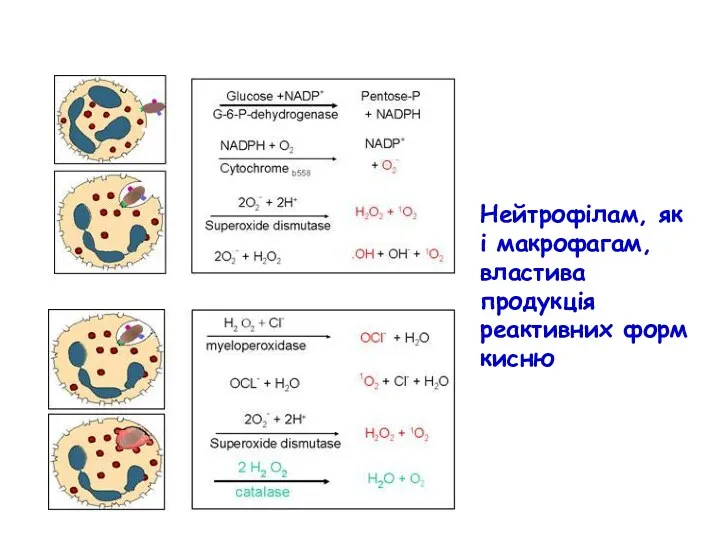
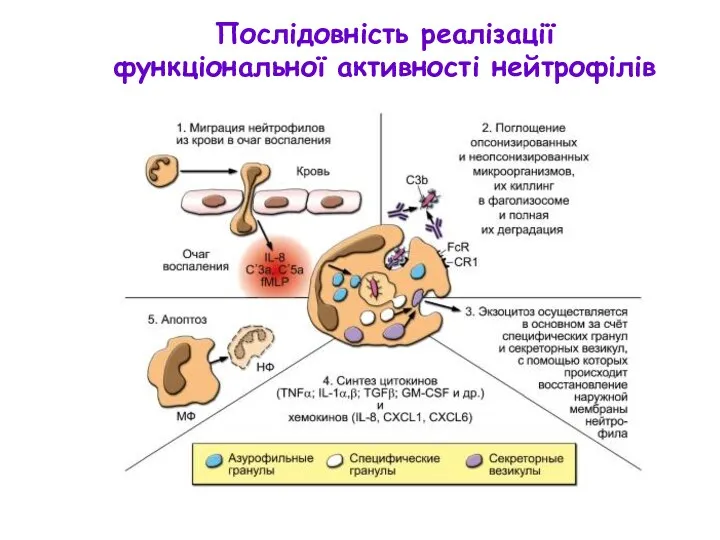
- 47. У відповідь на лігацію ПРР нейтрофіли вивільнюють вміст секреторних везикул і гранул (екзоцитоз) у наступній послідовності:
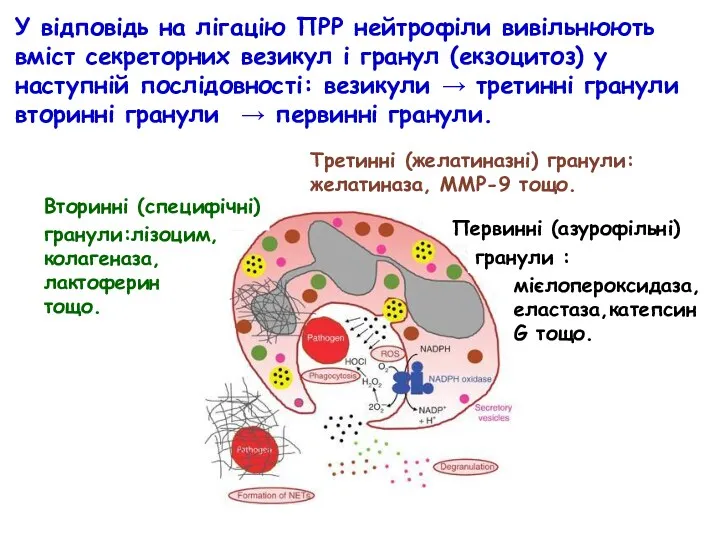
- 48. Послідовність реалізації функціональної активності нейтрофілів
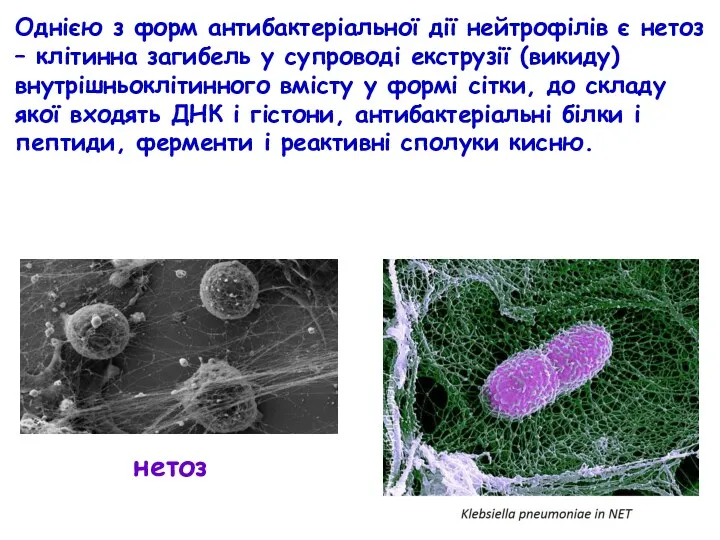
- 49. нетоз Однією з форм антибактеріальної дії нейтрофілів є нетоз – клітинна загибель у супроводі екструзії (викиду)
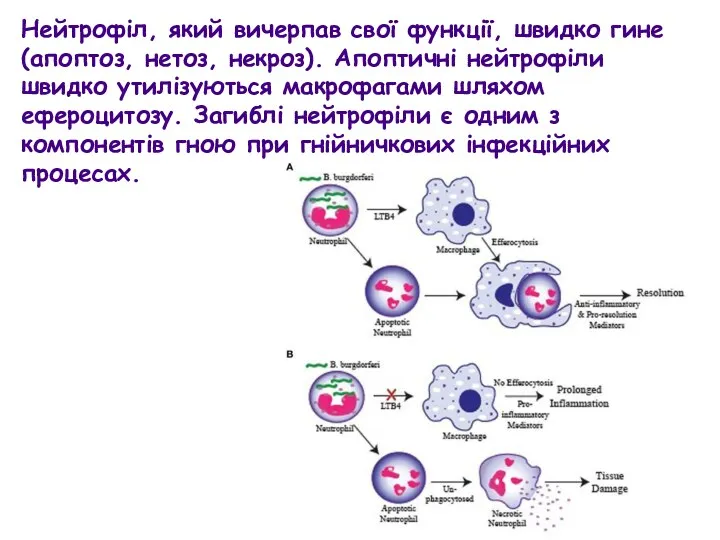
- 50. Нейтрофіл, який вичерпав свої функції, швидко гине (апоптоз, нетоз, некроз). Апоптичні нейтрофіли швидко утилізуються макрофагами шляхом
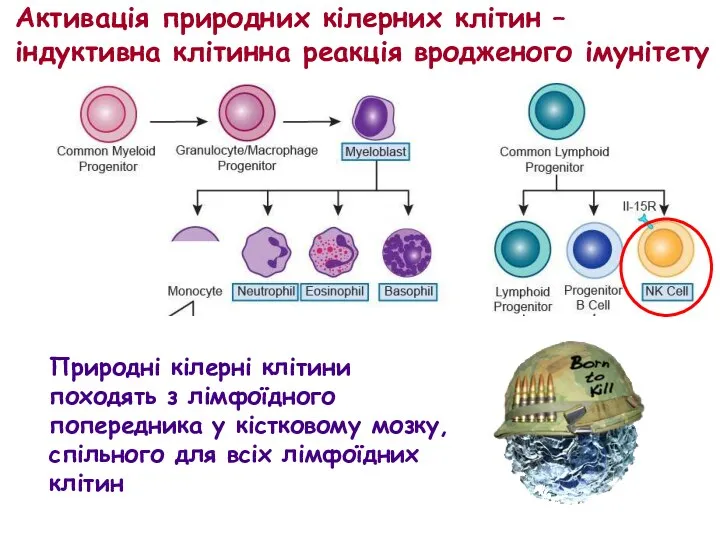
- 51. Природні кілерні клітини походять з лімфоїдного попередника у кістковому мозку, спільного для всіх лімфоїдних клітин Активація
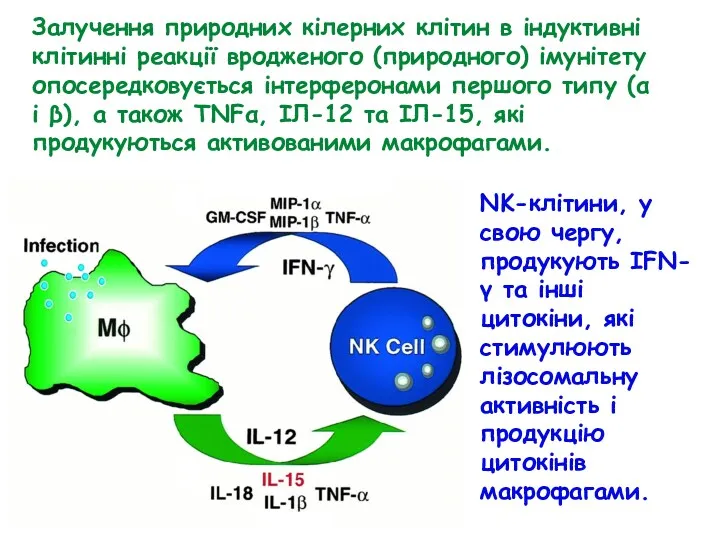
- 52. Залучення природних кілерних клітин в індуктивні клітинні реакції вродженого (природного) імунітету опосередковується інтерферонами першого типу (α
- 53. IFN-γ єдиний інтерферон ІІ типу. Основними продуцентами є NK-клітини, CD4+Th1 та CD8+цитотоксичні Т-лімфоцити. Володіє широким спектром
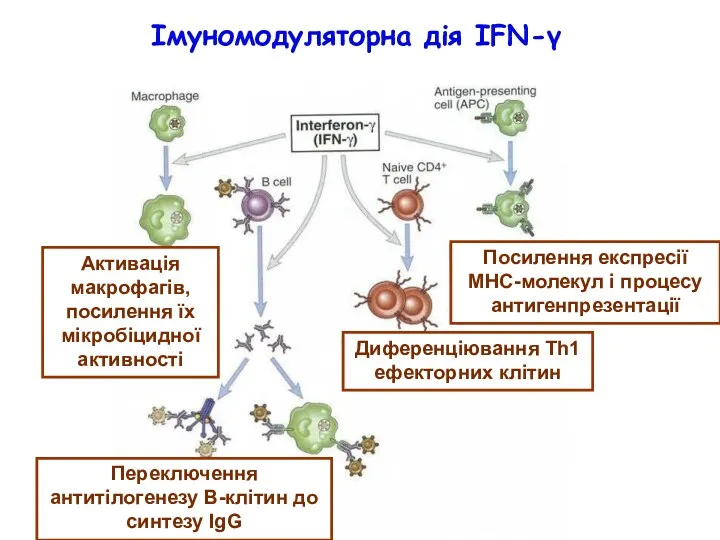
- 54. Імуномодуляторна дія IFN-γ Активація макрофагів, посилення їх мікробіцидної активності Переключення антитілогенезу В-клітин до синтезу IgG Диференціювання
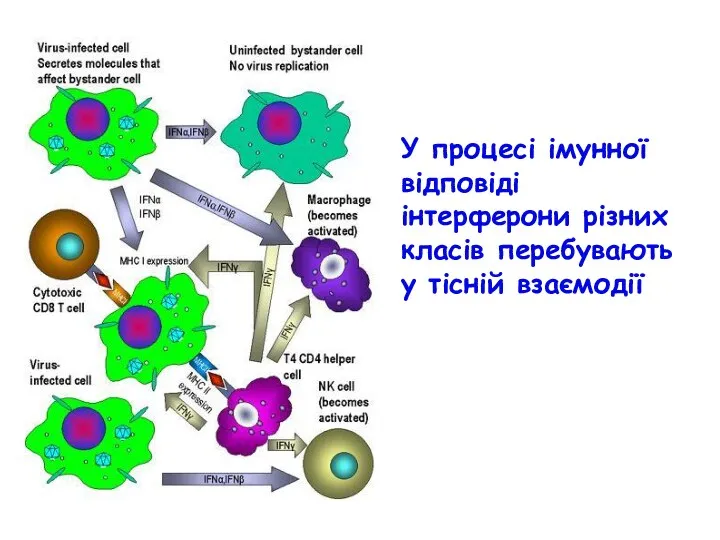
- 55. У процесі імунної відповіді інтерферони різних класів перебувають у тісній взаємодії
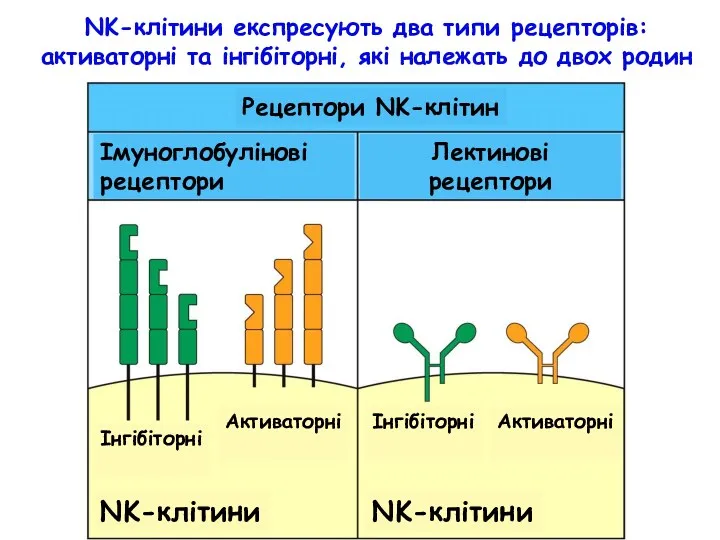
- 56. NK-клітини експресують два типи рецепторів: активаторні та інгібіторні, які належать до двох родин Рецептори NK-клітин Імуноглобулінові
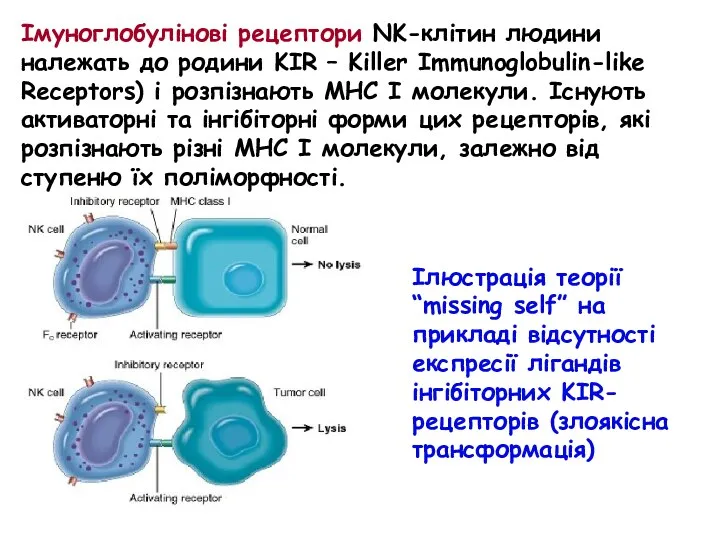
- 57. Існує дві теорії активації цитотоксичної активності NK-клітин: “missing self” та “induced self”. Згідно першої теорії, інгібіторні
- 58. Імуноглобулінові рецептори NK-клітин людини належать до родини KIR – Killer Immunoglobulin-like Receptors) і розпізнають МНС І
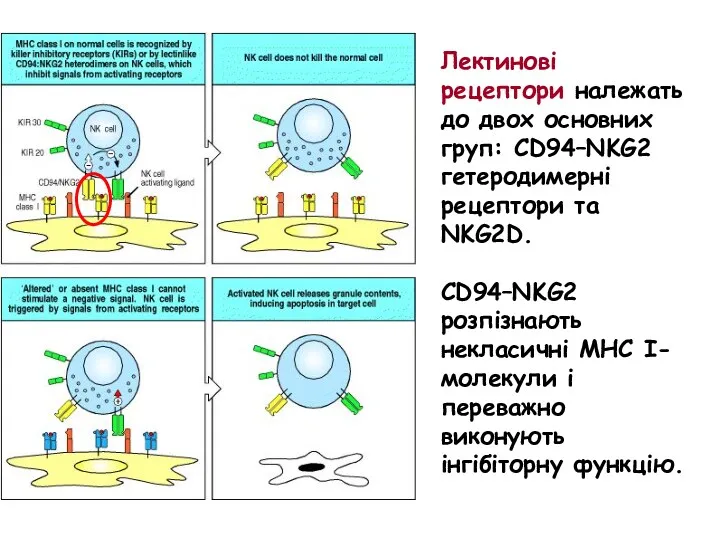
- 59. Лектинові рецептори належать до двох основних груп: CD94–NKG2 гетеродимерні рецептори та NKG2D. CD94–NKG2 розпізнають некласичні МНС
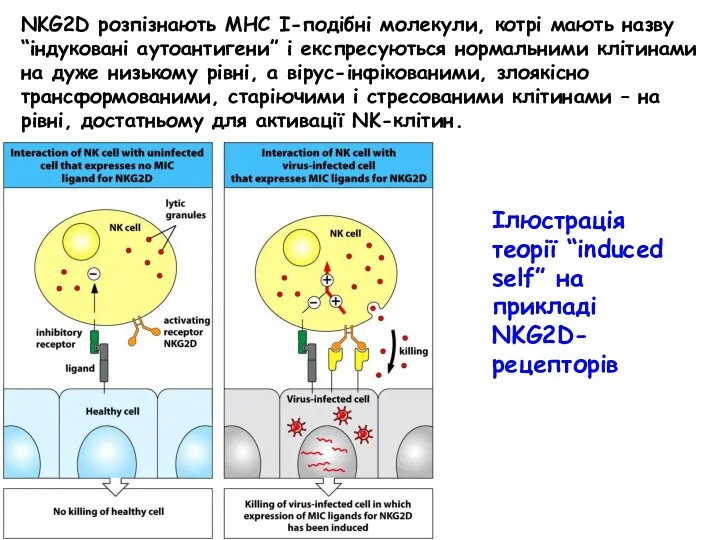
- 60. NKG2D розпізнають МНС І-подібні молекули, котрі мають назву “індуковані аутоантигени” і експресуються нормальними клітинами на дуже
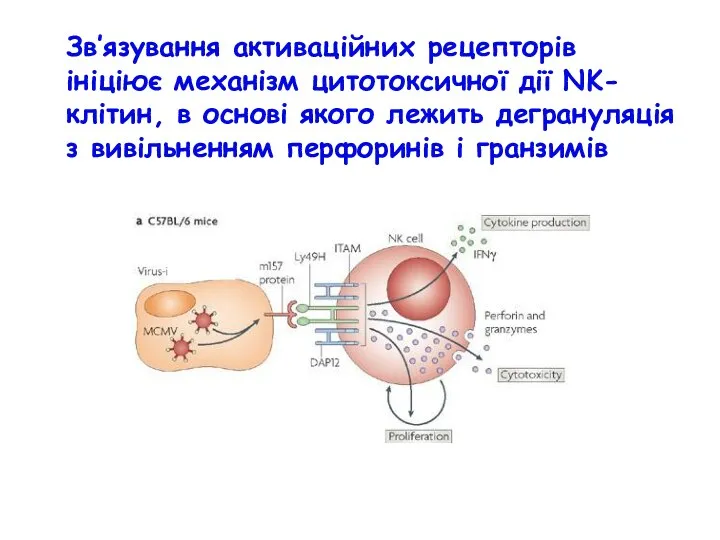
- 61. Зв’язування активаційних рецепторів ініціює механізм цитотоксичної дії NK-клітин, в основі якого лежить дегрануляція з вивільненням перфоринів
- 62. Тучні клітини (мастоцити) диференціюють з мієлоїдного попередника кісткового мозку. Локалізуються вздовж невеликих кровоносних судин. Активовані мастоцити
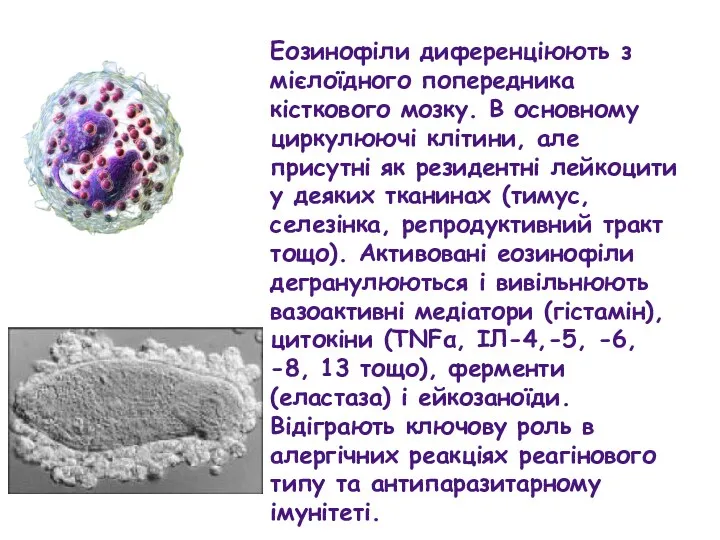
- 63. Еозинофіли диференціюють з мієлоїдного попередника кісткового мозку. В основному циркулюючі клітини, але присутні як резидентні лейкоцити
- 64. Базофіли диференціюють з мієлоїдного попередника кісткового мозку. В основному циркулюючі клітини. Активовані базофіли дегранулюються (екзоцитоз) і
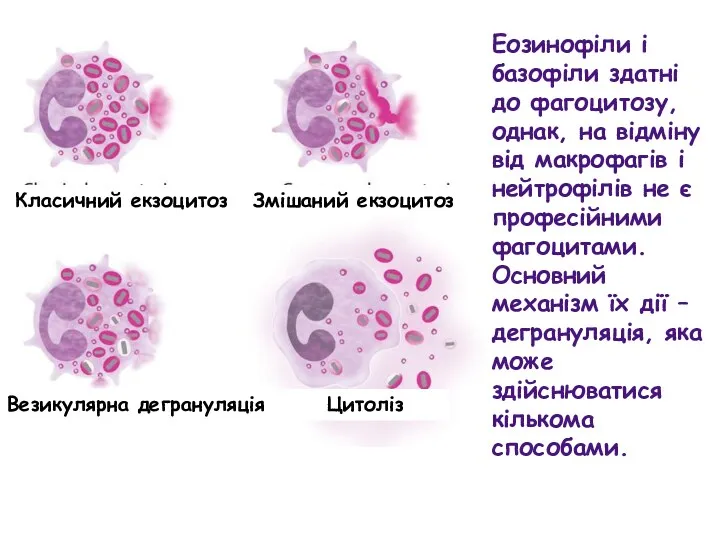
- 65. Еозинофіли і базофіли здатні до фагоцитозу, однак, на відміну від макрофагів і нейтрофілів не є професійними
- 67. Скачать презентацию














 ЖИТС және жүктілік
ЖИТС және жүктілік Амбулаторлы жағдайда жаңа туылған нәрестелерге емдік-профилактикалық шараларды ұйымдастыру
Амбулаторлы жағдайда жаңа туылған нәрестелерге емдік-профилактикалық шараларды ұйымдастыру Геморрагический синдром. Острый лейкоз
Геморрагический синдром. Острый лейкоз Энтеробактерии. Классификация
Энтеробактерии. Классификация Физиология выделения
Физиология выделения Клиническая анатомия лицевого нерва. Топическая диагностика периферических поражений лицевого нерва
Клиническая анатомия лицевого нерва. Топическая диагностика периферических поражений лицевого нерва Спинной мозг. Проводящие пути
Спинной мозг. Проводящие пути Как бросить курить. Тест на выраженность никотиновой зависимости. Фармакологические препараты, облегчающие отказ от курения
Как бросить курить. Тест на выраженность никотиновой зависимости. Фармакологические препараты, облегчающие отказ от курения Лихорадка, уход за лихорадящими пациентами.Температура тела и ее измерение
Лихорадка, уход за лихорадящими пациентами.Температура тела и ее измерение Иммунология и иммунитет
Иммунология и иммунитет Нарушения кровообращения
Нарушения кровообращения Возбудители туберкулеза, микобактериозов, лепры
Возбудители туберкулеза, микобактериозов, лепры Доброкачественные и злокачественные опухоли почек
Доброкачественные и злокачественные опухоли почек Принципы терапии острой почечной недостаточности. Патогенетические сдвиги, клиническая картина
Принципы терапии острой почечной недостаточности. Патогенетические сдвиги, клиническая картина Возбудители микозов
Возбудители микозов Хроническая надпочечниковая недостаточность
Хроническая надпочечниковая недостаточность Методы лучевой диагностики. (Лекция 1)
Методы лучевой диагностики. (Лекция 1) Первая медицинская помощь на занятиях физической культуры
Первая медицинская помощь на занятиях физической культуры Рак полового члена
Рак полового члена Основы трансплантологии
Основы трансплантологии Микробиологическая диагностика брюшного тифа, паратифов и сальмонеллёзных гастроэнтеритов
Микробиологическая диагностика брюшного тифа, паратифов и сальмонеллёзных гастроэнтеритов Дезинфекция. Методы дезинфекции
Дезинфекция. Методы дезинфекции Саркома Юинга
Саркома Юинга Жамбас – сан буынының туберкулезінің дифференциальды диагностикасы
Жамбас – сан буынының туберкулезінің дифференциальды диагностикасы Проводящая система сердца
Проводящая система сердца Влияние быстрой еды на организм человека
Влияние быстрой еды на организм человека Философия сестринского дела
Философия сестринского дела Акушерство для линейных бригад скорой помощи
Акушерство для линейных бригад скорой помощи