Содержание
- 2. Требования к исследованиям: Стандартизация Качество и скорость выполнения Полнота обследования Минимизация затрат Задачи лабораторной диагностики при
- 3. Задачи исследования эякулята Стандартное Оценка наличия и количества сперматозоидов Оценка их подвижности Оценка их морфологии Свойства
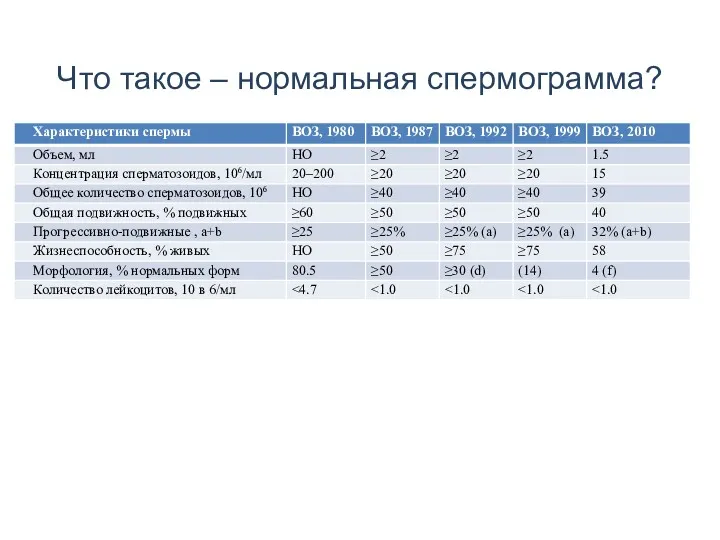
- 4. Что такое – нормальная спермограмма?
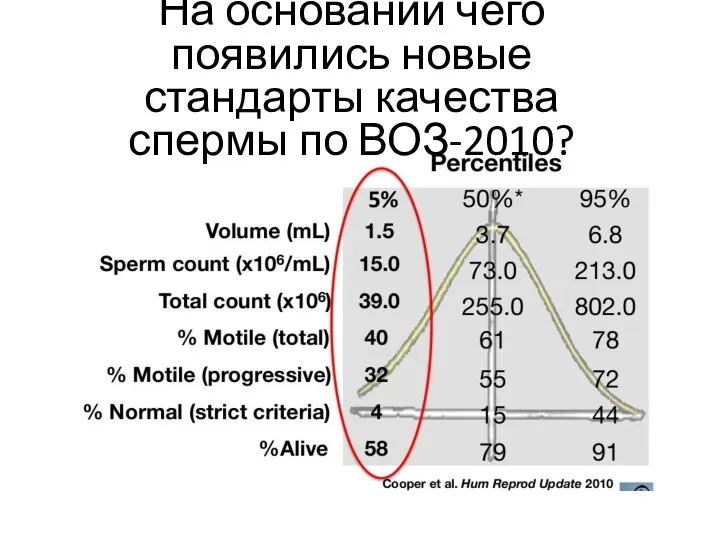
- 5. На основании чего появились новые стандарты качества спермы по ВОЗ-2010?
- 6. СТАНДАРТНОЕ ИССЛЕДОВАНИЕ
- 7. Исследование эякулята проводят дважды с интервалом не менее 7 дней и не более 3 недель. Если
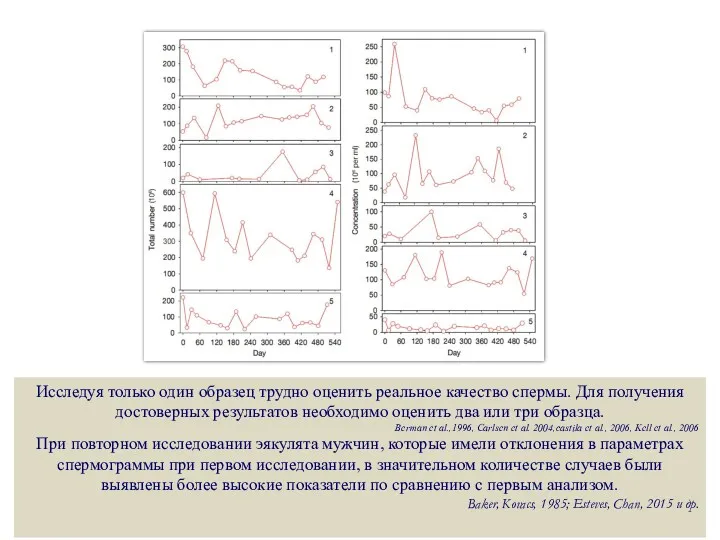
- 8. Исследуя только один образец трудно оценить реальное качество спермы. Для получения достоверных результатов необходимо оценить два
- 10. рН Если в образце с азооспермией рН Объем, снижение: Ретроградная эякуляция Обструкция семявыносящих путей Агенезия семенных
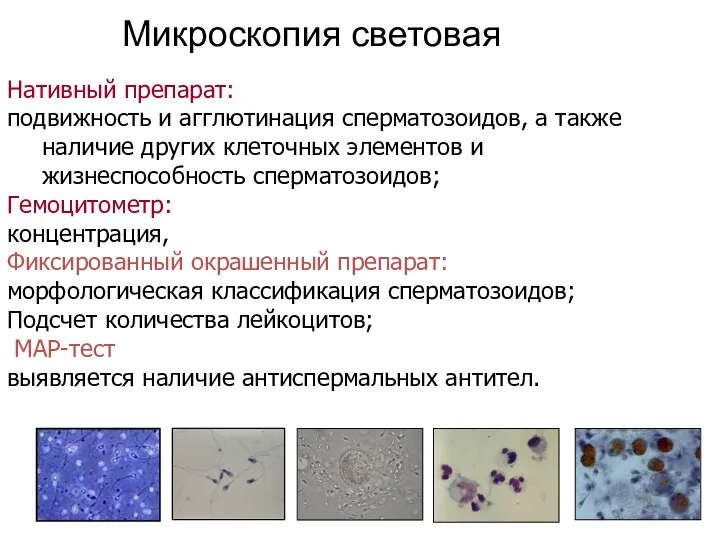
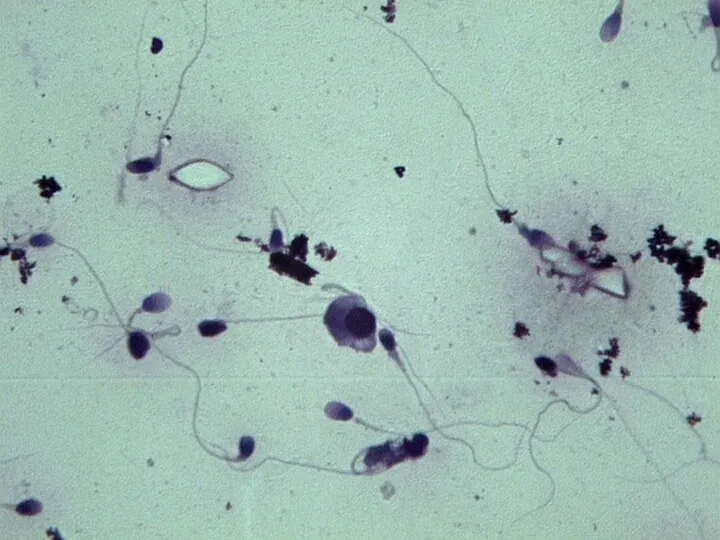
- 11. Микроскопия световая Нативный препарат: подвижность и агглютинация сперматозоидов, а также наличие других клеточных элементов и жизнеспособность
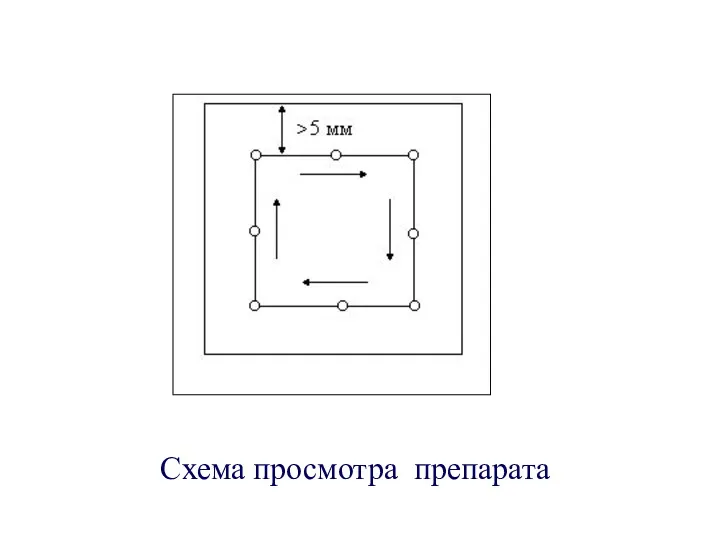
- 12. Для просмотра наносят 10 мкл эякулята на предметное стекло и накрывают предметным 22х22 Стабилизация препарата происходит
- 13. Схема просмотра препарата
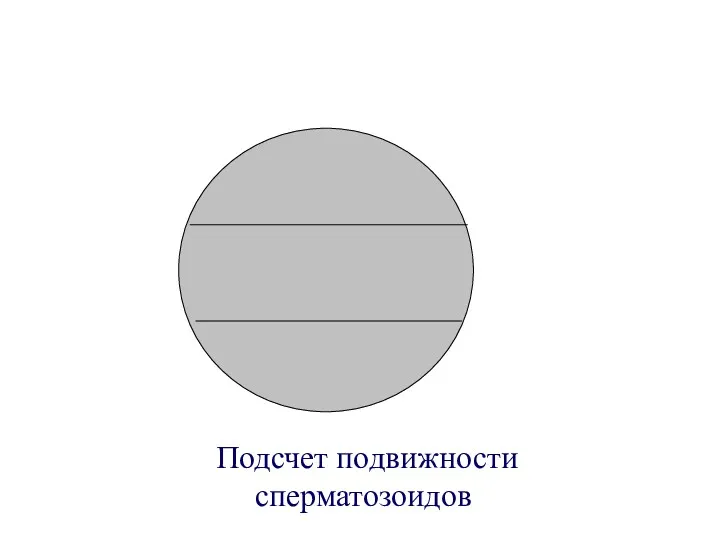
- 14. Подсчет подвижности сперматозоидов
- 15. Критерии подвижности сперматозоидов : поступательное движение (≥ 20-25 мкм/сек, что приблизительно соответствуют длине 5 головок или
- 16. Жизнеспособность Окраска эозином. Реактивы: Эозин Y( К или желтый водорастворимый) - раствор 5 г/л на физиологическом
- 17. Окраска эозином-нигрозином Реактивы: Эозин Y – 3% водный раствор, нигрозин – 10% раствор. - на предметное
- 18. Концентрацию сперматозоидов подсчитывают в гемоцитометре, сделав предварительно разведение эякулята Для разведения на 1 л физ. р-ра:
- 20. Х = (n x разведение х 250х1000)/к-во подсчитанных квадратов
- 21. Для подсчета сперматозоидов: Х = (n x разведение х 250х1000)/5 Для разведения в 20 раз n
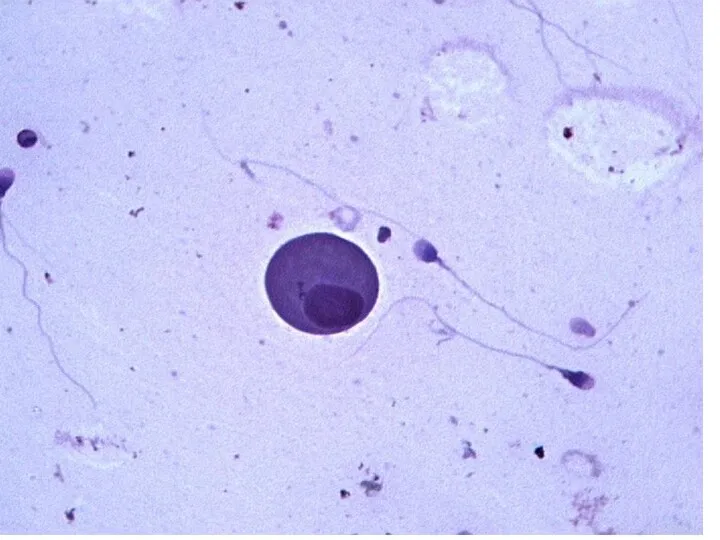
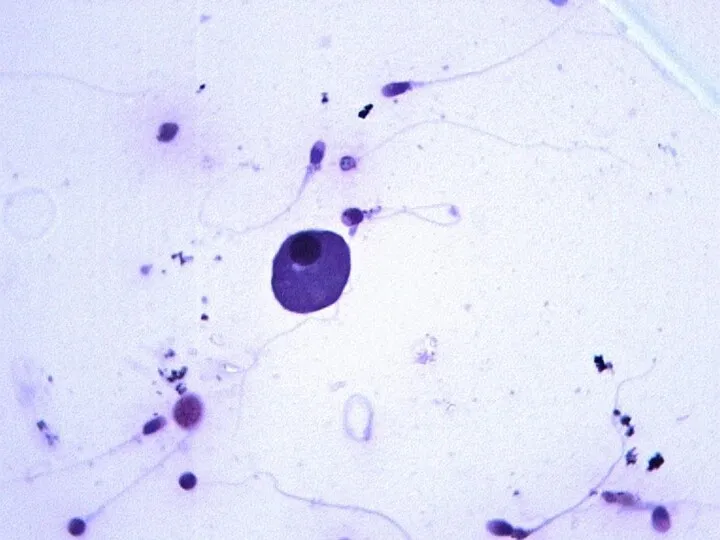
- 22. Клетки эякулята кроме сперматозоидов в совокупности обозначают, как «круглые клетки». Их количество не должно превышать 3∙106/мл
- 23. Для подсчета лейкоцитов Х = (n x разведение х 250х1000)/40 Для разведения в 20 раз n
- 24. Окраска по Папаниколау метод быстрого окрашивания «Diff-Quik» (США) Spermatic Stain (фирма Ferti Pro, Бельгия). по Романовскому-Гимза
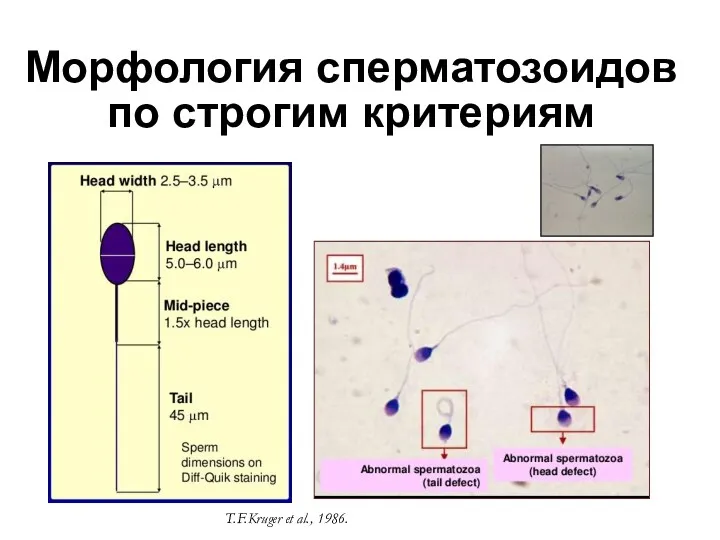
- 25. Морфология сперматозоидов по строгим критериям T.F.Kruger et al., 1986.
- 26. Индекс тератозооспермии (ИТЗ) или индекс множественных аномалий (ИМА) ИТЗ = число дефектов, деленное на число патологических
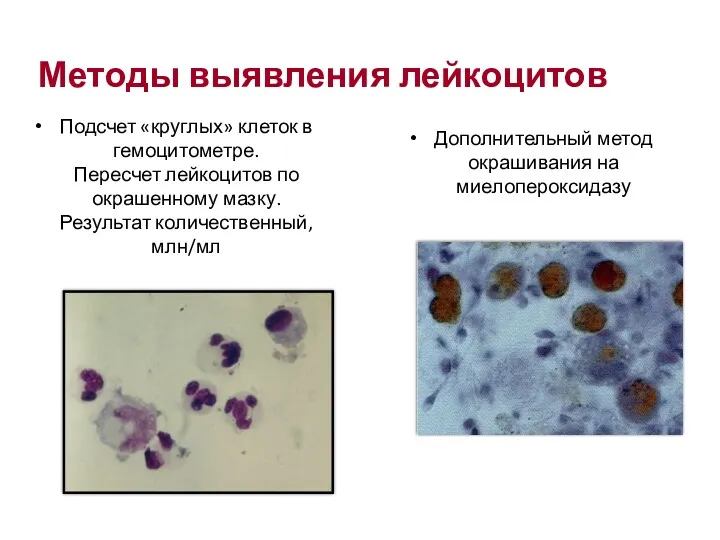
- 27. Подсчет «круглых» клеток в гемоцитометре. Пересчет лейкоцитов по окрашенному мазку. Результат количественный, млн/мл Дополнительный метод окрашивания
- 28. СПЕЦИАЛЬНЫЕ ИССЛЕДОВАНИЯ Все еще четко не определены характеристики эякулята присущие исключительно бесплодным пациентам и не характерные
- 29. нарушают функциональную целостность мембраны сперматозоидов препятствуют продвижению сперматозоидов и их пенетрации через цервикальную слизь блокируют рецепторные
- 30. Смешанная реакция агглютинации/ SpermMar IgG, IgА test Прямой тест : на подвижных сперматозоидах Непрямой тест: в
- 31. Биохимические исследования эякулята Фруктоза (семенные пузырьки) обеспечивает энергетический баланс, поддержание обмена веществ и подвижности сперматозоидов. Существенное
- 32. Биохимические исследования эякулята, референтные пределы Фруктоза ( более 13 мкМоль на эякулят) Цинк (более 2,4 мкМоль
- 33. ИССЛЕДОВАТЕЛЬСКИЕ ТЕСТЫ
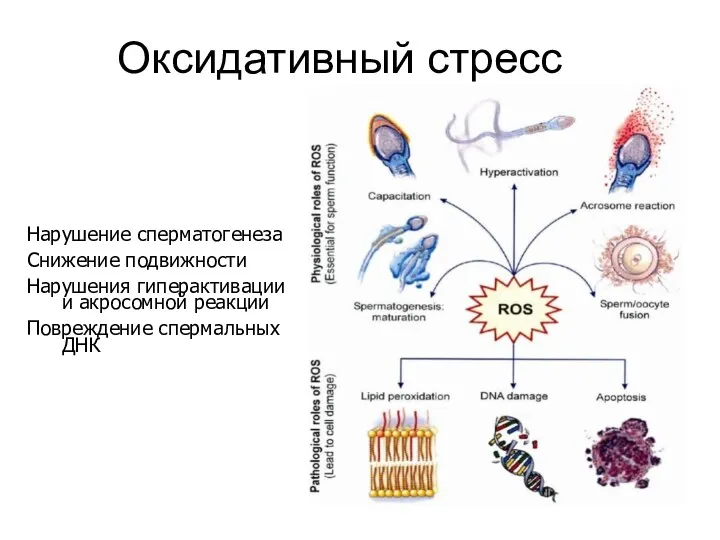
- 34. Оксидативный стресс Нарушение сперматогенеза Снижение подвижности Нарушения гиперактивации и акросомной реакции Повреждение спермальных ДНК
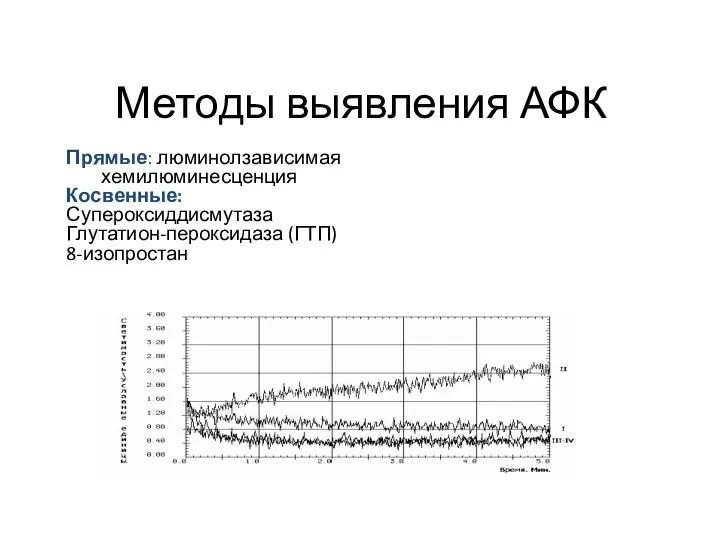
- 35. Прямые: люминолзависимая хемилюминесценция Косвенные: Супероксиддисмутаза Глутатион-пероксидаза (ГТП) 8-изопростан Методы выявления АФК
- 36. Акросомная реакция Спонтанная - сперматозоиды теряют акросому до встречи с яйцеклеткой индуцированная – выброс ферментов при
- 37. Акросомная реакция Своевременная акросомная реакция сперматозоидов – условие естественной фертилизации яйцеклетки. Преждевременная - избыточность спонтанной реакции;
- 38. Методы изучения акросомной реакции Флюоресцентная микроскопия Проточная цитофлюорометрия Электронная микроскопия (выявление структурных дефектов акросомальной зоны) Определение
- 39. Бесплодие неясного генеза Остановки развития плода Неудачные попытки ЭКО Криоконсервация спермы Инфекции репродуктивного тракта Длительное применение
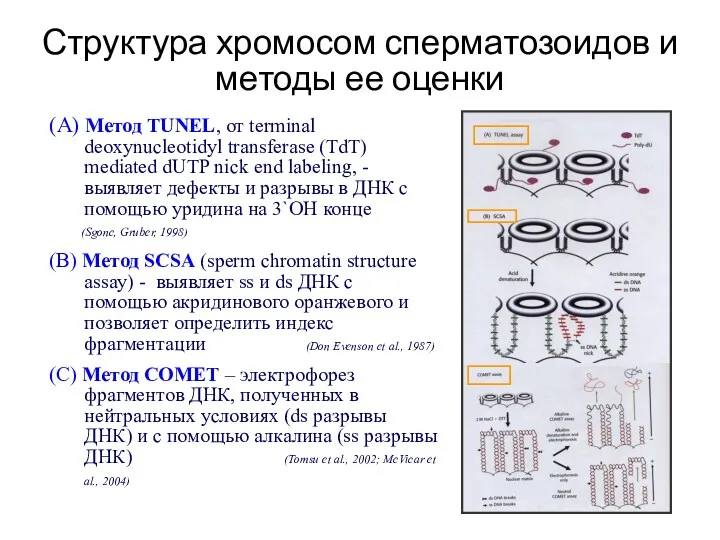
- 40. Структура хромосом сперматозоидов и методы ее оценки (А) Метод TUNEL, от terminal deoxynucleotidyl transferase (TdT) mediated
- 41. Диcперсия хроматина сперматозоидов (SCD) в агарозном геле (Journal of Andrology, Vol. 24, No. 1, January/February 2003):
- 42. ДРУГИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
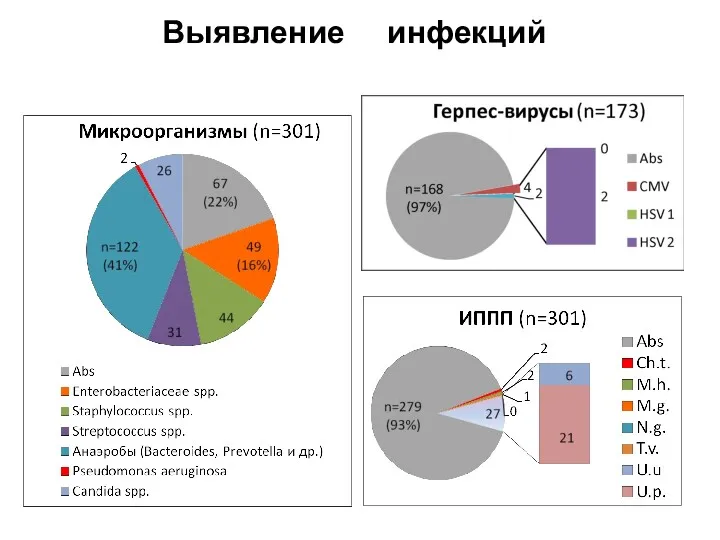
- 43. Выявление инфекций
- 44. Все еще четко не определены характеристики эякулята присущие исключительно бесплодным пациентам и не характерные для фертильных,
- 64. Скачать презентацию






























 Профессия врача. Одна из самых нужных и важных профессий
Профессия врача. Одна из самых нужных и важных профессий Орталық жүйке жүйесіне әсер ететін дәрілер
Орталық жүйке жүйесіне әсер ететін дәрілер Диета – здоровье или мода?
Диета – здоровье или мода? Кашлюк. Етіологія. Клініка. Лікування
Кашлюк. Етіологія. Клініка. Лікування Профилактика ВИЧ-инфекции
Профилактика ВИЧ-инфекции Средства, влияющие на систему крови
Средства, влияющие на систему крови СПИД. Пути передачи вируса
СПИД. Пути передачи вируса Токсокароз. Жизненный цикл токсокар
Токсокароз. Жизненный цикл токсокар Высокий и очень высокий сердечно-сосудистый риск. Индивидуальное профилактическое консультирование
Высокий и очень высокий сердечно-сосудистый риск. Индивидуальное профилактическое консультирование Основні методи дослідження в психіатрії
Основні методи дослідження в психіатрії Мочекаменная болезнь
Мочекаменная болезнь Гіпертонічна хвороба
Гіпертонічна хвороба Принципы и современные методы лечения переломов. Несросшиеся переломы, ложные суставы
Принципы и современные методы лечения переломов. Несросшиеся переломы, ложные суставы Дыхательная гимнастика для школьников по методике Стрельниковой А.Н
Дыхательная гимнастика для школьников по методике Стрельниковой А.Н Гомеопатия и ноотропные препараты от головокружения
Гомеопатия и ноотропные препараты от головокружения Физиология мозжечка и переднего мозга, их участие в регуляции мышечного тонуса и движения
Физиология мозжечка и переднего мозга, их участие в регуляции мышечного тонуса и движения Основні переваги грудного вигодовування малят
Основні переваги грудного вигодовування малят Паразитарлы аурулар
Паразитарлы аурулар Некроз. Апоптоз
Некроз. Апоптоз Догляд за хворими з хірургічними захворюваннями прямої кишки
Догляд за хворими з хірургічними захворюваннями прямої кишки Клинико-морфологическая классификация фоновых заболеваний шейки матки
Клинико-морфологическая классификация фоновых заболеваний шейки матки Тематикалық аурулардан анамнез жинау ерекшеліктері
Тематикалық аурулардан анамнез жинау ерекшеліктері Здоровый образ жизни. Личная гигиена
Здоровый образ жизни. Личная гигиена Disorders of metabolism. (Subject 9)
Disorders of metabolism. (Subject 9) Патогенные и условно патогенные микроорганизмы
Патогенные и условно патогенные микроорганизмы Лечебная физкультура при гинекологических заболеваниях
Лечебная физкультура при гинекологических заболеваниях Первичные иммунодефициты. Этиология, патогенез, клинические проявления. Принципы диагностики. (Лекция 8)
Первичные иммунодефициты. Этиология, патогенез, клинические проявления. Принципы диагностики. (Лекция 8) Кардиология. ИБС. Классификация. Стенокардия
Кардиология. ИБС. Классификация. Стенокардия