Содержание
- 2. Неоплазия (греч.) – ‘новый рост’, новообразование Oncos - опухоль «Опухоль – патологическая и избыточнаямасса ткани, рост
- 3. Атипизм опухоли – новые свойства опухоли, которые отличают ее от нормальной ткани -Морфологический атипизм -Биохимический атипизм
- 4. Морфологический атипизм Тканевый атипизм характеризуется нарушением формы и величины морфологических структур, нарушении соотношений стромы и паренхимы,
- 6. Биохимический атипизм Биохимический атипизм выражается изменением метаболизма опухолевых клеток. В клетках преобладает гликолиз Отрицательный эффект Пастера
- 7. Иммунологический атипизм Антигенное упрощение – утрата опухолевыми клетками антигенов, имеющихся в нормальных клетках. Появление новых антигенов.
- 8. Атипизм регуляции роста и дифференцировки клеток Автономность роста Нечувствительность к сигналам, ингибирующим рост Уклонение от апоптоза
- 9. Степени дифференцировки клеток опухоли При электронно-микроскопическом исследовании выявляется не только ультраструктурный атипизм, но и специфическая дифференцировка
- 10. Виды роста В зависимости от степени дифференцировки опухоли различают три вида ее роста: экспансивный аппозиционный инфильтрирующий
- 11. Экспансивный рост При экспансивном росте опухоль растет «сама из себя», отодвигая окружающие ткани. Паренхиматозные элементы окружающей
- 12. Аппозиционный рост Аппозиционный рост опухоли происходит за счет неопластической трансформации нормальных клеток в опухолевые, что наблюдается
- 13. Инфильтрирующий рост При инфильтрирующем (инвазивном) росте клетки опухоли врастают в окружающие ткани и разрушают их (деструирующий
- 14. В зависимости от числа очагов возникновения опухоли говорят об уницентрическом (один очаг) и мультицентрическом (множественные очаги)
- 15. Доброкачественные и злокачественные опухоли
- 16. Метастазирование За счет инвазии злокачественные опухоли проникают в кровеносные и лимфатические сосуды, полости тела и распространяются
- 17. Пути метастазирования Имплантационный путь - по поверхности предсуществующих полостей; отмечается при врастании опухоли в естественную полость.
- 18. Пути метастазирования Лимфогенный путь более типичен для карцином но иногда и метастазирование сарком идет поэтому пути.
- 19. Пути метастазирования Гематогенный путь наиболее характерен для сарком, но иногда этим путем идет распространение карцином. -
- 20. TNM Международная классификация стадий злокачественных новообразований. Была разработана Пьером Денуа (Pierre Denoix) (Франция) в 1943-1952 гг.
- 21. Цели TNM планирование лечения; учёт прогностических факторов; оценка результатов лечения; обмен информацией между разными медицинскими центрами;
- 22. Общие принципы TNM Деление опухолей на группы, по так называемым «стадиям» процесса, основано на том, что
- 23. Структура TNM Система TNM, принятая для описания анатомического распространения поражения, основана на трех компонентах: Т —
- 24. Общие правила TNM Правило 1: Во всех случаях должно быть гистологическое подтверждение диагноза, если его нет,
- 25. Общие правила TNM Правило 2: При каждой локализации описываются две классификации: Клиническая классификацияTNM(или cTNM), применяется до
- 26. Общие правила TNM Правило 3: После определения Т, N, М и (или) рТ, pN и рМ
- 27. Общие правила TNM Правило 4: Если имеется сомнение в правильности определения категорий Т, N или М,
- 28. Общие правила TNM Правило 5: В случае множественных синхронных злокачественных опухолей в одном органе классификация строится
- 29. Общие правила TNM Правило 6: Определение TNM категорий или группировка по стадиям могут использоваться для клинических
- 30. TNM Клиническая классификация Т—Первичная опухоль Т—Первичная опухоль ТХ - Оценить размеры и местное распространение первичной опухоли
- 31. TNM Клиническая классификация N —Регионарные лимфатические узлы NX - Недостаточно данных для оценки регионарных лимфатических узлов
- 32. TNM Клиническая классификация М—Отдаленные метастазы MX - Недостаточно данных для определения отдаленных метастазов МО - Нет
- 33. pTNM Патологоанатомическая классификация рТ—Первичная опухоль рТХ - Первичная опухоль не может быть оценена гистологически рТО -
- 34. pTNM Патологоанатомическая классификация pN—Регионарные лимфатические узлы pNX - Регионарные лимфатические узлы не могут быть оценены pNO
- 35. pTNM Патологоанатомическая классификация Сторожевой лимфатический узел Сторожевой лимфатический узел (СЛУ) - первый лимфатический узел на пути
- 36. pTNM Патологоанатомическая классификация Изолированные опухолевые клетки В понятие изолированные опухолевые клетки (ИОК)входят отдельные опухолевые клетки или
- 37. pTNM Патологоанатомическая классификация Гистопатологическая дифференцировка В большинстве случаев дополнительная информация, касающаяся первичной опухоли, может быть отмечена
- 38. pTNM Патологоанатомическая классификация Необязательные символы L - Инвазия лимфатических сосудов LX L0 L1 V—Инвазия вен VX
- 39. С-фактор, или «уровень надежности», отражает достоверность классификации с учетом использованных диагностических методов.
- 40. Эпидемиология Зависимость от факторов окружающей среды В одном из крупных исследований установлено, что риск развития злокачественных
- 41. Эпидемиология Зависимость от расы и национальности Расовая принадлежность не относится к прямым биологическим факторам, однако при
- 42. Эпидемиология Возраст Частота злокачественных опухолей обычно увеличивается с возрастом. Большинство летальных исходовот карцином происходит в возрасте
- 43. Эпидемилогия Наследственность Опухоли развиваются в определенных органах и тканях, хотя могут возникать в нескольких местах. Предрасположенность
- 44. Наследственность
- 45. Статистика в мире Рак является ведущей причиной смертности во всем мире, в 2018 году ожидается 9,6
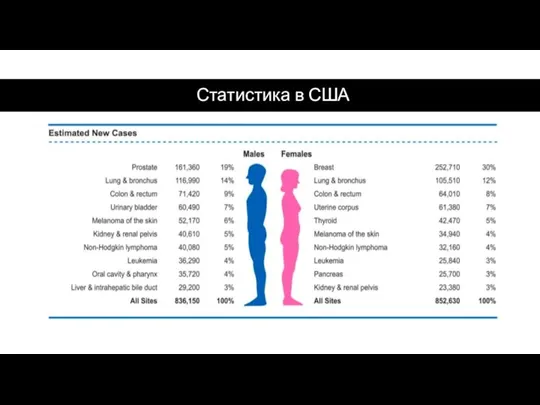
- 46. Статистика в США
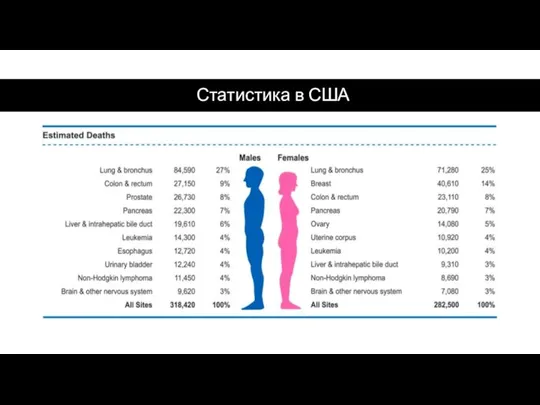
- 47. Статистика в США
- 48. Статистика в России В 2017г.в Российской Федерации впервые в жизни выявлено 617 177 случаев злокачественных новообразований(в
- 51. Статистика в России В2017г. от всех причин в России умерли1 826 125человек(2016г.-1 891 015). "Грубый"показатель смертности
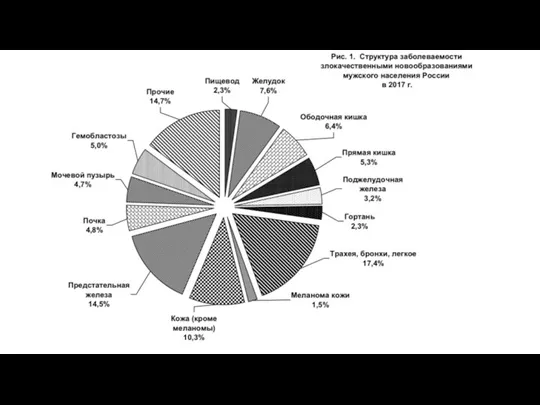
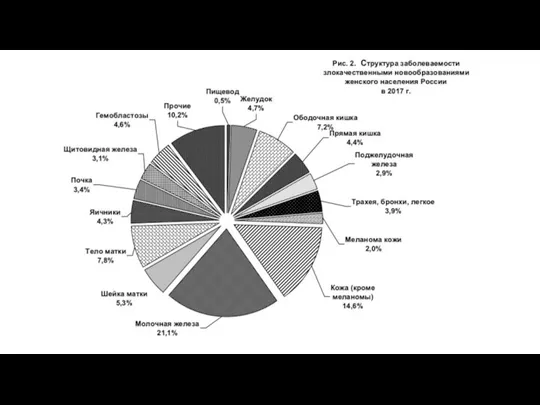
- 52. Статистика в России В структуре смертности населения России от злокачественных новообразований наибольший удельный вес составляют опухоли
- 53. Онкомаркеры Наиболее распространенные: АФП — альфа-фетопротеин ПСА — простатический специфический антиген CA-125 РЭА — раковоэмбриональный антиген
- 54. Комбинации маркеров Colorectal: M2-PK; if M2-PK is not available, can test CEA, CA 19-9, CA 125
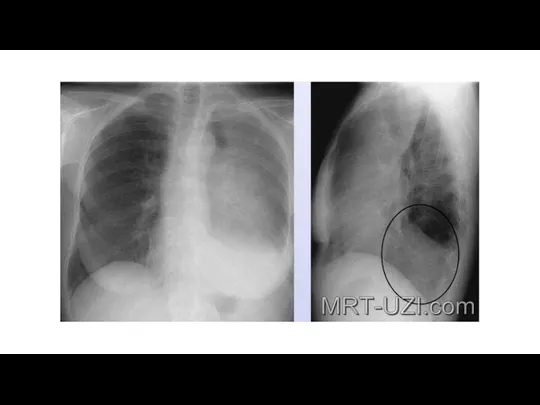
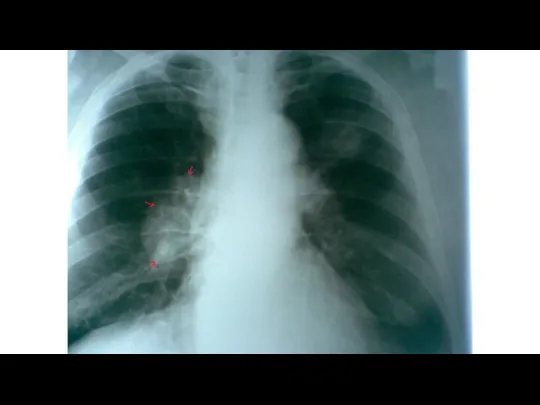
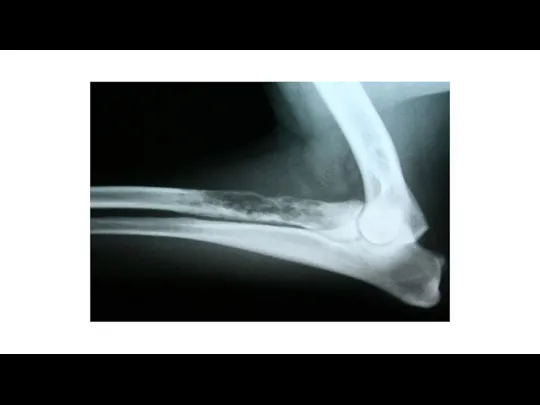
- 55. Лучевая диагностика
- 61. Скачать презентацию

















































 Дезинфекция
Дезинфекция Лапароскопические методы лечения заболеваний пищевода и желчного пузыря
Лапароскопические методы лечения заболеваний пищевода и желчного пузыря Применение крестора (резувастатина) при лечении больных с мультифокальным атеросклерозом
Применение крестора (резувастатина) при лечении больных с мультифокальным атеросклерозом Болезни женских половых органов, молочной железы и заболевания, связанные с беременностью
Болезни женских половых органов, молочной железы и заболевания, связанные с беременностью Наследственные и врожденные заболевания и заболевания передаваемые половым путем. 8 класс
Наследственные и врожденные заболевания и заболевания передаваемые половым путем. 8 класс Базовые знания о меридианах
Базовые знания о меридианах Никотиновая зависимость и как от нее избавится
Никотиновая зависимость и как от нее избавится Мышцы областей тела. Мышцы спины поверхностный слой
Мышцы областей тела. Мышцы спины поверхностный слой Природне вигодовування дітей раннього віку
Природне вигодовування дітей раннього віку Issues Affecting ART Success: Adherence, ARV Toxicity, Drug Interactions
Issues Affecting ART Success: Adherence, ARV Toxicity, Drug Interactions Синдром Марфана
Синдром Марфана Медико-санитарное обеспечение населения при ликвидации последствий ЧС химической природы
Медико-санитарное обеспечение населения при ликвидации последствий ЧС химической природы Интервенционная кардиология .Виды стендов
Интервенционная кардиология .Виды стендов Металлические яды, изоляция минерализацией. Применение металлов и их соединений в клинической фармации
Металлические яды, изоляция минерализацией. Применение металлов и их соединений в клинической фармации Оказание первой помощи
Оказание первой помощи Эндогенные психические заболевания
Эндогенные психические заболевания Дифференциальная диагностика и лечение одышки
Дифференциальная диагностика и лечение одышки ХСН: причины, классификация, консервативное лечение
ХСН: причины, классификация, консервативное лечение Ведение медицинской документации
Ведение медицинской документации Предоперационный период. Хирургическая операция. Послеоперационный период
Предоперационный период. Хирургическая операция. Послеоперационный период Проведение врачебных назначений. Десмургия
Проведение врачебных назначений. Десмургия Естественное вскармливание ребенка первого года жизни
Естественное вскармливание ребенка первого года жизни СРС: Транспортировка больных и пострадавших в машине скорой помощи
СРС: Транспортировка больных и пострадавших в машине скорой помощи Депрессивные расстройства в неврологии
Депрессивные расстройства в неврологии Эбола, Марбург қызбаларының және жапон энцефалитінің эпидемиологиялық сипаттамасы. Алдын алу және эпидемияға қарсы шаралардың
Эбола, Марбург қызбаларының және жапон энцефалитінің эпидемиологиялық сипаттамасы. Алдын алу және эпидемияға қарсы шаралардың Постизометрическая релаксация мышц
Постизометрическая релаксация мышц Особенности ухода за детьми грудного возраста
Особенности ухода за детьми грудного возраста Патопсихология
Патопсихология