Основные стандарты клинических исследований. Принципы надлежащей клинической практика (GCP). Словарь основных терминов презентация
Содержание
- 2. План: Стандарты клинических испытаний. История, структура и основные положения качественной клинической практики (ICH-GCP) Государственный стандарт РК
- 3. Стандарты клинических испытаний При проведении клинических испытаний исследователи всего мира руководствуются основными правилами GCP (Good Clinical
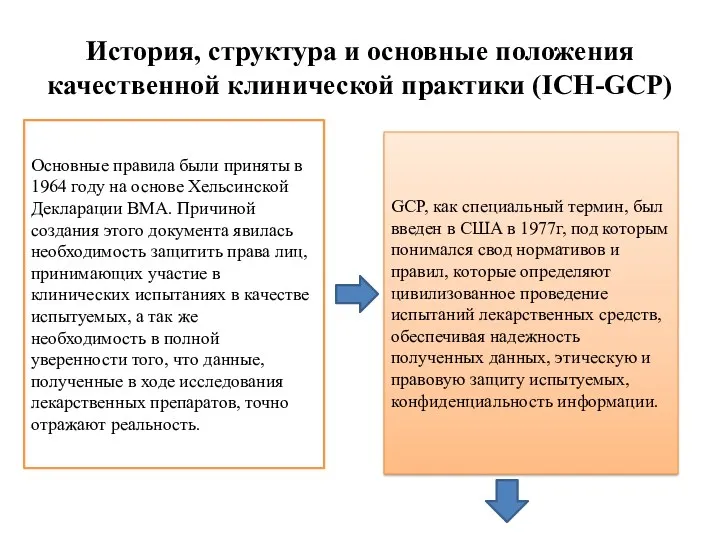
- 4. История, структура и основные положения качественной клинической практики (ICH-GCP) GCP, как специальный термин, был введен в
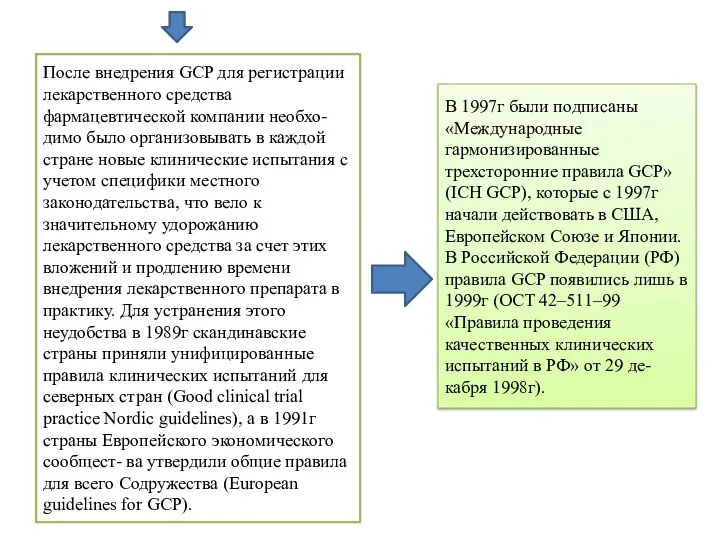
- 5. После внедрения GCP для регистрации лекарственного средства фармацевтической компании необхо- димо было организовывать в каждой стране
- 6. Государственный стандарт РК «Надлежащая клиническая практика» Стандарт надлежащей клинической практики (GCP) утвержден приложением 2 к приказу
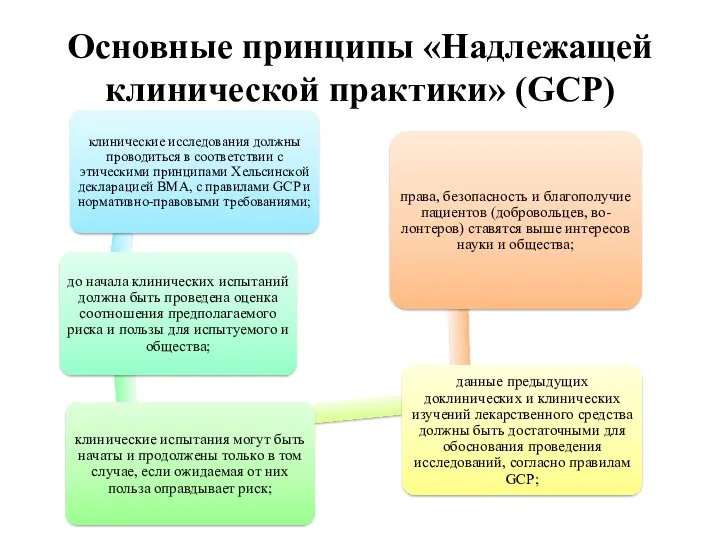
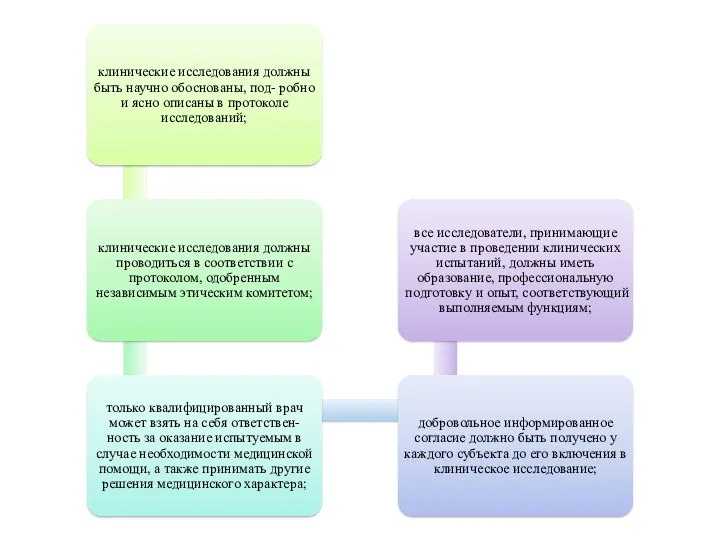
- 7. Основные принципы «Надлежащей клинической практики» (GCP)
- 10. Этические принципы проведения медицинских исследований с участием людей в качестве субъектов. Этические и научные стандарты проведения
- 11. Хельсинская декларация Всемирной медицинской ассоциации. Одним из первых и весомых документов этического плана стала Хельсинская Декларация
- 12. Независимый этический комитет Все принципы, одобренные в международной практике, предусматривают необходимость проведения этической и научной оценки
- 13. Комитеты по этике несут ответственность за своевременное проведение этической оценки планируемых научных исследований еще до начала
- 14. Информированное согласие Для подтверждения своего согласия на участие в исследовании участник (субъект) исследования подписывает документ –
- 15. Участники клинического исследования: спонсор, исследователь, монитор, пациент. – – В Национальном стандарте РК дано толкование данных
- 17. Скачать презентацию









 Фармакогнозия как наука и учебная дисциплина
Фармакогнозия как наука и учебная дисциплина Өкпенің милиарлы, диссеминирленген туберкулезінің клиникасы,диагностикасы, дифференциялді диагностикасы
Өкпенің милиарлы, диссеминирленген туберкулезінің клиникасы,диагностикасы, дифференциялді диагностикасы Ишемическая болезнь сердца (ИБС)
Ишемическая болезнь сердца (ИБС) Основы ЭКГ диагностики
Основы ЭКГ диагностики Местная анестезия. Виды и методы проведения. Принципы сердечно-легочной реанимации
Местная анестезия. Виды и методы проведения. Принципы сердечно-легочной реанимации Врач – одна из самых уважаемых и почетных профессий
Врач – одна из самых уважаемых и почетных профессий Жұлынның қантамырлық аурулары
Жұлынның қантамырлық аурулары Пути введения лекарственных средств
Пути введения лекарственных средств Акушерский травматизм
Акушерский травматизм Терапевтическое общение с пациентом
Терапевтическое общение с пациентом В, С, Д вирустық гепатиттері кезіндегі шаралардың стандарттары және алгоритмдері
В, С, Д вирустық гепатиттері кезіндегі шаралардың стандарттары және алгоритмдері Терминальные состояния. Смерть и оживление. Сердечно-легочная реанимация
Терминальные состояния. Смерть и оживление. Сердечно-легочная реанимация Сосудистый шов
Сосудистый шов Ведение нормальных родов
Ведение нормальных родов Трихинеллез. Эпизоотологические данные
Трихинеллез. Эпизоотологические данные Потребности человека в здоровье и болезни
Потребности человека в здоровье и болезни Здоровое питание – активное долголетие
Здоровое питание – активное долголетие Рентгендиагностика диспластического тазобедренного сустава
Рентгендиагностика диспластического тазобедренного сустава Денсаулық сақтау жүйесіндегі. Аккредитация
Денсаулық сақтау жүйесіндегі. Аккредитация Communication 25
Communication 25 Современные способы фиксации несъёмных ортопедических конструкций
Современные способы фиксации несъёмных ортопедических конструкций Введение в психогенетику
Введение в психогенетику Первая медицинская помощь при отравлении АХОВ
Первая медицинская помощь при отравлении АХОВ Деконтаминация в ЛПО. Подбор дезинфицирующих средств. Практикум 7
Деконтаминация в ЛПО. Подбор дезинфицирующих средств. Практикум 7 Коллективное медицинское страхование работников АК Узбектелеком
Коллективное медицинское страхование работников АК Узбектелеком Дәрігерлік-еңбектік сараптама
Дәрігерлік-еңбектік сараптама Невротические расстройства (неврозы)
Невротические расстройства (неврозы) Требования к безопасности соковой продукции, компонентам и пищевым добавкам, используемым при ее изготовлении
Требования к безопасности соковой продукции, компонентам и пищевым добавкам, используемым при ее изготовлении