Содержание
- 2. Химиотерапия – специфическое лечение инфекционных и паразитарных болезней при помощи химических веществ. Химиотерапевтический индекс = минимальная
- 3. Уникальность антибиотика Мишень-рецептор находится не в тканях человека, а в клетке микроорганизма. Активность антибиотиков не является
- 4. Современный взгляд на основные понятия избирательность действия антибиотика; спектр активности антибиотика; клиническая эффективность антибиотика; происхождение антибиотиков:
- 5. Классификация антибиотиков по химическому строению β-Лактамы (пенициллины, цефалоспорины). Аминогликозиды (стрептомицин, гентамицин). Тетрациклины (тетрациклин, доксициклин). Макролиды (эритромицин,
- 6. Антибиотики действуют на микроорганизм в фазе активного роста и размножения антибиотики менее эффективны при хронических, чем
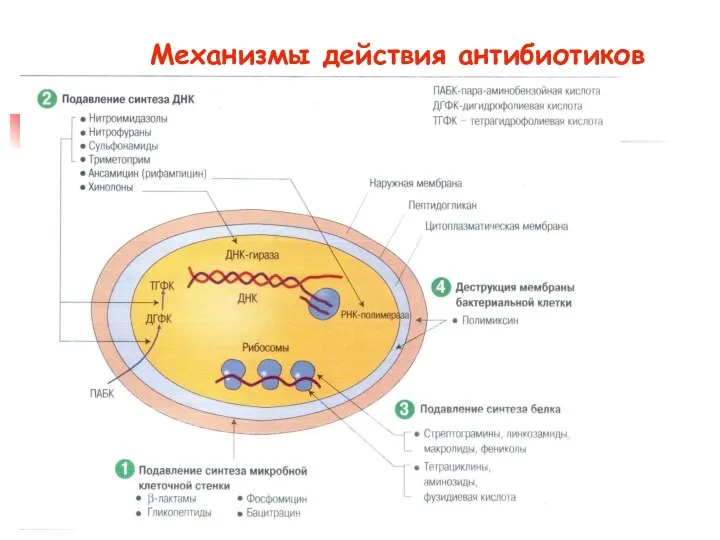
- 7. Механизмы действия антибиотиков нарушение синтеза клеточной стенки (пенициллины, цефалоспорины, бацитрацин, ванкомицин, тейкопланин, циклосерин); нарушение синтеза белка
- 8. Механизмы действия антибиотиков
- 9. Механизмы действия антибиотиков нарушение функции мембран (полимиксины, грамицидины, нистатин, леворин, амфотерицин В, трихомицин, кандицидины, аскозин, альбомицин,
- 10. Механизмы действия антибиотиков: подавление синтеза пуринов и пиримидинов (азасерин, декоинин, саркомицин и др.); угнетение ДНК-гиразы (gyrA)
- 11. Механизмы действия антибиотиков: угнетение дыхания (антимицины, олигомицины, патулин, пиоцианин, усниновая кислота и др.); угнетение окислительного фосфорилирования
- 12. Общие принципы реализации антимикробного эффекта: антибиотик должен связаться с бактериями и пройти через их оболочку; антибиотик
- 13. Резистентность бактерий к антибиотикам В медицинском смысле резистентными следует считать бактерии, если они не обезвреживаются такими
- 14. Устойчивость бактерий к антибиотикам
- 15. Гены резистентности могут передаваться в процессе: конъюгации (плазмидами, транспозоны); трансдукции (бактериофаги, которые извлекают ген из одной
- 16. Механизмы резистентности Нарушение проницаемости клеточных оболочек для антибиотика и подавление его транспорта к внутриклеточным мишеням. Причина
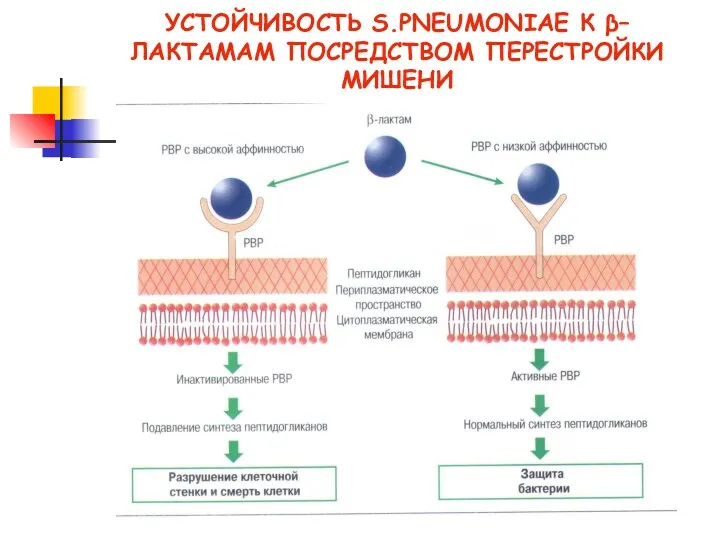
- 17. Механизмы резистентности Модификация мишеней β-лактамы − ПСБ (стафилококки − ПСБ2а → устойчивость к метициллину или оксациллину).
- 18. УСТОЙЧИВОСТЬ S.PNEUMONIAE К β–ЛАКТАМАМ ПОСРЕДСТВОМ ПЕРЕСТРОЙКИ МИШЕНИ
- 19. Механизмы резистентности Инактивация антибиотика β-лактамазы → гидролиз β-лактамного кольца: β-лактамазы расширенного действия (ESBL, БЛРС) → цефалоспорины
- 20. Характеристика бета-лактамаз
- 21. Характеристика бета-лактамаз
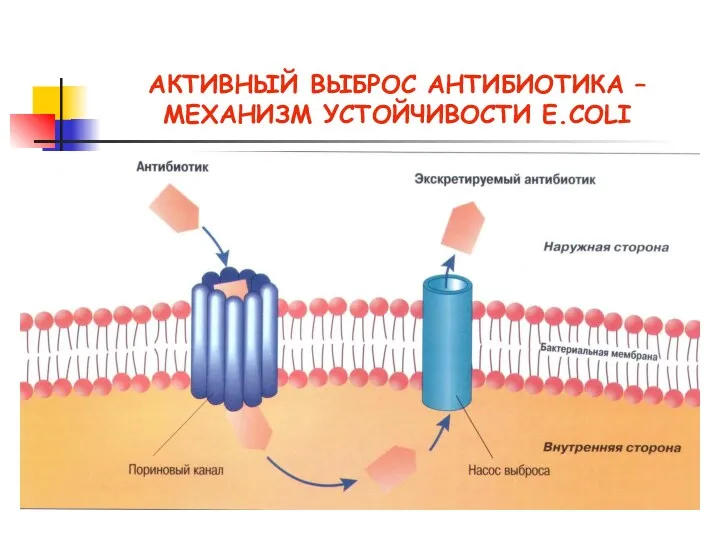
- 22. Механизмы резистентности Активное выведение антибиотика из бактериальной клетки (эффлюкс). Синегнойная палочка → карбопинемы. Хинолоны, макролиды, линкозамиды
- 23. АКТИВНЫЙ ВЫБРОС АНТИБИОТИКА – МЕХАНИЗМ УСТОЙЧИВОСТИ E.COLI
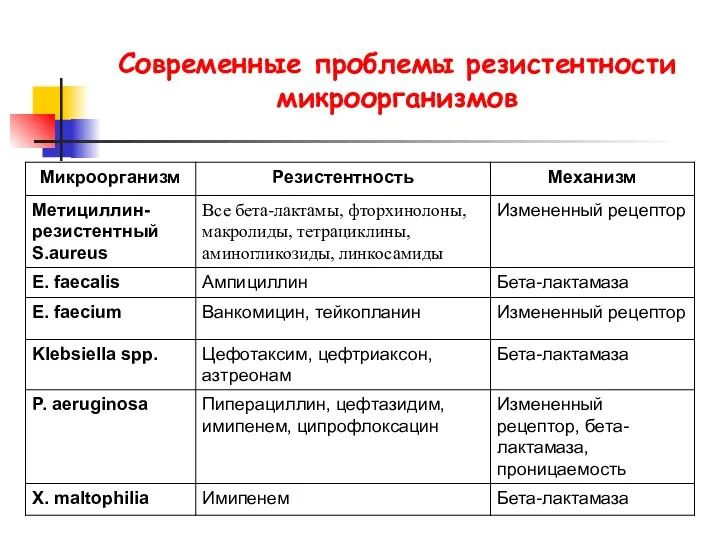
- 24. Современные проблемы резистентности микроорганизмов
- 25. Наиболее распространенные механизмы резистентности Enterobacteriaceae Продукция β-лактамаз расширенного спектра действия (Klebsiella spp.), обусловливающая клиническую неэффективность всех
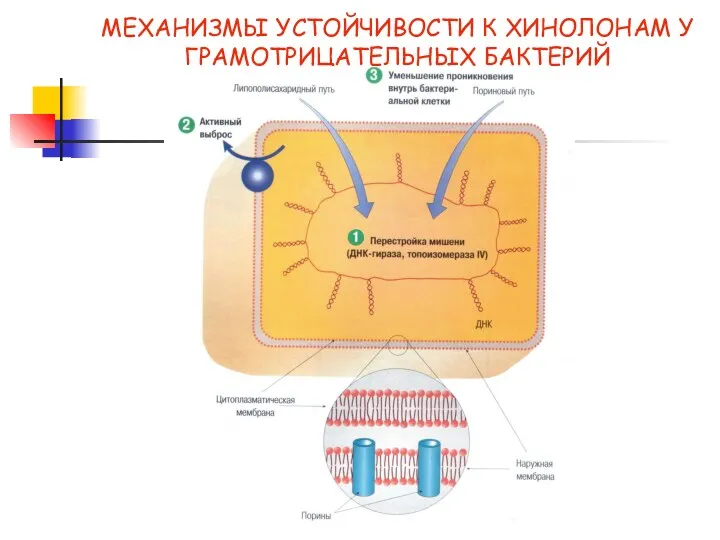
- 26. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К ХИНОЛОНАМ У ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ
- 27. Наиболее распространенные механизмы резистентности Pseudomonas spp., Acinetobacter spp., Stenotrophomonas maltophilia Ассоциированная устойчивость к цефалоспоринам, аминогликозидам, фторхинолонам,
- 28. Наиболее распространенные механизмы резистентности Enterococcus spp. Ассоциация устойчивости к пенициллинам, высокого уровня устойчивости к аминогликозидам, фторхинолонам
- 29. Наиболее распространенные механизмы резистентности Staphylococcus spp. (метициллин-резистентные) Ассоциированная устойчивость к макролидам, аминогликозидам, тетрациклинам, ко-тримоксазолу, фторхинолонам. Основное
- 30. Генотипы и фенотипы антибиотикорезистентности Генотип - совокупность детерминант, определяющих природную и приобретенную устойчивость микроорганизма. Непосредственная детекция
- 31. Исследование антибиотикорезистентности Цель исследования: выявление приобретенной устойчивости к антибактериальным препаратам у микроорганизмов − возбудителей инфекционных болезней.
- 32. Этапы проведения исследования антибиотикорезистентности Оценка целесообразности изучения антибиотикорезистентности выделенного микроорганизма (показания для проведения исследования). Выбор антибактериальных
- 33. Показания для проведения исследований Уровень устойчивости выделенного штамма не может быть предсказан на основании данных идентификации
- 34. Показания для проведения исследований Обязательному исследованию на антибиотикорезистентность подлежат все микроорганизмы, выделенные из первично стерильных жидкостей,
- 35. Подбор антибиотиков для включения в исследование Основой для выбора являются данные о природной устойчивости или чувствительности
- 36. Методы определения чувствительности бактерий к антибиотикам Серийных разведений В агаре, в бульоне Макровариант, микровариант По количеству
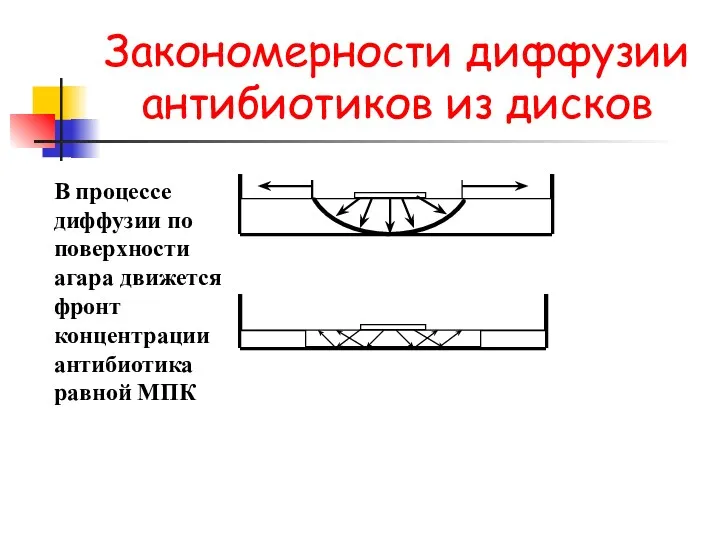
- 37. Закономерности диффузии антибиотиков из дисков В процессе диффузии по поверхности агара движется фронт концентрации антибиотика равной
- 38. Закономерности зонообразования Рост культуры на поверхности агара происходит в той области, где концентрация антибиотика не достигает
- 39. Е - тест
- 40. Преимущества коммерческих тест-систем Исключение трудоемких этапов Обеспечение стандартных питательных сред растворов антибиотиков Длительные сроки хранения
- 41. Турбидиметрические методы Основа: логарифмическая зависимость степени угнетения роста тест-организма от концентрации антибиотика. Метод: измерение концентрации клеток
- 42. Основные параметры, влияющие на выбор метода оценки антибиотикорезистентности точность; воспроизводимость; трудоемкость; стоимость.
- 43. Возможные методические ошибки при оценке чувствительности Состав среды, катионный, питательный Соблюдение правил приготовления среды (рН) Заливка
- 44. Контроль качества питательных сред контроль катионного состава: концентрация Са2+ (20-25 мг/л) и Mg2+ (10-12.5 мг/мл) -
- 45. Оценка антибиотикочувствительности Enterobacteriaceae Минимальный набор ампициллин; защищенный аминопенициллин цефотаксим или цефтриаксон; цефтазидим; гентамицин; ципрофлоксацин. Возможности расширения
- 46. Оценка антибиотикочувствительности P. aeruginosa Минимальный набор цефтазидим; пиперациллин (тикарциллин, тикарциллин, тикарциллин/клавуланат, пиперациллин/тазобактам); карбенициллин гентамицин; амикацин ципрофлоксацин;
- 47. Оценка антибиотикорезистентности микроорганизмов со сложными питательными потребностями Стрептококки. Для методов серийных разведений в бульоне - бульон
- 48. Оценка антибиотикорезистентности микроорганизмов со сложными питательными потребностями N. gonorrhoeae. Методы оценки антибиотикорезистентности гонококков в бульоне недостаточно
- 49. Метициллинрезистентные стафилококки Метициллинорезистентные штаммы Staphylococcus aureus – MRSA Частота MRSA в структуре стафилококковых инфекций: США →
- 50. Детекция метициллинрезистентности Тест-антибиотик - оксациллин Диско-диффузионный метод Недостаточная специфичность (80%) Метод серийных разведений Высокая чувствительность и
- 51. Первые сообщения К. Хираматсу (K. Hiramatsu), 1996 г. →MRSA Ванкомицин – 29 дней безрезультатно. Клинический эффект
- 52. Другие факторы, приводящие к снижению эффективности ванкомицина недостаточный уровень антибиотика в плазме, нарушения методики проведения лекарственного
- 53. Возможная альтернатива гликопептидам олигосахариды (эверниномицин), стрептограмины (хинупристин/дальфопристин) оксазалидиноны (линезолид).
- 54. Меры по ограничению распространения ванкомицинрезистентности разработка методов лабораторной диагностики и мониторинга ванкомицинрезистентности; разработка методики для контроля
- 55. Категории чувствительности микроорганизмов Чувствительный: лечение инфекции, вызванной данным микроорганизмом при применении данного антибиотика вероятно будет эффективным
- 56. Абсолютная резистентность Enterococcus faecalis Mycobacterium tuberculosis Pseudomonas aeruginosa
- 57. Формирование госпитальных штаммов – результат селективного действия антибиотиков "Порочный круг" − возникающие внутрибольничные инфекции требуют применения
- 58. РЕЗИСТЕНТНОСТЬ К АНТИБИОТИКАМ: НАРУШЕНИЕ ЭКОЛОГИЧЕСКОГО РАВНОВЕСИЯ Настало время, когда некоторые бактериальные инфекции уже не поддаются лечению
- 59. "Плотность" селекции Антибиотики → здравоохранение, животноводство и сельское хозяйство Всемирный естественный отбор Результатом использования антибиотиков является
- 60. Основные эффекты антибиотика лечебный – воздействие на внедрившийся инфекционный агент; устранение не патогенных бактерий.
- 61. Факторы нарушения экологии микромира плотность антибиотика число объектов противомикробной терапии площадь пораженной географической зоны Введение антибиотика
- 62. Обратимость резистентности Обратимость селекции зависит от репопуляции соответствующей среды исходными чувствительными бактериями. Доминирование резистентных штаммов может
- 63. Резервуар резистентности нормальная микрофлора; окружающая среда; пища
- 64. Нарушение экологии микромира изменение видов, появление и доминирование новых возбудителей оппортунистических инфекций болезней, по природе резистентные
- 65. Антибиотики – социальные препараты: влияют на качественный состав бактерий в окружающей среде и в организмах людей,
- 66. Антибиотики выходят из-под контроля Использование антибиотиков без показаний. По расчетам исследователей около 50 миллионов из 150
- 67. Подходы к решению проблемы снизить использование антибиотиков в животноводстве и земледелии; полный курс лечения до уничтожения
- 68. Подходы к решению проблемы отрегулировать процесс селекции → антибиотики нужно использовать с гораздо большей осторожностью. Решающий
- 69. Антибиотики и окружающая среда Основной путь уничтожения резистентных штаммов - вытеснение их чувствительными штаммами, которые сохраняются
- 70. "Пороговая доза антибиотика" предельный уровень использования, при котором антибиотик успешно применяется для борьбы с инфекциями внутри
- 71. Новый уровень понимания Информированные пациенты Образованные врачи Административные работники Министры здравоохранения
- 72. Уровни резистентности к антибиотикам глобальный, региональный, локальный (паспорт резистентности)
- 73. Глобальная стратегия по сдерживанию резистентности к противомикробным препаратам ВОЗ, 11 сентября 2001 г. содействие разумному применению
- 74. Глобальная стратегия по сдерживанию резистентности к противомикробным препаратам Ориентирована на всех, кто в той или иной
- 75. Роль микробиологического мониторинга в системе эпидемиологического надзора за внутрибольничными инфекциями СПбГМА им. И.И. Мечникова, городской ОМОКЭ
- 76. Распоряжением Комитета по Здравоохранению № 405-Р от 29.12.2004 «О внедрении микробиологического мониторинга как элемента инфекционного контроля»
- 77. Распоряжением КЗ «О внедрении микробиологического мониторинга, как элемента инфекционного контроля» № 405-Р от 29.12.2004 Определена необходимость
- 78. Для организации микробиологического мониторинга используются методические рекомендации и программа WHONET 5.4
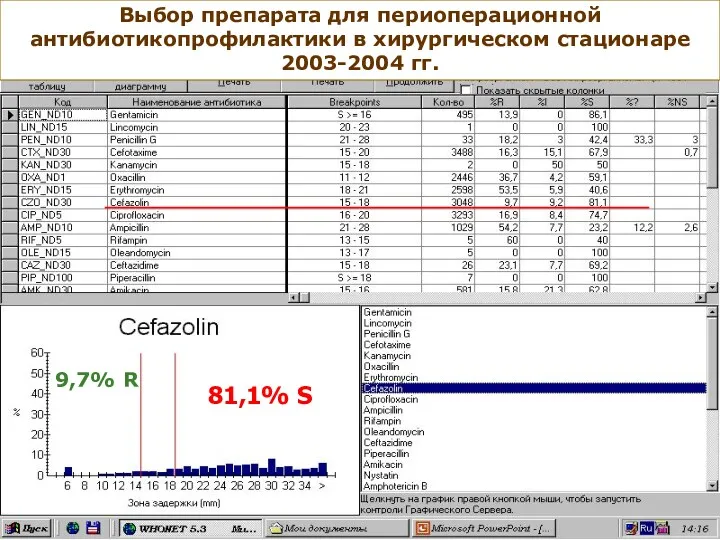
- 79. 81,1% S Выбор препарата для периоперационной антибиотикопрофилактики в хирургическом стационаре 2003-2004 гг. 9,7% R
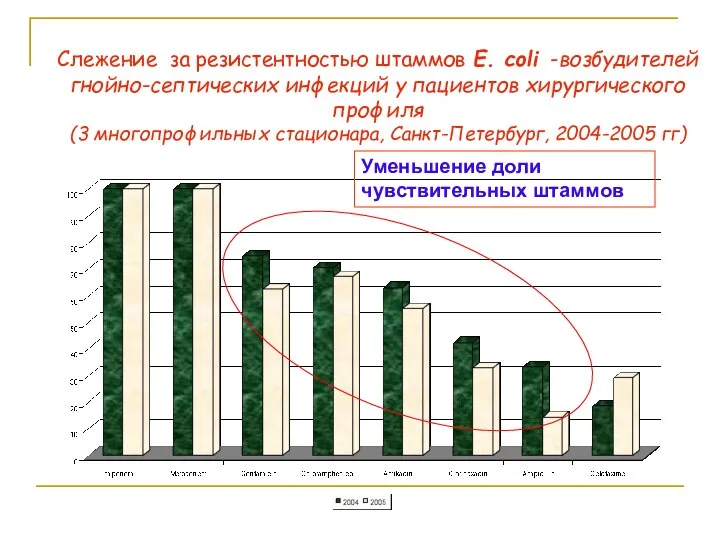
- 80. Слежение за резистентностью штаммов E. coli -возбудителей гнойно-септических инфекций у пациентов хирургического профиля (3 многопрофильных стационара,
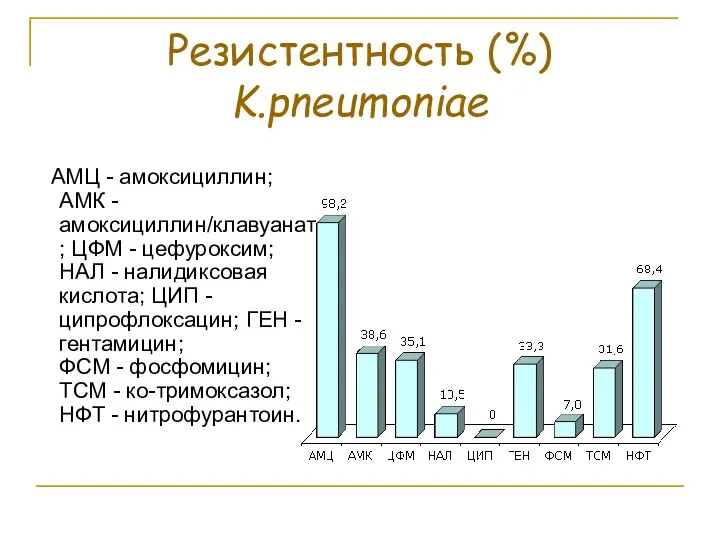
- 81. Резистентность (%) K.pneumoniae АМЦ - амоксициллин; АМК - амоксициллин/клавуанат; ЦФМ - цефуроксим; НАЛ - налидиксовая кислота;
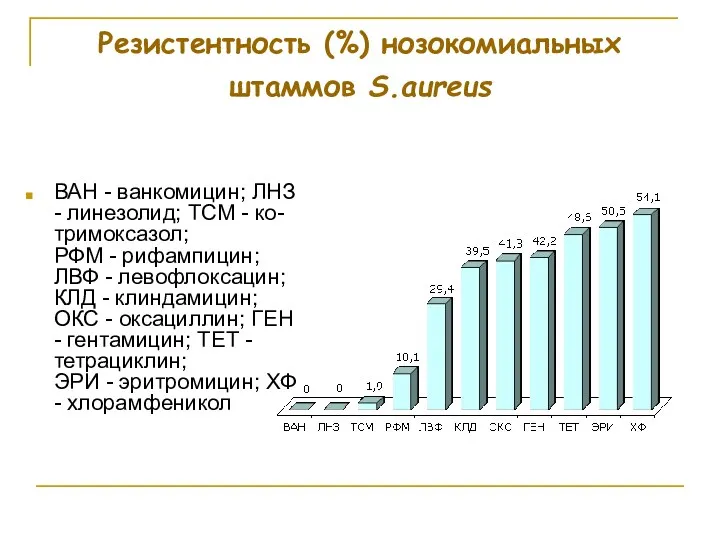
- 82. Резистентность (%) нозокомиальных штаммов S.aureus ВАН - ванкомицин; ЛНЗ - линезолид; ТСМ - ко-тримоксазол; РФМ -
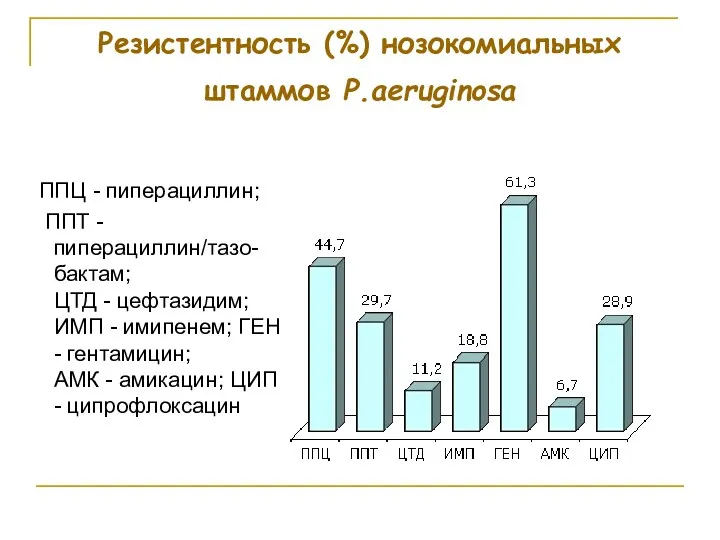
- 83. Резистентность (%) нозокомиальных штаммов P.aeruginosa ППЦ - пиперациллин; ППТ - пиперациллин/тазо-бактам; ЦТД - цефтазидим; ИМП -
- 85. Скачать презентацию






































































 Көкжөтел
Көкжөтел Профилактика вирусного гепатита А и Е
Профилактика вирусного гепатита А и Е Ревматоидный артрит
Ревматоидный артрит Синдром покраснения глаза
Синдром покраснения глаза ЭКГ-диагностика. Формирование электрокардиограммы
ЭКГ-диагностика. Формирование электрокардиограммы Врожденная кишечная непроходимость
Врожденная кишечная непроходимость Stoomipatsiendi hooldus
Stoomipatsiendi hooldus Головные боли. Вопросы дифференциальной диагностики и лечения
Головные боли. Вопросы дифференциальной диагностики и лечения Компания Микрохим. Таблетированные препараты, спреи с высокоточным дозированием и инъекции
Компания Микрохим. Таблетированные препараты, спреи с высокоточным дозированием и инъекции Нейропсихологические методы исследования в афазиологии
Нейропсихологические методы исследования в афазиологии Цитологическое исследование в клинической практике
Цитологическое исследование в клинической практике Аномалії розвитку плідного яйця
Аномалії розвитку плідного яйця Трихомониаз
Трихомониаз Гипервитаминоз D
Гипервитаминоз D Treatment of Angina Pectoris
Treatment of Angina Pectoris Нозология. Учение о болезни. Определение понятия болезнь, патологический процесс, патологическая реакция
Нозология. Учение о болезни. Определение понятия болезнь, патологический процесс, патологическая реакция Врожденные пороки сердца у взрослых
Врожденные пороки сердца у взрослых Лекарственные средства, влияющие на миометрий
Лекарственные средства, влияющие на миометрий Митральный стеноз
Митральный стеноз Хирургия мен травматологиядағы заманауи синтетикалық материалдар
Хирургия мен травматологиядағы заманауи синтетикалық материалдар Тромбоэмболия легочной артерии (ТЭЛА)
Тромбоэмболия легочной артерии (ТЭЛА) Сестринское вмешательство при хронической обструктивной болезни легких (ХОБЛ)
Сестринское вмешательство при хронической обструктивной болезни легких (ХОБЛ) Сосуды малого круга кровообращения. Кровообращение плода. (Лекция 13.1)
Сосуды малого круга кровообращения. Кровообращение плода. (Лекция 13.1) Променева діагностика захворювань серця і судин
Променева діагностика захворювань серця і судин Трансплантация сердца
Трансплантация сердца ГБУЗ НО Дзержинский перинатальный центр
ГБУЗ НО Дзержинский перинатальный центр Традиционная диагностика по языку
Традиционная диагностика по языку Молекулярные аспекты формирования алкогольной, опиумной и каннабиноидной
Молекулярные аспекты формирования алкогольной, опиумной и каннабиноидной