Современные возможности терапии дифференцированного рака щитовидной железы рефрактерного к терапии радиоактивным йодом презентация
Содержание
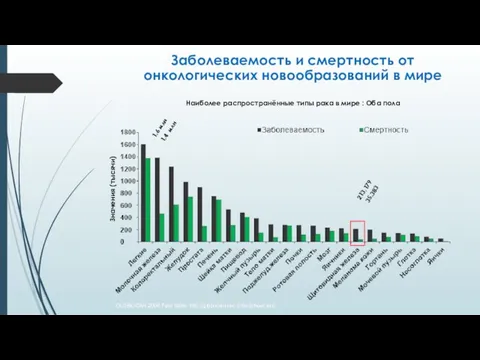
- 2. Заболеваемость и смертность от онкологических новообразований в мире GLOBOCAN 2008 Fast Stats. http://globocan.iarc.fr/factsheet.asp. Значения (тысячи) Наиболее
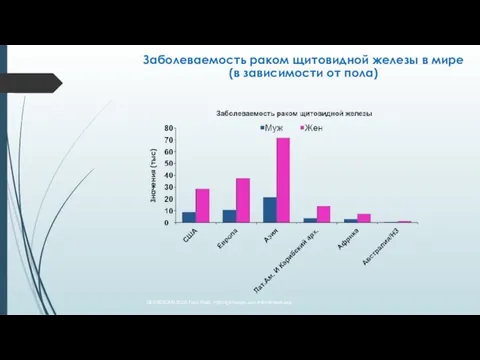
- 3. Заболеваемость раком щитовидной железы в мире (в зависимости от пола) Значения (тыс) GLOBOCAN 2008 Fast Stats.
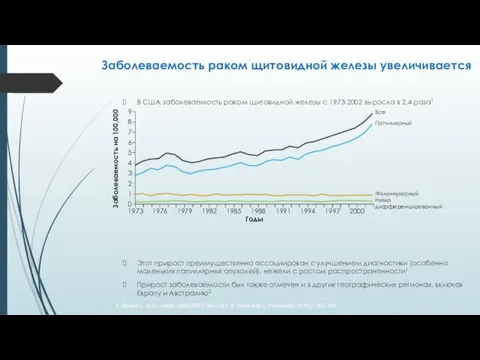
- 4. В США заболеваемость раком щитовидной железы с 1973-2002 выросла в 2.4 раза1 Этот прирост преимущественно ассоциирован
- 5. Заболеваемость раком щитовидной железы в России Годы Заболеваемость на 100 тыс. населения
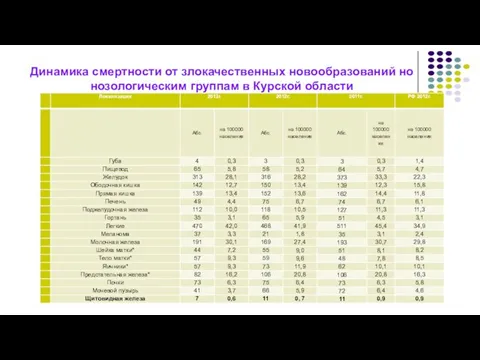
- 6. Динамика смертности от злокачественных новообразований но нозологическим группам в Курской области
- 7. Факторы риска рака развития щитовидной железы 1. American Cancer Society. Thyroid cancer. http://www.cancer.org/cancer/thyroidcancer/detailedguide/thyroid-cancer-risk-factors. 2. Wartofsky L.
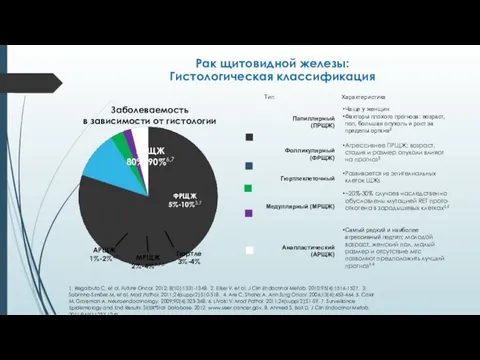
- 8. Рак щитовидной железы: Гистологическая классификация ПРЩЖ 80%-90%6,7 ФРЩЖ 5%-10%3,7 АРЩЖ 1%-2%4,7 МРЩЖ 2%-4%5,7,8 Гюртле 3%-4% 1.
- 9. Распределение пациентов на группы риска Группа низкого риска — пациенты с солитарной опухолью Т1N0M0 (размером менее
- 10. Оценка риска рецидивирования: ATA, American Thyroid Association; RAI, radioactive iodine; RxWBS, posttreatment whole-body RAI scan. Tuttle
- 11. Подходы к терапии дифференцированного РЩЖ Хирургия I131 ИТК
- 12. Алгоритм лечения ДРЩЖ Системная терапия Локальные методы Хирургия Лучевая терапия РЧА Гормоносупрессивная терапия Радиойодтерапия
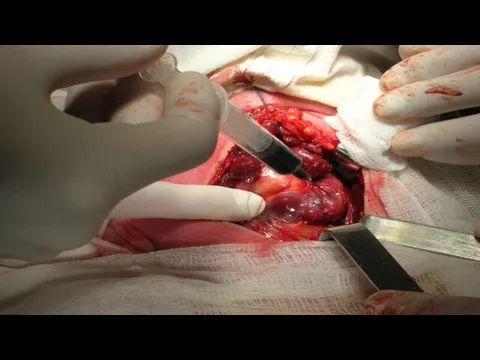
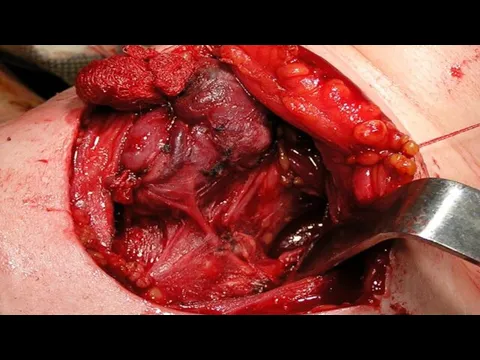
- 13. Хирургическое лечение РЩЖ Гемитиреоидэктомия с удалением перешейка Тиреоидэктомия
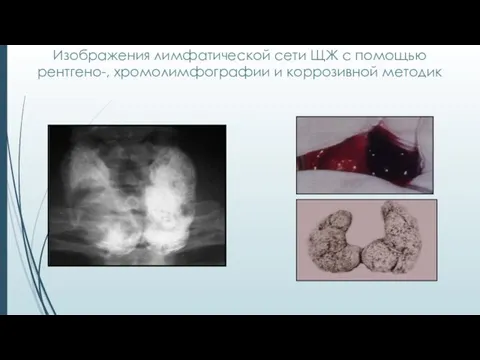
- 15. Изображения лимфатической сети ЩЖ с помощью рентгено-, хромолимфографии и коррозивной методик
- 16. Гемитиреоидэктомия с перешейком может быть выполнена при папиллярном раке Т1 до (опухоль до 2 см, ограниченная
- 18. ДРЩЖ: роль уровня ТГ в установлении прогрессирования заболевания Уровень ТГ является наиболее часто используемым маркером прогрессирования
- 19. Применение радиоактивного йода при РЩЖ Сканирование всего тела1 ДРЩЖ накапливает РЙ в большей степени, чем другие
- 20. Выживаемость и ответ на лечение Группа 1: исходное накопления 131I и ПО Возраст Высоко дифференцированный рак
- 21. Критерии радиойодрезистентности ДРЩЖ Наличие по крайней мере одного очага, не накапливающего радиоактивный йод или Прогрессирование опухолевого
- 22. Обоснование применения ИТК ИТК воздействуют на проангиогенные и онкогенные сигнальные пути как в эндотелиальных клетках (перицитах),
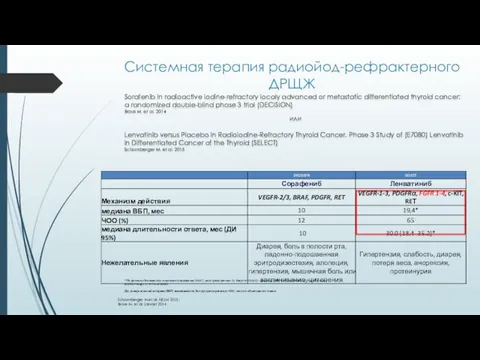
- 23. Системная терапия радиойод-рефрактерного ДРЩЖ Schlumberger M et al. NEJM 2015; Brose M. et al. Lancet 2014
- 24. Рандомизированное двойное слепое плацебо-контролируемое исследование сорафениба у пациентов с местно-распространенным или метастатическим I131-рефрактерным дифференцированным раком щитовидной
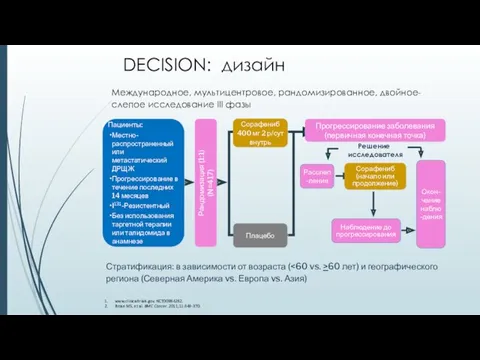
- 25. Международное, мультицентровое, рандомизированное, двойное-слепое исследование III фазы www.clinicaltrials.gov. NCT00984282. Brose MS, et al. BMC Cancer. 2011;11:349-370.
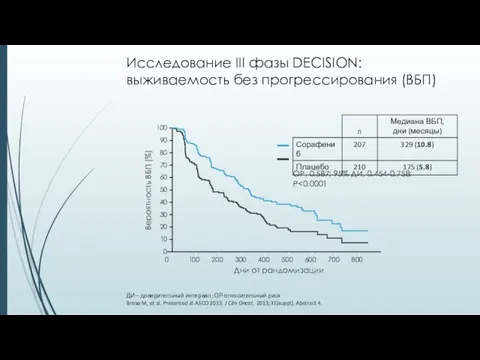
- 26. www.clinicaltrials.gov. ClinicalTrials.gov identifier # NCT00984282. Brose M, et al. BMC Cancer. 2011;11:349. Первичная конечная точка Выживаемость
- 27. ДИ – доверительный интервал; ОР относительный риск Brose M, et al. Presented at ASCO 2013. J
- 28. Brose M, et al. Presented at ASCO 2013. J Clin Oncol. 2013;31(suppl). Abstract 4. Вторичные точки
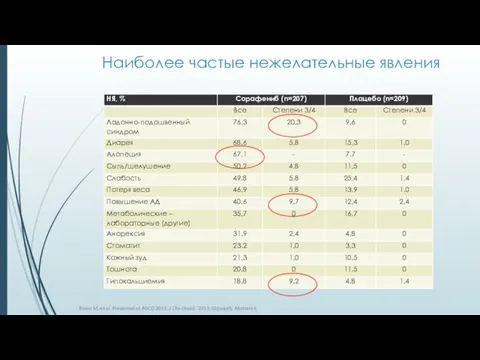
- 29. Наиболее частые нежелательные явления Brose M, et al. Presented at ASCO 2013. J Clin Oncol. 2013;31(suppl).
- 30. Выводы: DECISION DECISION – первое положительное исследование III фазы таргетной терапии при радиойодрефрактерном дифференцированном раке щитовидной
- 31. Исследование 303 (SELECT): многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое ИССЛЕДОВАНИЕ применения ленватиниба у пациентов с рефрактерным к
- 32. Обоснование исследования У пациентов с РЙР-ДРЩЖ уровень 10-летней выживаемости со времени обнаружения метастазов составлял 10% 1-3
- 33. Распределение пациентов
- 34. Исследование 303 (SELECT): схема исследования Пациенты с ДРЩЖ (N=392) Признаки прогрессирования в предыдущие 13 месяцев при
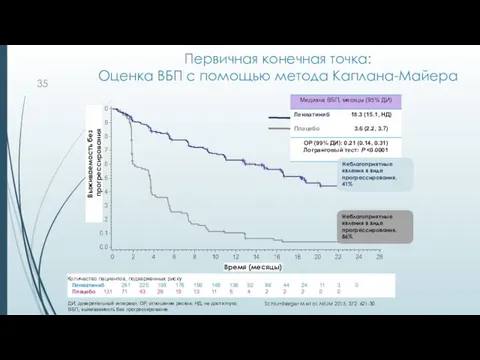
- 35. Первичная конечная точка: Оценка ВБП с помощью метода Каплана-Майера ДИ, доверительный интервал; ОР, отношение рисков; НД,
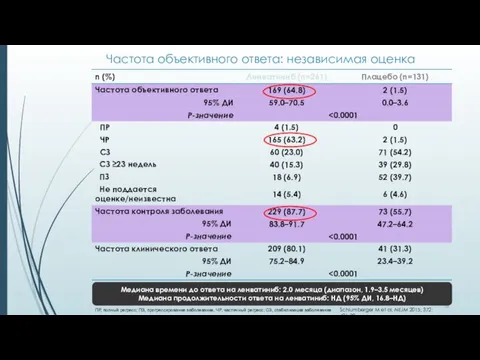
- 36. Частота объективного ответа: независимая оценка Медиана времени до ответа на ленватиниб: 2.0 месяца (диапазон, 1.9–3.5 месяцев)
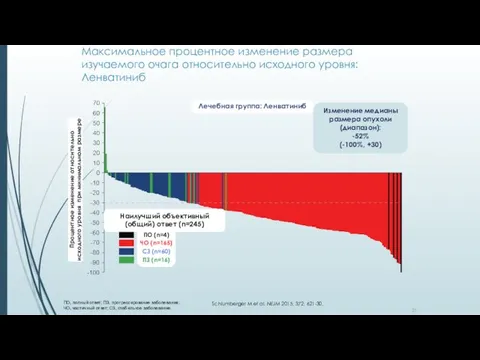
- 37. Максимальное процентное изменение размера изучаемого очага относительно исходного уровня: Ленватиниб ПО, полный ответ; ПЗ, прогрессирование заболевания;
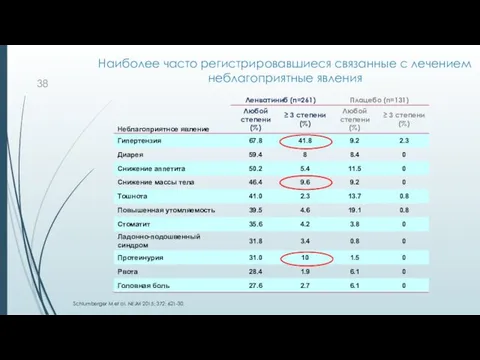
- 38. Наиболее часто регистрировавшиеся связанные с лечением неблагоприятные явления Schlumberger M et al. NEJM 2015; 372: 621-30.
- 39. Обзор нежелательных явлений Schlumberger M et al. NEJM 2015; 372: 621-30.; НЯ, неблагоприятные явления. 6/20 летальных
- 40. Исследование SELECT: выводы У пациентов с РЙР-ДРЩЖ ленватиниб существенно увеличивал медиану ВБП на 14.7 месяцев в
- 41. Обновленный анализ данных исследования «SELECT» дата среза данных: 31 Августа 2015г.
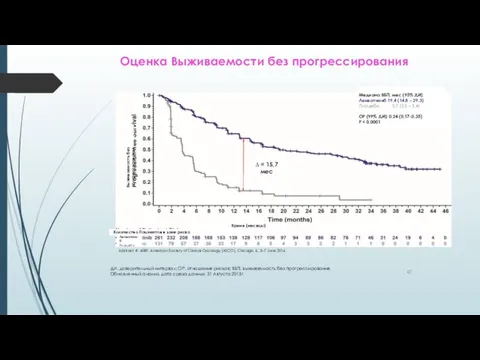
- 42. Оценка Выживаемости без прогрессирования ДИ, доверительный интервал; ОР, отношения рисков; ВБП, выживаемость без прогрессирования. Обновленный анализ,
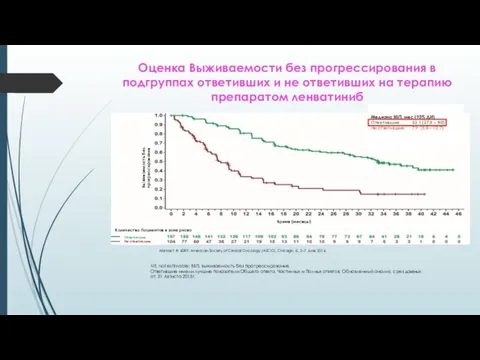
- 43. Оценка Выживаемости без прогрессирования в подгруппах ответивших и не ответивших на терапию препаратом ленватиниб NE, not
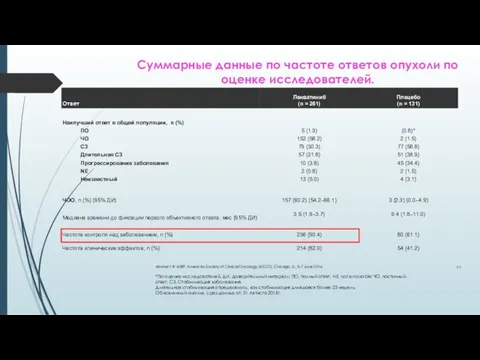
- 44. Суммарные данные по частоте ответов опухоли по оценке исследователей. *По оценке исследователей, ДИ, Доверительный интервал; ПО,
- 45. Медиана ДОО в группе ленватиниба в исследовании SELECT CI, confidence interval; ДОО, Длительность объективного ответа; NE,
- 46. Системная терапия радиойод-рефрактерного ДРЩЖ Schlumberger M et al. NEJM 2015; Brose M. et al. Lancet 2014
- 47. Клинические рекомендации NCCN v. 1.2017: Рак щитовидной железы Ленватиниб рекомендован в качестве препарата предпочтительного выбора при
- 49. Скачать презентацию



























 Клуб правильного питания. Часть 1
Клуб правильного питания. Часть 1 Вроджені вади грудної клітки
Вроджені вади грудної клітки Эпидемиология и профилактика холеры
Эпидемиология и профилактика холеры Обоснование применения визуальных методов исследования в гинекологии
Обоснование применения визуальных методов исследования в гинекологии Балалардағы эндокриндік патологияның визуалді диагностика әдістерінің ерекшеліктері
Балалардағы эндокриндік патологияның визуалді диагностика әдістерінің ерекшеліктері Тактические принципы работы выездных бригад скорой медицинской помощи
Тактические принципы работы выездных бригад скорой медицинской помощи Сальмонеллёзы. Этиология
Сальмонеллёзы. Этиология Инфекция. Роль микроорганизмов в развитии инфекционных заболеваний человека
Инфекция. Роль микроорганизмов в развитии инфекционных заболеваний человека Анализ ассортимента антиаритмических препаратов в аптечной организации
Анализ ассортимента антиаритмических препаратов в аптечной организации Жүрекшелер фибрилляция кезінде анти аритмиялық препараттарды (амидарон, флекайнид) салыстыру
Жүрекшелер фибрилляция кезінде анти аритмиялық препараттарды (амидарон, флекайнид) салыстыру Совершенствование организационной структуры медицинской организации (на примере ООО ММЦ Диалайн)
Совершенствование организационной структуры медицинской организации (на примере ООО ММЦ Диалайн) Ісік жасушаларын зерттеу
Ісік жасушаларын зерттеу Раневые инфекции. Этиологическая структура
Раневые инфекции. Этиологическая структура Современные принципы организации акушерскогинекологической помощи
Современные принципы организации акушерскогинекологической помощи Презентация ООИБ-ПНД
Презентация ООИБ-ПНД Клиника и лечение современной холеры
Клиника и лечение современной холеры Страховая модель здравоохранения
Страховая модель здравоохранения Жүре пайда болған жүрек ақаулары
Жүре пайда болған жүрек ақаулары Назальный глюкагон как альтернатива введению глюкагона у детей с сахарным диабетом I типа при гипогликемических состояниях
Назальный глюкагон как альтернатива введению глюкагона у детей с сахарным диабетом I типа при гипогликемических состояниях Профилактика врожденной патологии лица
Профилактика врожденной патологии лица Опухолевый рост
Опухолевый рост Интерннің өзіндік жұмысы
Интерннің өзіндік жұмысы Гематогенді остеомиелит
Гематогенді остеомиелит Симптоматическая артериальная гипертензия
Симптоматическая артериальная гипертензия Эпилепсия. Классификация припадков. Первая помощь
Эпилепсия. Классификация припадков. Первая помощь Правильная осанка
Правильная осанка Диссеминированное внутрисосудистое свертывание крови (ДВС)
Диссеминированное внутрисосудистое свертывание крови (ДВС) Интерферон короткого действия
Интерферон короткого действия