Управление качеством на фармацевтическом предприятии. Служба качества фармацевтических компаний презентация
- Главная
- Медицина
- Управление качеством на фармацевтическом предприятии. Служба качества фармацевтических компаний

Содержание
- 2. Система менеджмента качества предприятия фармацевтического профиля необходимо считать комплексом процессов (наиболее часто классифицируемых на основные, управленческие
- 3. Общие направления развития стандартов
- 4. В настоящее время в развитии фармацевтического производства нашей страны наступил критический момент, характеризующийся разнонаправленными тенденциями и,
- 5. Система менеджмента качества (СМК) – это система внутрифирменного управления, направленная на достижение определенных критериев качества выпускаемой
- 6. Система обеспечения качества при производстве лекарственных средств должна гарантировать, что: Продукция разработана с учетом всех требовании
- 7. Необходимо отметить, что внедрение стандартов ИСО серии 9000 на предприятии является добровольным решением руководства и направлено,
- 8. Таблица 2 – Фармацевтические предприятия мира с сертифицированной системой качества
- 9. Основными преимуществами внедрения интегрированной системы менеджмента являются: Изменение подхода к обеспечению качества и безопасности лекарственных средств,
- 10. Систему обеспечения качества фармацевтического предприятия нужно рассматривать, как интегрированную систему, в основе которой лежат стандарты (базовые
- 11. «На сегодня из 42 производителя лекарственных средств 4 производственных участков двух производителей - АО «Химфарм» и
- 13. Скачать презентацию
Система менеджмента качества предприятия фармацевтического профиля необходимо считать комплексом процессов (наиболее часто
Система менеджмента качества предприятия фармацевтического профиля необходимо считать комплексом процессов (наиболее часто
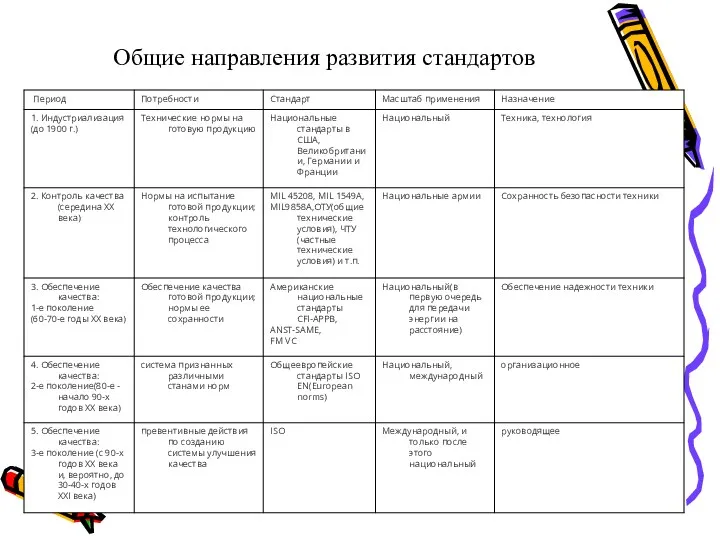
Общие направления развития стандартов
Общие направления развития стандартов
В настоящее время в развитии фармацевтического производства нашей страны наступил критический
В настоящее время в развитии фармацевтического производства нашей страны наступил критический
Понятия «качество» и «безопасность» должны стать девизом предприятий фармацевтической промышленности. Фармацевтический рынок мира динамично развивается, что приводит к повышению конкуренции и требовании к организации управления фармацевтическими предприятиями. В этих условиях определение основных направлений повышения конкурентоспособности является важной стратегической задачей фармацевтического предприятия.
Проведенный анализ фармацевтических предприятий стран – лидеров мировой экономики показывает, что достижения стратегической цели в управлении обеспечивается интегрированных систем использования европейских методов менеджмента качества, сертификация систем в соответствии с ISO 9000, GMP, GLP, GCP, GDP, т.д. [1]
Система менеджмента качества (СМК) – это система внутрифирменного управления, направленная на
Система менеджмента качества (СМК) – это система внутрифирменного управления, направленная на
Система обеспечения качества при производстве лекарственных средств должна гарантировать, что:
Продукция разработана
Система обеспечения качества при производстве лекарственных средств должна гарантировать, что:
Продукция разработана
На все операции по производству и контролю составлена четкая документация в соответствии с правилами стандарта;
Ответственность и полномочия строго определены;
Выполняются мероприятия по производству, поставке и использованию надлежащего исходного сырья и упаковочного материала;
Проводиться контроль промежуточной продукции и технологического процесса, а также валидация;
Контроль и проверка готовой продукции проводиться в соответствии с требованиями стандарта и законодательства;
Выполняется процедура проведения самоинспекции и/или аудита качества, по которой регулярно оценивают эффективность и пригодность системы обеспечения качества.
Необходимо отметить, что внедрение стандартов ИСО серии 9000 на предприятии является
Необходимо отметить, что внедрение стандартов ИСО серии 9000 на предприятии является
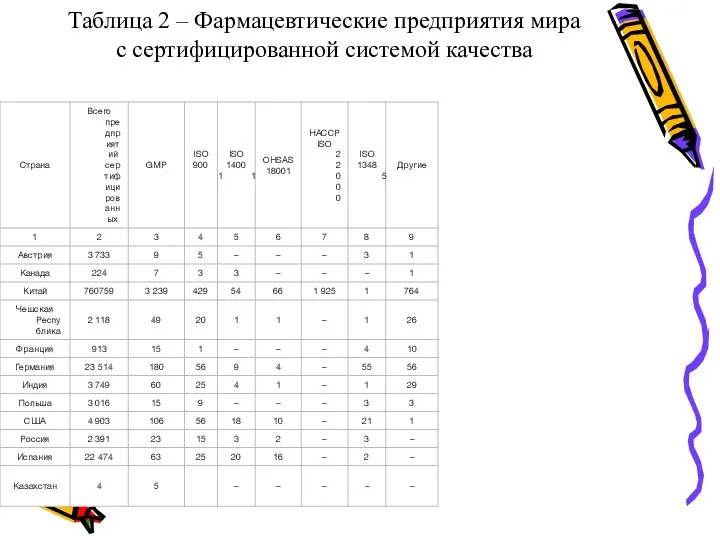
Для фармацевтических предприятий наиболее характерно создание интегрированной системы менеджмента, которая соответствует требованиям стандартов ИСО серии 9000 и правилам GMP. В связи с этим совершенствования деятельности на фармацевтическом предприятии необходимо внедрение интегрированных систем менеджмента, отвечающих требованиям международных стандартов и обобщающих мировой опыт системного управления. Количество фармацевтических предприятий с интегрированной системой менеджмента качества увеличивается с каждым годом.(табл. 2).
Таблица 2 – Фармацевтические предприятия мира с сертифицированной системой качества
Таблица 2 – Фармацевтические предприятия мира с сертифицированной системой качества
Основными преимуществами внедрения интегрированной системы менеджмента являются:
Изменение подхода к обеспечению качества
Основными преимуществами внедрения интегрированной системы менеджмента являются:
Изменение подхода к обеспечению качества
Четкое определение ответственности за обеспечение безопасности лекарственных средств;
Документальное подтверждение уверенности в безопасности лекарственных средств, что особо важно при работе с потребителем, в т.ч. при судебных разбирательствах.
Обеспечение системного подхода, включающего все параметры безопасности лекарственных средств – от сырья до потребителя;
Более экономное использование ресурсов для управления безопасностью;
Снижение финансовых издержек, связанных с выпуском некачественной продукции;
Повышение доверия потребителя к качеству выпускаемых лекарственных средств;
Обеспечение деятельности предприятия в целом и оптимального режима работы систем контроля и верификации в частности;
Увеличение возможностей выхода на новые рынки сбыта и расширение существующих;
Повышение готовности у зарубежных инвесторов идти на капиталовложение;
обеспечение репутации производителя качественных и безопасных лекарственных средств.
Систему обеспечения качества фармацевтического предприятия нужно рассматривать, как интегрированную систему, в
Систему обеспечения качества фармацевтического предприятия нужно рассматривать, как интегрированную систему, в
Серии ИСО 9000, описывающие организационную структуру управления качеством;
Стандарты GMP, которые содержат требования к производству и контролю качества лекарственных средств для человека и животных (СТ РК 1617-2006). [5]
Дополнительные стандарты:
Стандарты, устанавливающие требования к системе экологического менеджмента (ISO 14001:2004);
Стандарты, устанавливающие требования к системе менеджмента безопасности продукции (ИСО 22000-2007, Управление рисками по качеству ICH Q9, ISO 31000:2009); 1. Стандарты ИСО
Стандарты, устанавливающие требования к информационной безопасности (ISO/IEC 27001:2005);
Стандарты, устанавливающие требования в области охраны здоровья и безопасности труда (OHSAS 18001:2007);
Стандарты, помогающие предприятию разработать и внедрить эффективную систему управления, направленную на повышение уровня условий труда и жизненного уровня сотрудников компании (SA 8000; ISO 26000:2010).
«На сегодня из 42 производителя лекарственных средств 4 производственных участков двух
«На сегодня из 42 производителя лекарственных средств 4 производственных участков двух
18 производителей также планируют получить сертификаты GMP. Сейчас они делают для этого все возможное: строят новые здания, проводят реконструкцию старых зданий, обучают инженер-технологов и.т.д. Продолжается подготовка национального инспектората с привлечением международных специалистов. Всего по стране обучено свыше 200 специалистов государственного органа.
Проводится работа по вступлению Казахстана в международную систему сотрудничества фармацевтических инспекций (PIC/S). В марте 2015 Казахстан получил статус заявителя на присоединение к PIC/S.
PIC/S - международная организация, объединяющая фармацевтические инспекционные органы для обеспечения активного сотрудничества в области GMP.








 Хронические неспецифические заболевания лёгких у детей
Хронические неспецифические заболевания лёгких у детей Неотложная помощь при анафилаксии и анафилактическом шоке
Неотложная помощь при анафилаксии и анафилактическом шоке Основы трансплантологии
Основы трансплантологии Нейродиетология тиков и гиперкинезов
Нейродиетология тиков и гиперкинезов История неврологии
История неврологии Лечебная физкультура при заболеваниях гепатобилиарной системы
Лечебная физкультура при заболеваниях гепатобилиарной системы Кровь. Лимфа. Кроветворение (гемопоэз)
Кровь. Лимфа. Кроветворение (гемопоэз) Модели нормативного, правового регулирования врачебной тайны от Гиппократа до современности
Модели нормативного, правового регулирования врачебной тайны от Гиппократа до современности Предмет, задачи, основные этапы и направления развития психиатрии. Организация психиатрической помощи в России
Предмет, задачи, основные этапы и направления развития психиатрии. Организация психиатрической помощи в России Мышцы, фасции и топография туловища в функциональном и клиническом аспектах
Мышцы, фасции и топография туловища в функциональном и клиническом аспектах Клиническая фармакология как наука. Задачи. Основные положения
Клиническая фармакология как наука. Задачи. Основные положения Особенности оказания медико-психологической и реабилитационной помощи комбатантам в Российской Федерации
Особенности оказания медико-психологической и реабилитационной помощи комбатантам в Российской Федерации Клиническая анатомия больших суставов
Клиническая анатомия больших суставов Жұлынның сегменттік құрылысы. Жай және күрделі рефлекторлық доғалар
Жұлынның сегменттік құрылысы. Жай және күрделі рефлекторлық доғалар Реконструкция проксимального отдела бедра после неудач в лечении травм
Реконструкция проксимального отдела бедра после неудач в лечении травм Производные фторхинолонов (ломефлоксацин, офлоксацин) и хиназолина (празозин). Требования к качеству, методы анализа
Производные фторхинолонов (ломефлоксацин, офлоксацин) и хиназолина (празозин). Требования к качеству, методы анализа Вторичные иммунодефициты
Вторичные иммунодефициты Замедляем старение. Всё об увядании кожи
Замедляем старение. Всё об увядании кожи Первая помощь при неотложных состояниях: закон и порядок
Первая помощь при неотложных состояниях: закон и порядок Спайсы- памятка для родителей
Спайсы- памятка для родителей Программы добровольного медицинского страхования для студентов МГИМО(У)
Программы добровольного медицинского страхования для студентов МГИМО(У) Биологически активные добавки (БАД)
Биологически активные добавки (БАД) Новое в оказании медицинской помощи, в трудовых отношениях для организаций отдыха и оздоровления детей
Новое в оказании медицинской помощи, в трудовых отношениях для организаций отдыха и оздоровления детей Язвенная болезнь
Язвенная болезнь Система ранней помощи
Система ранней помощи Дифтерия. Возбудитель дифтерии
Дифтерия. Возбудитель дифтерии Закаливание как основа здоровья человека
Закаливание как основа здоровья человека Подагра. Эпидемиология
Подагра. Эпидемиология