Содержание
- 2. ВАКЦИНЫ - Иммунобиологические препараты на основе живых аттенуированных или инактивированных микроорганизмов, токсинов, микробных антигенов Применяются для
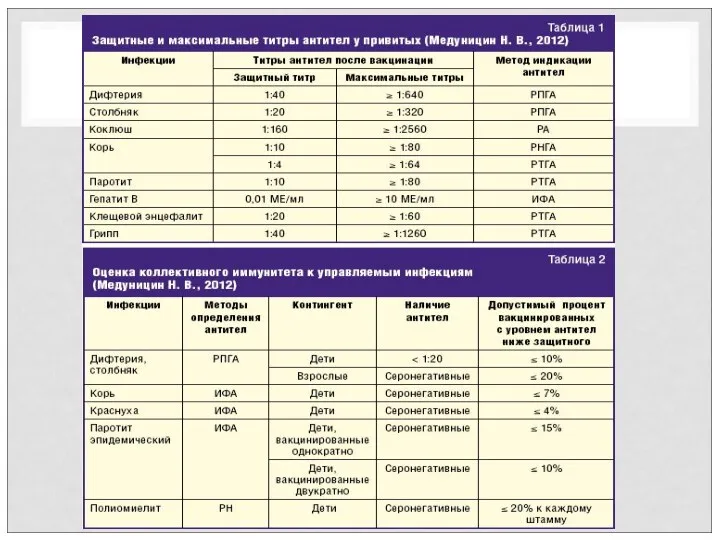
- 4. ТЕРМИНОЛОГИЯ Протективный титр антител - минимальное количество антител, постоянно синтезируемые после курса вакцинации, обеспечивающее защиту от
- 5. ОСНОВОПОЛОЖНИКИ ВАКЦИНОЛОГИИ Эдвард Дженнер (1749-1823)
- 6. Луи Пастер (1822-1895) ОСНОВОПОЛОЖНИКИ ВАКЦИНОЛОГИИ
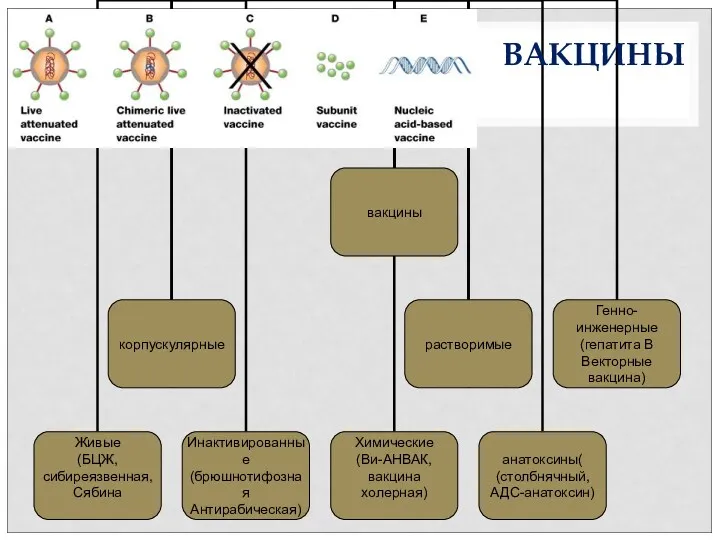
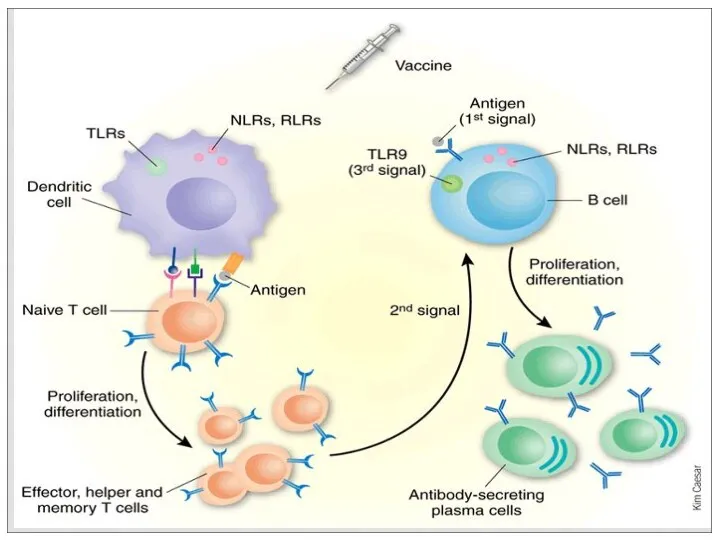
- 7. ВАКЦИНЫ ВАКЦИНЫ
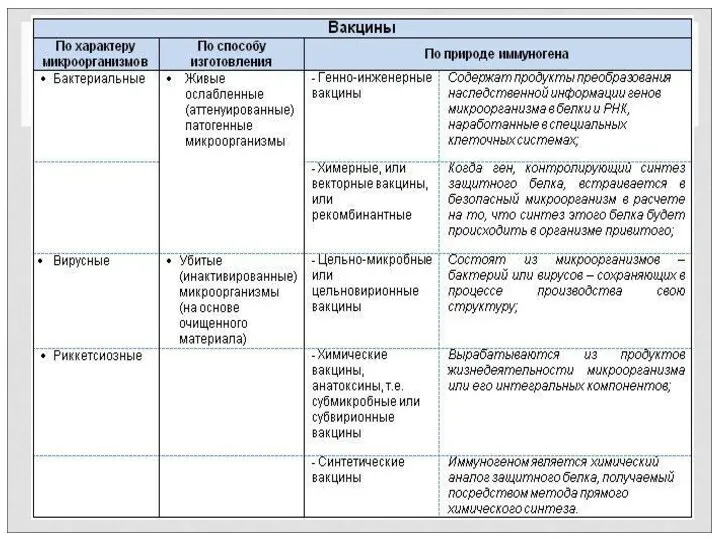
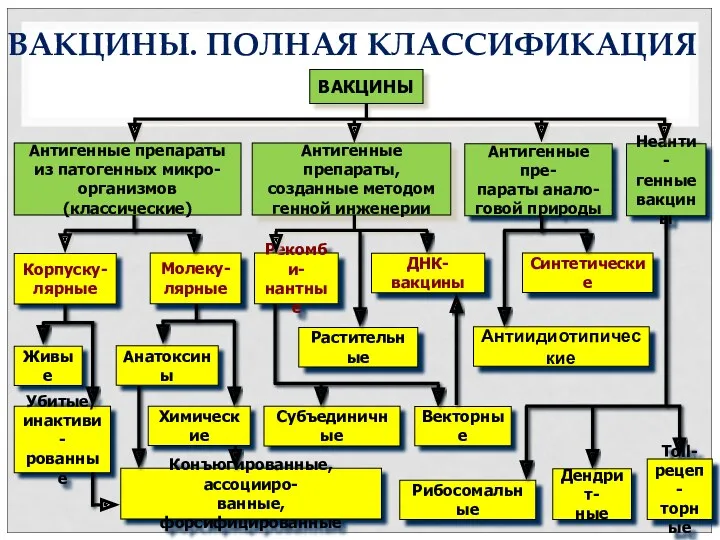
- 9. Антигенные пре- параты анало- говой природы ВАКЦИНЫ Антигенные препараты из патогенных микро- организмов (классические) Антигенные препараты,
- 10. ЖИВЫЕ ВАКЦИНЫ Живые вакцины представляют собой взвесь вакцинных штаммов микроорганизмов: бактерий, вирусов, риккетсий Основа живых вакцин
- 11. ЖИВЫЕ ВАКЦИНЫ Наряду с генетически закрепленной утратой патогенных свойств и потерей способности вызывать у человека инфекционное
- 12. ЖИВЫЕ ВАКЦИНЫ Преимущества: создают прочный и длительный иммунитет, по напряженности приближающийся к постинфекционному иммунитету; могут вводиться
- 13. ЖИВЫЕ ВАКЦИНЫ Недостатки: Для обеспечения безопасности живых вакцин необходимо иметь генетически стабильный гомогенный аттенуированный штамм и
- 14. ЖИВЫЕ ВАКЦИНЫ Большинство живых вакцин выпускается в сухом лиофилизированном виде (кроме полиомиелитной). Такие вакцины имеют достаточно
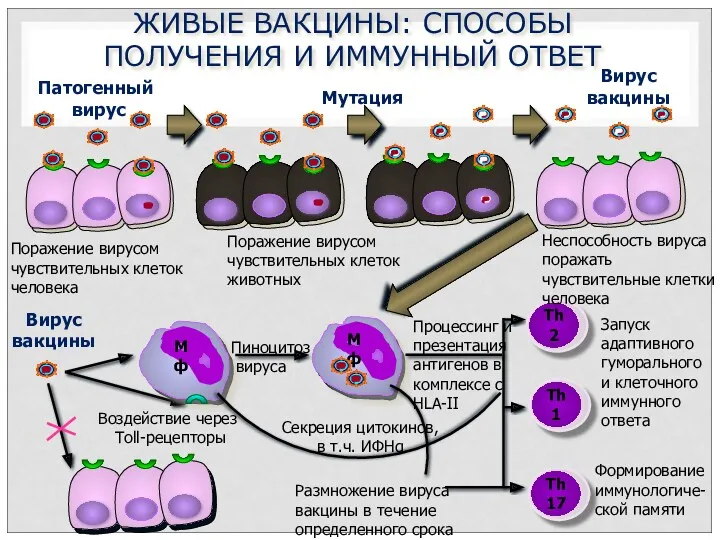
- 15. ЖИВЫЕ ВАКЦИНЫ: СПОСОБЫ ПОЛУЧЕНИЯ И ИММУННЫЙ ОТВЕТ Мф Мф Мутация Патогенный вирус Вирус вакцины Неспособность вируса
- 16. ЖИВЫЕ ВАКЦИНЫ
- 17. ЖИВЫЕ ВАКЦИНЫ Вакцина гриппозная аллантоисная живая сухая интраназальная содержит аттенуированные эпидемически актуальные штаммы вируса гриппа типов
- 18. Вакцина БЦЖ (BCG – бацилла Кальметта и Герена) – содержит живые авирулентные микобактерии, полученные из M.bovis
- 19. ЖИВЫЕ ВАКЦИНЫ Вакцина для профилактики ветряной оспы содержит живой аттенуированный вирус Varicella zoster (штамм Oka), полученный
- 20. ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Убитые вакцины готовятся из инактивированных культур вирулентных штаммов бактерий и вирусов, обладающих полным набором
- 22. ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Преимущества: Не вызывают инфекционных заболеваний Недостатки: Стимулируют развитие только общего гуморального иммунитета Требуется 2-3х-кратное
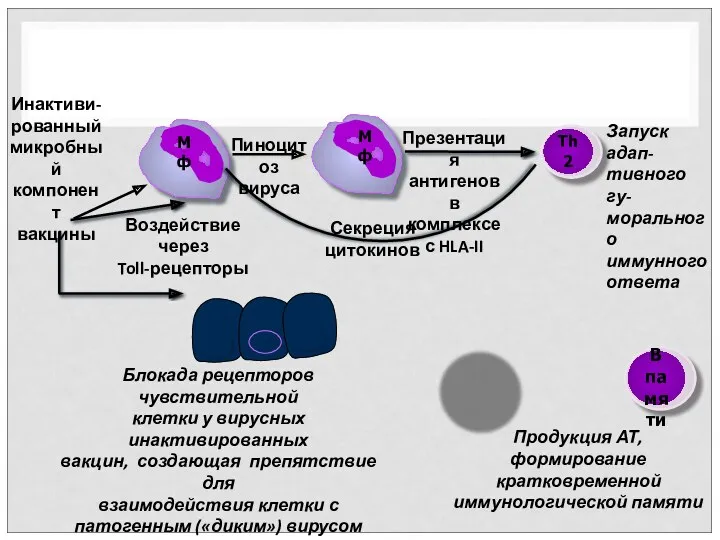
- 23. Инактиви- рованный микробный компонент вакцины Пиноцитоз вируса Воздействие через Toll-рецепторы Презентация антигенов в комплексе с HLA-II
- 24. Инактивированные вирусные вакцины Одна из особенностей производства инактивированных вакцин заключается в необходимости строгого контроля за полнотой
- 25. ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Вакцина брюшнотифозная спиртовая сухая готовится из штамма S. typhi Ту2 путем инактивации бактерий этиловым
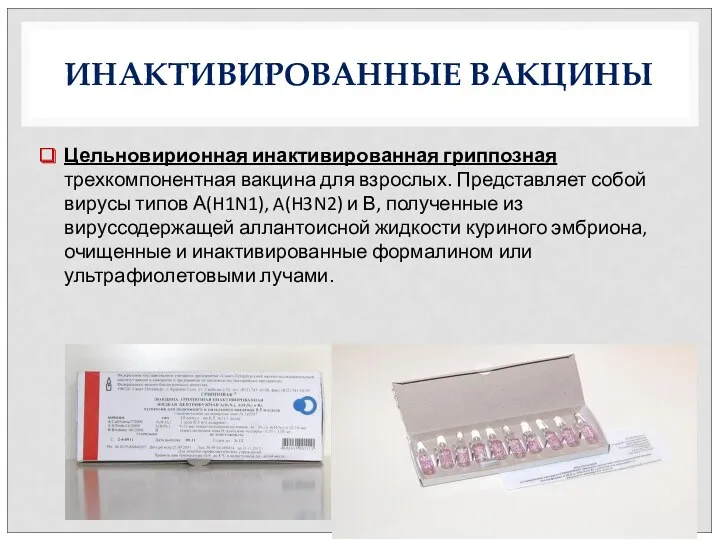
- 26. ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Цельновирионная инактивированная гриппозная трехкомпонентная вакцина для взрослых. Представляет собой вирусы типов А(H1N1), A(H3N2) и
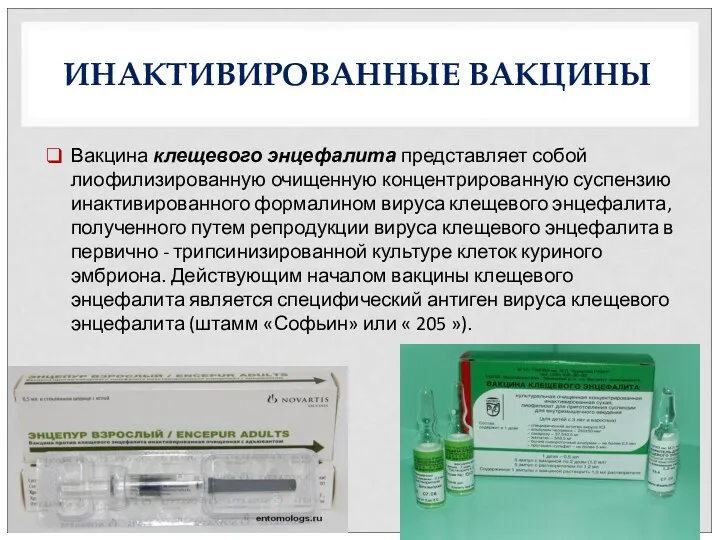
- 27. ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Вакцина клещевого энцефалита представляет собой лиофилизированную очищенную концентрированную суспензию инактивированного формалином вируса клещевого энцефалита,
- 28. ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Геп-А-ин-Вак - КУЛЬТУРАЛЬНАЯ ОЧИЩЕННАЯ КОНЦЕНТРИРОВАННАЯ АДСОРБИРОВАННАЯ ИНАКТИВИРОВАННАЯ ЖИДКАЯ ВАКЦИНА ПРОТИВ ГЕПАТИТА А представляет собой
- 29. ЛЕЧЕБНЫЕ ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Вакцины из убитых бактерий применяются для лечения (вакцинотерапия) инфекционных заболеваний, имеющих характер хронического
- 30. ЛЕЧЕБНЫЕ ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ В России зарегистрированы и применяются лечебные вакцины: герпетическя (ВПГ 1 и 2 «Витагерпавак»,
- 31. Гонококковая вакцина Вакцина приготовлена из взвеси гонококков 12 свежевыделенных от больных людей штаммов и убитых нагреванием.
- 32. ЛЕЧЕБНЫЕ ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Действие вакцин строго специфично, применение индивидуально. Это связано с тем, что вакцинотерапия вызывает
- 33. ХИМИЧЕСКИЕ ВАКЦИНЫ - препараты, содержащие наиболее активные по иммунологическим свойствам (протективные) антигены, извлекаемые из микробных клеток
- 34. ХИМИЧЕСКИЕ ВАКЦИНЫ Преимущества химических вакцин: из микробных клеток выделяются иммунологически активные субстанции — изолированные антигены (комплекс
- 35. ХИМИЧЕСКИЕ ВАКЦИНЫ Недостатки химических вакцин: небольшие размеры вводимых комплексов, что приводит к быстрому выведению их из
- 36. ХИМИЧЕСКИЕ ВАКЦИНЫ Примеры: полисахаридные вакцины против менингококковой инфекции групп А и С (Менинго А+С), гемофилюс инфлюенца
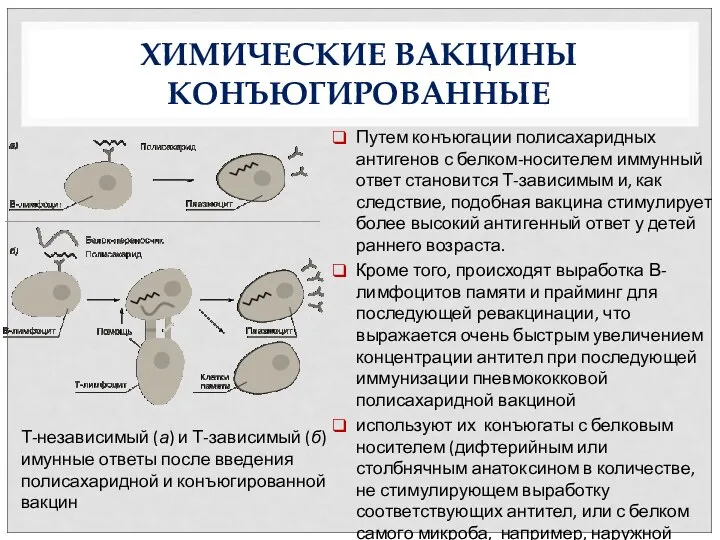
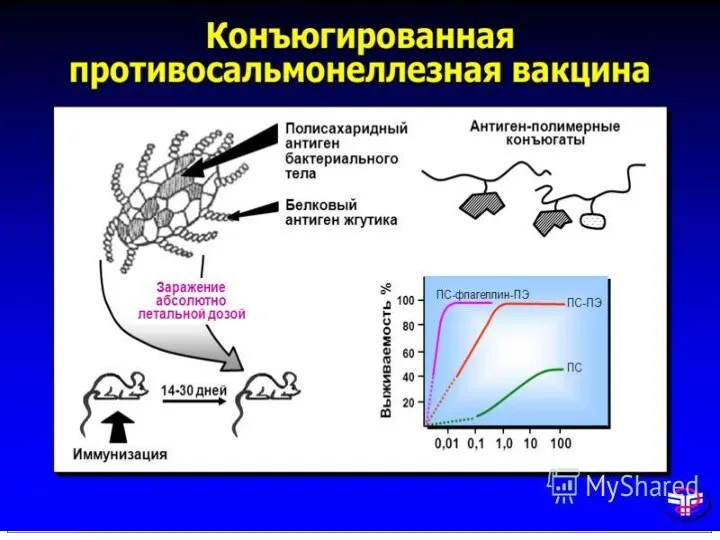
- 37. ХИМИЧЕСКИЕ ВАКЦИНЫ КОНЪЮГИРОВАННЫЕ Путем конъюгации полисахаридных антигенов с белком-носителем иммунный ответ становится Т-зависимым и, как следствие,
- 38. ХИМИЧЕСКИЕ ВАКЦИНЫ МЕНИНГО А+С для профилактики менингококковой инфекции серогрупп А и С содержит очищенные лиофилизированные полисахариды
- 39. ХИМИЧЕСКИЕ ВАКЦИНЫ Тифим Ви - вакцина на основе капсульного Vi-антигена возбудителя брюшного тифа (Vi-вакцины рекомендованы ВОЗ)
- 40. ХИМИЧЕСКИЕ ВАКЦИНЫ -АНАТОКСИНЫ Анатоксины (токсоиды) представляют собой препараты, полученные путем обезвреживания токсинов соответствующих видов возбудителей формалином
- 41. ПРИМЕРЫ: Анатоксины применяются для профилактики и, реже, лечения токсинемических инфекций (дифтерии, газовой гангрены, ботулизма, столбняка, холеры
- 42. ХИМИЧЕСКИЕ ВАКЦИНЫ -АНАТОКСИНЫ Выпускают анатоксины в виде моно- или комбинированных препаратов: анатоксин дифтерийный (очищенный, адсорбированный гидроокисью
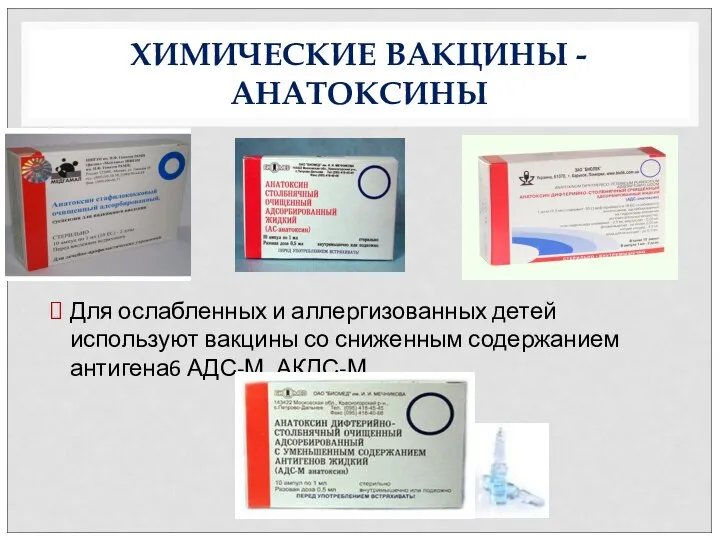
- 43. ХИМИЧЕСКИЕ ВАКЦИНЫ -АНАТОКСИНЫ Для ослабленных и аллергизованных детей используют вакцины со сниженным содержанием антигена6 АДС-М, АКДС-М
- 44. АССОЦИИРОВАННЫЕ ВАКЦИНЫ Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов и позволяющие проводить иммунизацию против нескольких
- 45. АССОЦИИРОВАННЫЕ ВАКЦИНЫ АКДС - адсорбированная коклюшно-дифтерийно-столбнячная вакцина- взвесь убитых коклюшных микробов и очищенных дифтерийного и столбнячного
- 46. АССОЦИИРОВАННЫЕ ВАКЦИНЫ ТетрАкт-ХИБ- адсорбированная вакцина против дифтерии, столбняка, коклюша и гемофильной инфекции типа b (Франция) Состав:
- 47. АССОЦИИРОВАННЫЕ ВАКЦИНЫ Действующие вещества: анатоксин дифтерийный; анатоксин столбнячный; анатоксин коклюшный; гемагглютинин филаментозный; вирус полиомиелита 1-го типа
- 48. АССОЦИИРОВАННЫЕ ВАКЦИНЫ Бубо-кок – комбинированная вакцина для профилктики дифтерии, столбняка, коклюша и гепатита В - представляет
- 49. АССОЦИИРОВАННЫЕ ВАКЦИНЫ Тетракок 05 вакцина для профилактики коклюша, дифтерии, столбняка и полиомиелита (Aventis Pasteur, Франция) Состав:
- 50. АССОЦИИРОВАННЫЕ ВАКЦИНЫ ГЕКСАВАК(Hexavac®) - это комбинированная вакцина для профилактики дифтерии, столбняка, коклюша(бесклеточный компонент), полиомиелита (инактивированная), гепатита
- 51. ХИМИЧЕСКИЕ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ГРИППА
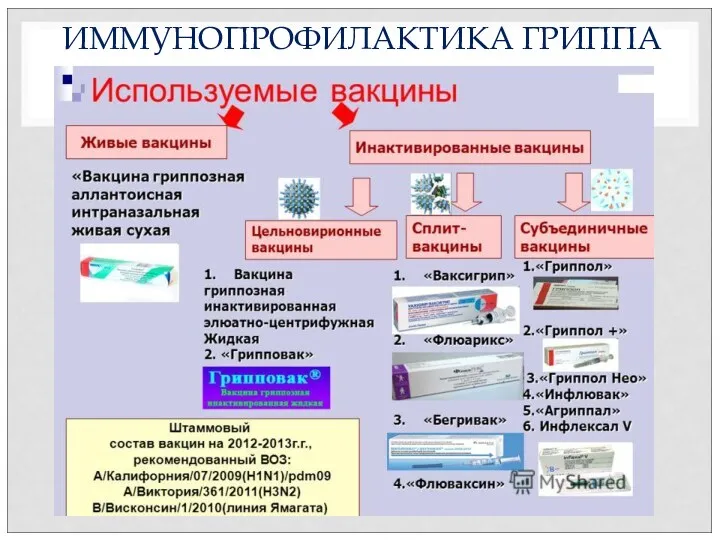
- 52. ИММУНОПРОФИЛАКТИКА ГРИППА
- 53. ФОРСИФИЦИРОВАННЫЕ ВАКЦИНЫ Вакцины нового поколения, полученные путем химического ковалентного связывания (конъюгация) иммуномодуляторов с иммунизирующими антигенами, входящими
- 54. ФОРСИФИЦИРОВАННЫЕ ВАКЦИНЫ Использование иммуномодулирующих препаратов в вакцинопрофилактике, в первую очередь, диктуется необходимостью уменьшения дозы вводимого антигена.
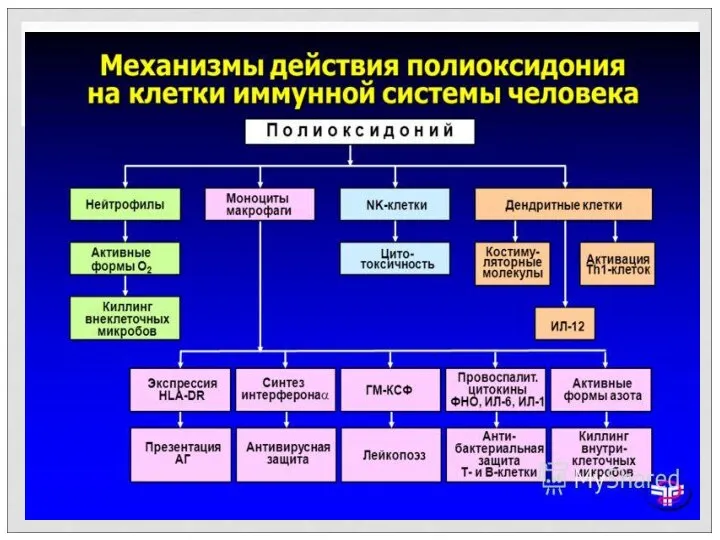
- 56. ФОРСИФИЦИРОВАННЫЕ ВАКЦИНЫ Полиоскидоний, а также ликопид, миелопид (МП-3) относятся к препаратам, оказывающим преимущественное воздействие на клетки
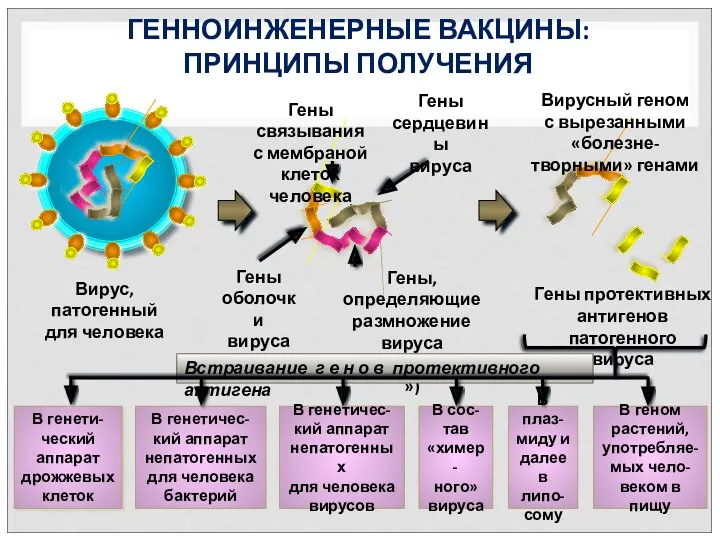
- 59. ГЕННОИНЖЕНЕРНЫЕ ВАКЦИНЫ: ПРИНЦИПЫ ПОЛУЧЕНИЯ Вирус, патогенный для человека Гены связывания с мембраной клеток человека Гены сердцевины
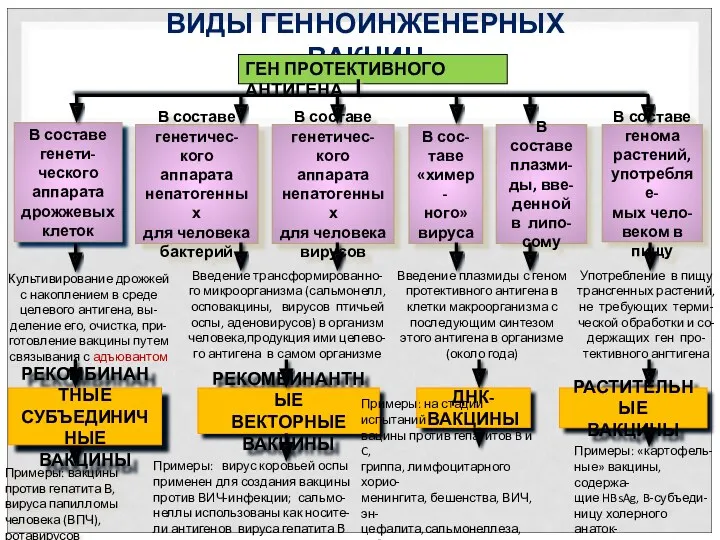
- 60. РАСТИТЕЛЬНЫЕ ВАКЦИНЫ ДНК-ВАКЦИНЫ РЕКОМБИНАНТНЫЕ ВЕКТОРНЫЕ ВАКЦИНЫ РЕКОМБИНАНТНЫЕ СУБЪЕДИНИЧНЫЕ ВАКЦИНЫ ВИДЫ ГЕННОИНЖЕНЕРНЫХ ВАКЦИН ГЕН ПРОТЕКТИВНОГО АНТИГЕНА В
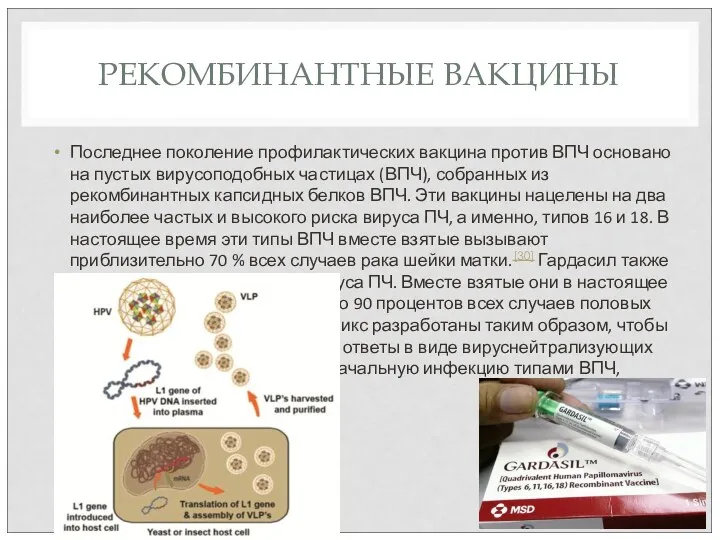
- 61. РЕКОМБИНАНТНЫЕ ВАКЦИНЫ Последнее поколение профилактических вакцина против ВПЧ основано на пустых вирусоподобных частицах (ВПЧ), собранных из
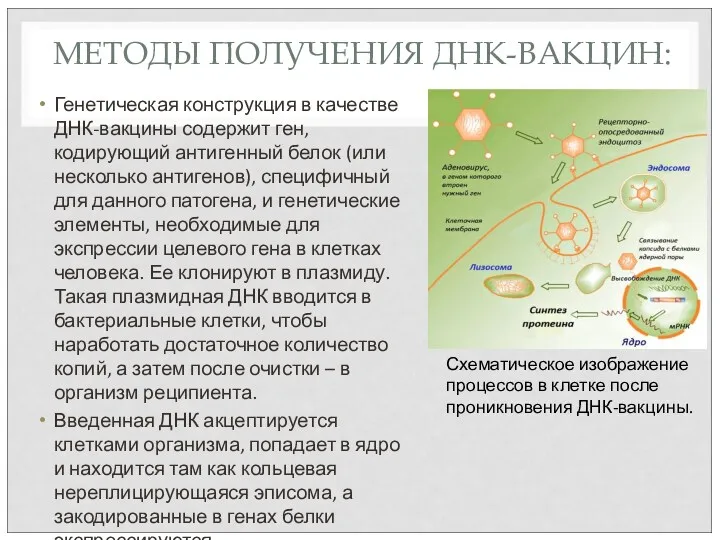
- 62. МЕТОДЫ ПОЛУЧЕНИЯ ДНК-ВАКЦИН: Генетическая конструкция в качестве ДНК-вакцины содержит ген, кодирующий антигенный белок (или несколько антигенов),
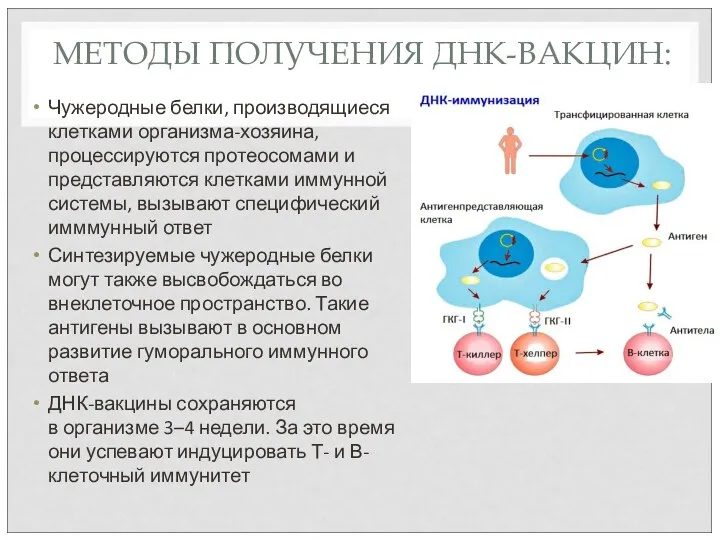
- 63. МЕТОДЫ ПОЛУЧЕНИЯ ДНК-ВАКЦИН: Чужеродные белки, производящиеся клетками организма-хозяина, процессируются протеосомами и представляются клетками иммунной системы, вызывают
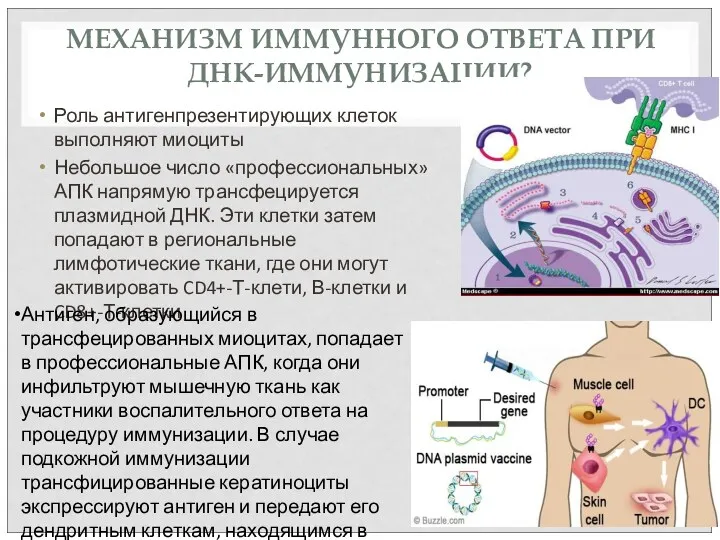
- 64. МЕХАНИЗМ ИММУННОГО ОТВЕТА ПРИ ДНК-ИММУНИЗАЦИИ? Роль антигенпрезентирующих клеток выполняют миоциты Небольшое число «профессиональных» АПК напрямую трансфецируется
- 65. Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная
- 66. СПОСОБЫ ВВЕДЕНИЯ ДНК-ВАКЦИН Парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно).
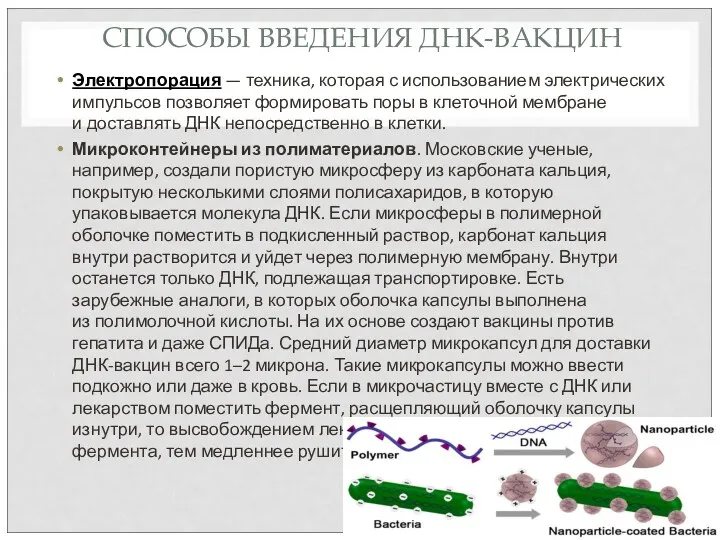
- 67. СПОСОБЫ ВВЕДЕНИЯ ДНК-ВАКЦИН Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной
- 68. СПОСОБЫ ВВЕДЕНИЯ ДНК-ВАКЦИН Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых
- 69. Система доставки ДНК с помощью «теней» — неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих
- 70. СОВРЕМЕННОЕ СОСТОЯНИЕ ДНК-ВАКЦИНОЛОГИИ В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии
- 71. ДЕНДРИТНЫЕ ВАКЦИНЫ. Особенности ДК, позволяющие им захватывать и представлять АГ более эффективно по сравнению с другими
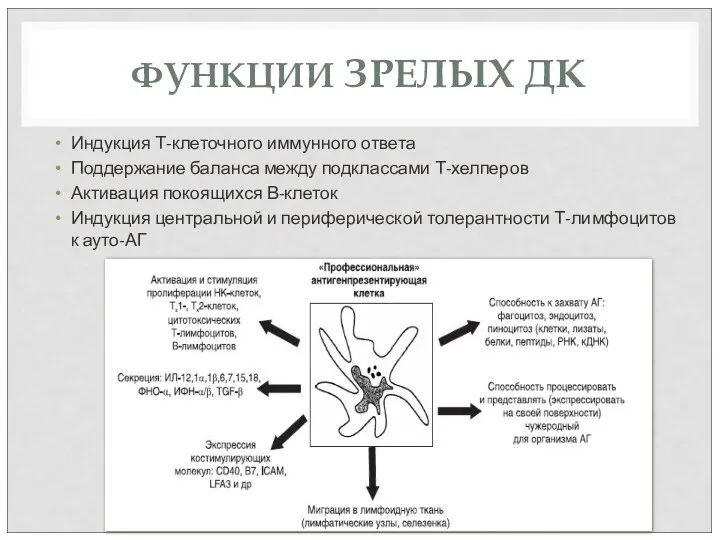
- 72. ФУНКЦИИ ЗРЕЛЫХ ДК Индукция Т-клеточного иммунного ответа Поддержание баланса между подклассами Т-хелперов Активация покоящихся В-клеток Индукция
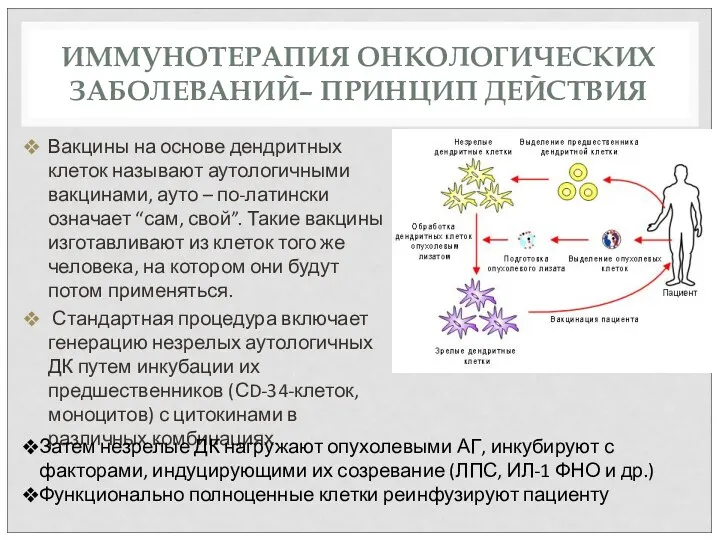
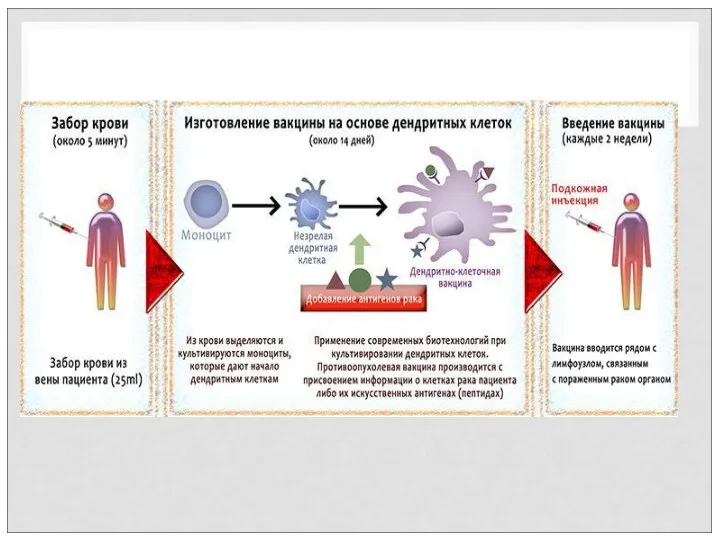
- 73. ИММУНОТЕРАПИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ– ПРИНЦИП ДЕЙСТВИЯ Вакцины на основе дендритных клеток называют аутологичными вакцинами, ауто – по-латински
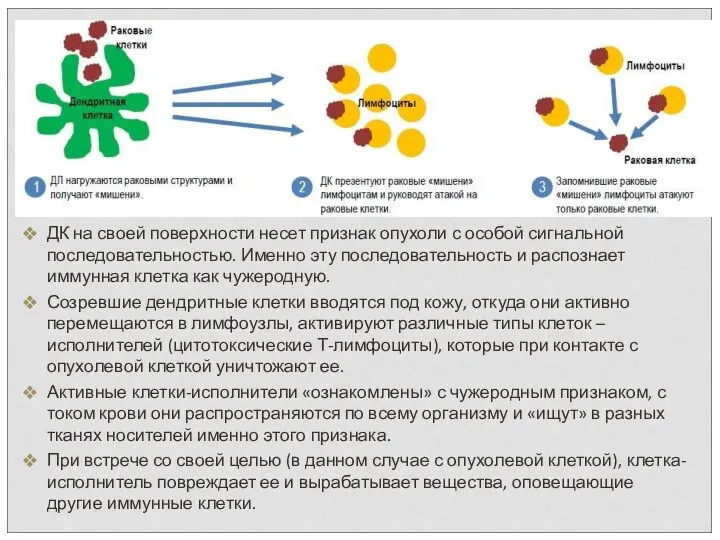
- 75. ДК на своей поверхности несет признак опухоли с особой сигнальной последовательностью. Именно эту последовательность и распознает
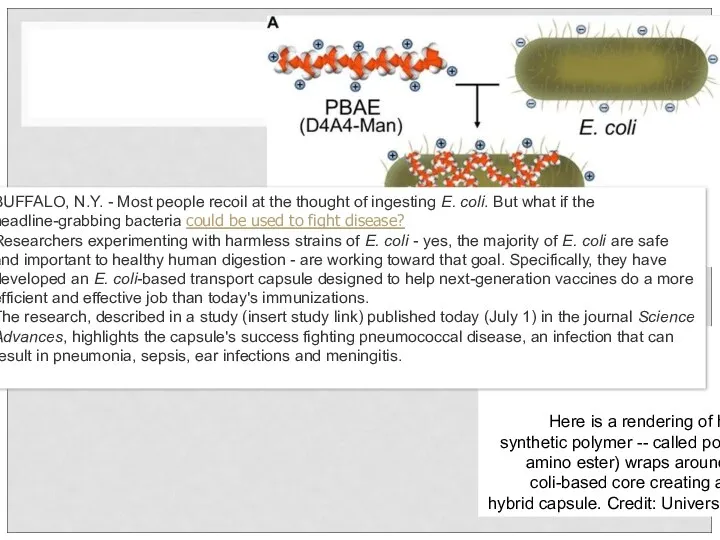
- 76. BUFFALO, N.Y. - Most people recoil at the thought of ingesting E. coli. But what if
- 77. It's a bit counterintuitive given what you here about E. coli, but there are many strains
- 78. Sci Adv. 2016 Jul; 2(7): e1600264. Published online 2016 Jul 1. doi: 10.1126/sciadv.1600264 PMCID: PMC4942325 In
- 79. In particular, this study features a hybrid antigen delivery vector composed of biological and biomaterial components,
- 80. pneumococcal surface protein A (PspA)
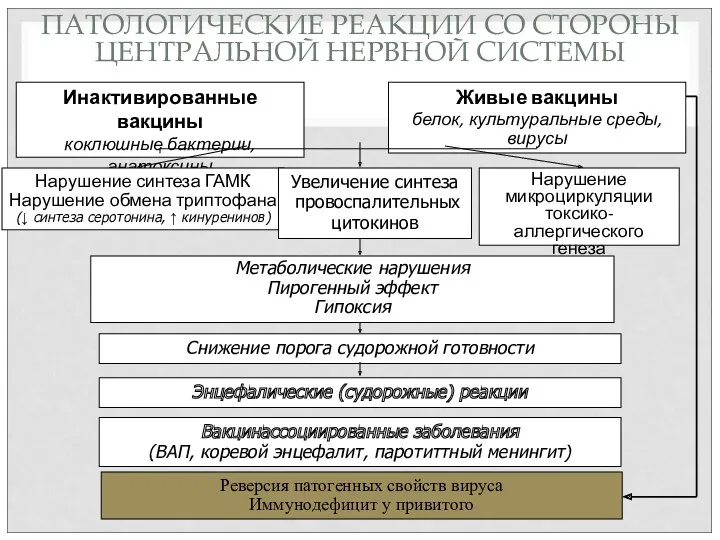
- 86. ПАТОЛОГИЧЕСКИЕ РЕАКЦИИ СО СТОРОНЫ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ Инактивированные вакцины коклюшные бактерии, анатоксины Живые вакцины белок, культуральные
- 87. ЗАБОЛЕВАНИЯ В ПОСТВАКЦИНАЛЬНОМ ПЕРИОДЕ, ПОДЛЕЖАЩИЕ РЕГИСТРАЦИИ И ПОСЛЕДУЮЩЕМУ РАССЛЕДОВАНИЮ
- 88. ПЕРЕЧЕНЬ МЕДИЦИНСКИХ ПРОТИВОПОКАЗАНИЙ К ПРОВЕДЕНИЮ ПРОФИЛАКТИЧЕСКИХ ПРИВИВОК
- 91. Скачать презентацию



























































 Патологиялық анатомия
Патологиялық анатомия Оба қоздырғышы
Оба қоздырғышы Microscopic colitis
Microscopic colitis Сосудистые анастомозы РУС
Сосудистые анастомозы РУС Нарушение половых функций. Климакс
Нарушение половых функций. Климакс Мeningeal a syndrome in clinic of infectious diseases
Мeningeal a syndrome in clinic of infectious diseases Медсестринський процес – історичний нарис. Професійні організації медичних сестер
Медсестринський процес – історичний нарис. Професійні організації медичних сестер Оксигенотерапия. Виды оксигенотерапии
Оксигенотерапия. Виды оксигенотерапии Потребность в нормальном дыхании
Потребность в нормальном дыхании Cardiovascular system
Cardiovascular system Первая помощь детям при травмах и несчастных случаях. Общие советы для детей и взрослых
Первая помощь детям при травмах и несчастных случаях. Общие советы для детей и взрослых Медикаментозды остеопороз: алдын алудағы және түзетуге негізгі ұстанымдар
Медикаментозды остеопороз: алдын алудағы және түзетуге негізгі ұстанымдар Первая помощь при отморожении, общем охлаждении организма
Первая помощь при отморожении, общем охлаждении организма Обследование зубных рядов, зубов и периодонта в детском возрасте
Обследование зубных рядов, зубов и периодонта в детском возрасте Терапиялық стоматология клиникасындағы ауру сезімі және жансыздандыру
Терапиялық стоматология клиникасындағы ауру сезімі және жансыздандыру Общие вопросы лучевой диагностики. Ультразвуковое исследование
Общие вопросы лучевой диагностики. Ультразвуковое исследование Концепция обеспечения качества лекарственных средств
Концепция обеспечения качества лекарственных средств Клиническая симптоматология рака и абсцесса легких. Синдром полости в легком. (Тема 21)
Клиническая симптоматология рака и абсцесса легких. Синдром полости в легком. (Тема 21) Острая почечная и острая печеночная недостаточность
Острая почечная и острая печеночная недостаточность Ранний детский аутизм
Ранний детский аутизм Технические регламенты и национальные стандарты оказания оздоровительных услуг гостиничными организациями. (Лекция 6.1)
Технические регламенты и национальные стандарты оказания оздоровительных услуг гостиничными организациями. (Лекция 6.1) Уход за больными хирургического профиля
Уход за больными хирургического профиля Требования к организации и проведению профилактической дератизации и дезинсекции
Требования к организации и проведению профилактической дератизации и дезинсекции Периферические венозные катетеры
Периферические венозные катетеры Ортаңғы және ішкі құлақ аурулары. Саңыраулық және мылқаулық орта кұлактың жедел және созылмалы кабынуы мастоидит
Ортаңғы және ішкі құлақ аурулары. Саңыраулық және мылқаулық орта кұлактың жедел және созылмалы кабынуы мастоидит Нейропротезирование. История нейропротезирования
Нейропротезирование. История нейропротезирования Синдромы при заболеваниях дыхательной системы
Синдромы при заболеваниях дыхательной системы Первая медицинская помощь
Первая медицинская помощь