Содержание
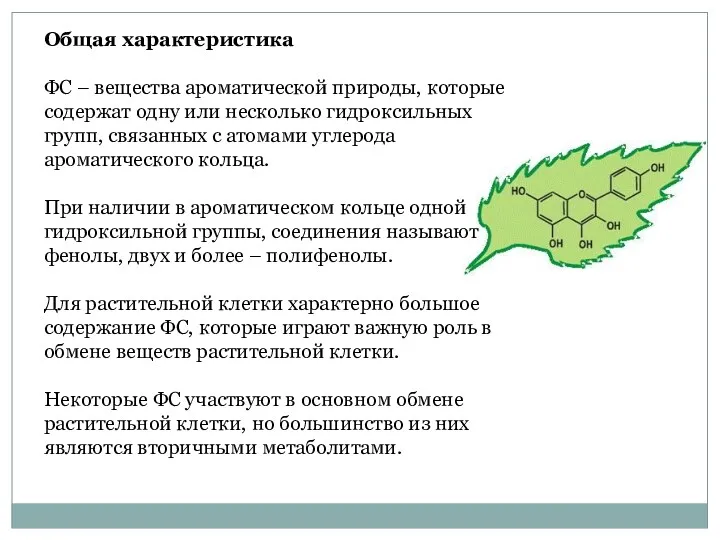
- 2. Общая характеристика ФС – вещества ароматической природы, которые содержат одну или несколько гидроксильных групп, связанных с
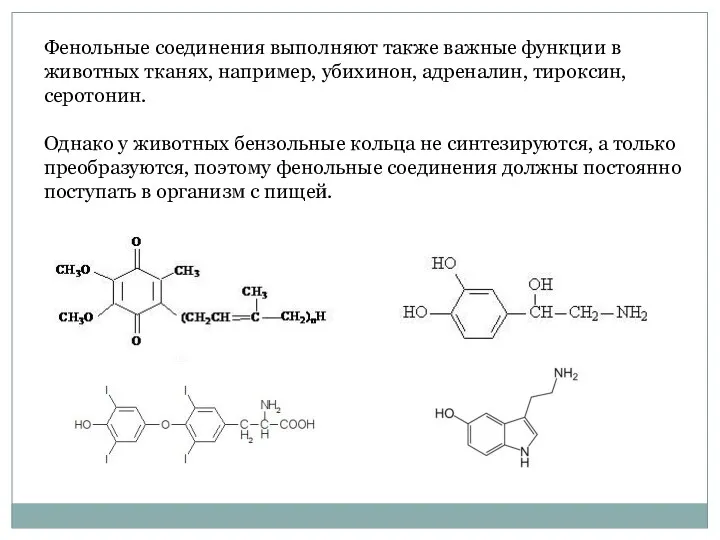
- 3. Фенольные соединения выполняют также важные функции в животных тканях, например, убихинон, адреналин, тироксин, серотонин. Однако у
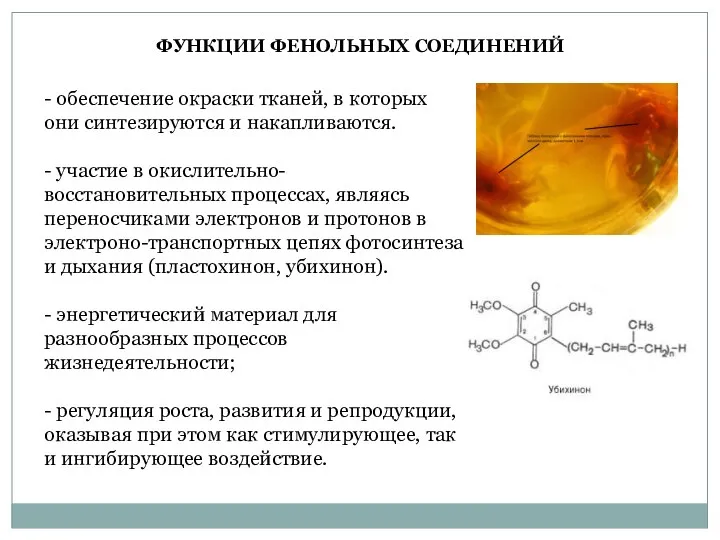
- 4. - обеспечение окраски тканей, в которых они синтезируются и накапливаются. - участие в окислительно-восстановительных процессах, являясь
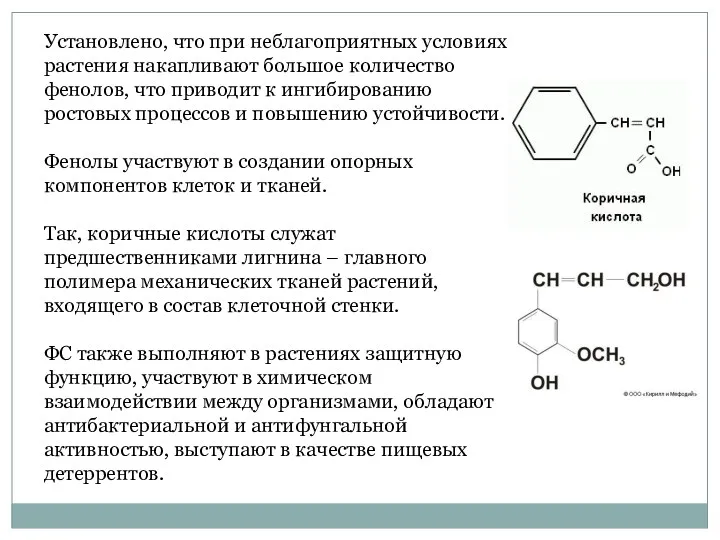
- 5. Установлено, что при неблагоприятных условиях растения накапливают большое количество фенолов, что приводит к ингибированию ростовых процессов
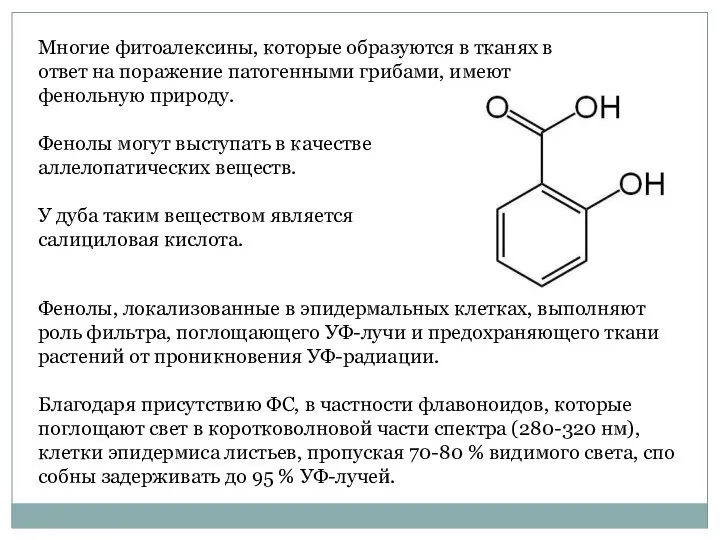
- 6. Многие фитоалексины, которые образуются в тканях в ответ на поражение патогенными грибами, имеют фенольную природу. Фенолы
- 7. Большая часть УФ-излучения поглощается поверхностными клетками, и лишь незначительная часть поступает вглубь тканей, поэтому у некоторых
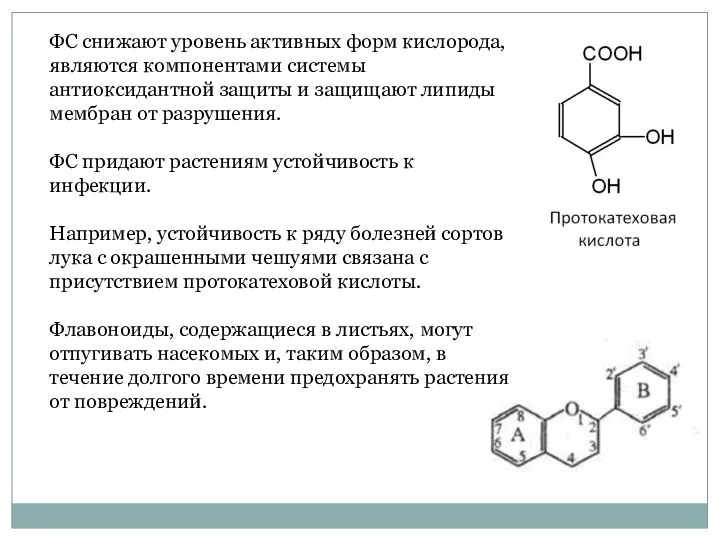
- 8. ФС снижают уровень активных форм кислорода, являются компонентами системы антиоксидантной защиты и защищают липиды мембран от
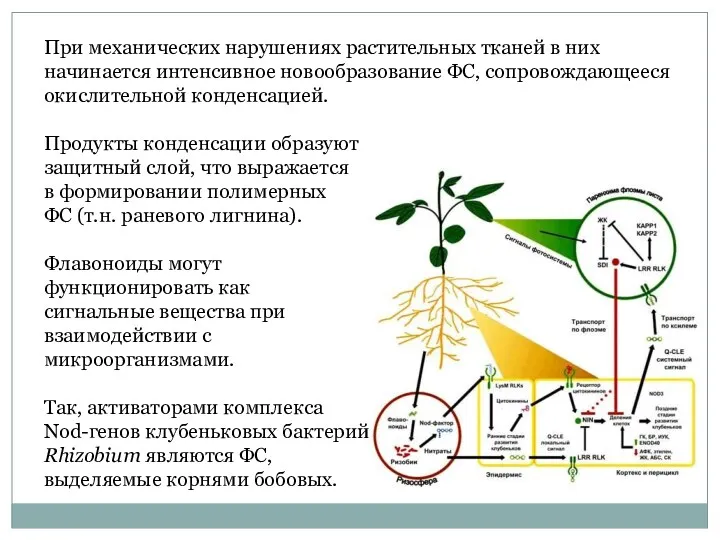
- 9. При механических нарушениях растительных тканей в них начинается интенсивное новообразование ФС, сопровождающееся окислительной конденсацией. Продукты конденсации
- 10. Обладая слабыми кислотными свойствами, они способны образовывать со щелочами феноляты. Как правило, ФС представляют собой кристаллы
- 11. Фенолы способны давать окрашенные комплексы с ионами тяжелых металлов. Соли свинца образуют с флавоноидами желтые или
- 12. Помимо окрашивания с солями металлов ФС вступают в реакции сочетания с диазониевыми соединениями, образуя продукты с
- 13. Более активные сорбенты (окись алюминия, активированный уголь и т.п.) при работе с ФС не используются из-за
- 14. Для исследования тонкой структуры флавоноидных соединений применяются и другие физико-химические методы анализа, в частности, метод ЯМР.
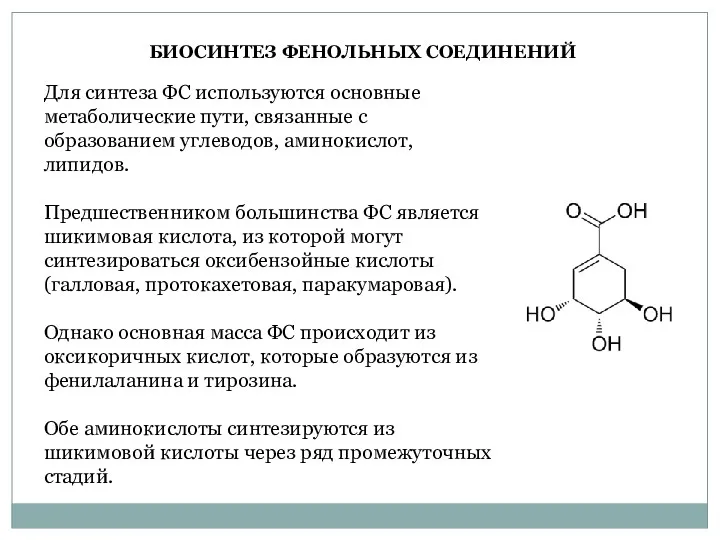
- 15. Для синтеза ФС используются основные метаболические пути, связанные с образованием углеводов, аминокислот, липидов. Предшественником большинства ФС
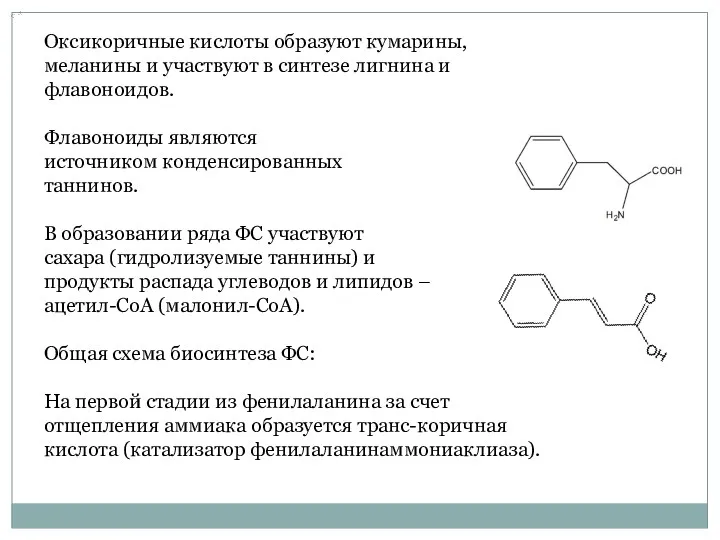
- 16. Оксикоричные кислоты образуют кумарины, меланины и участвуют в синтезе лигнина и флавоноидов. Флавоноиды являются источником конденсированных
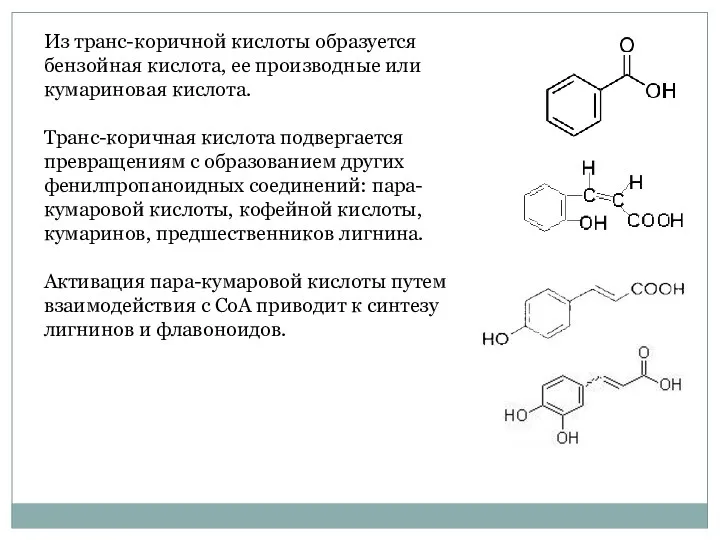
- 17. Из транс-коричной кислоты образуется бензойная кислота, ее производные или кумариновая кислота. Транс-коричная кислота подвергается превращениям с
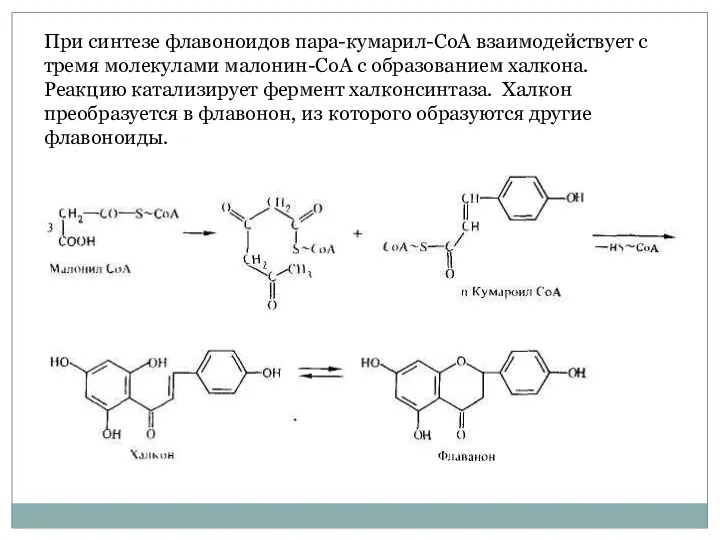
- 18. При синтезе флавоноидов пара-кумарил-СоА взаимодействует с тремя молекулами малонин-СоА с образованием халкона. Реакцию катализирует фермент халконсинтаза.
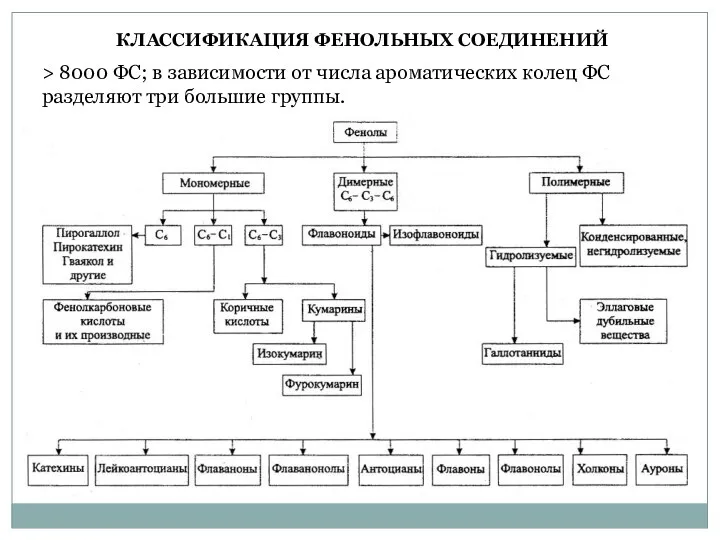
- 19. > 8000 ФС; в зависимости от числа ароматических колец ФС разделяют три большие группы. КЛАССИФИКАЦИЯ ФЕНОЛЬНЫХ
- 20. 9 групп: 1. Соединения С6-ряда не содержат дополнительных атомов углерода – простые фенолы. 2. Соединения С6-С1-ряда
- 21. 6. Соединения С6-С1-С6-ряда содержат два ароматических кольца, соединенных мостиком из одного углеродного атома, – бензофеноны и
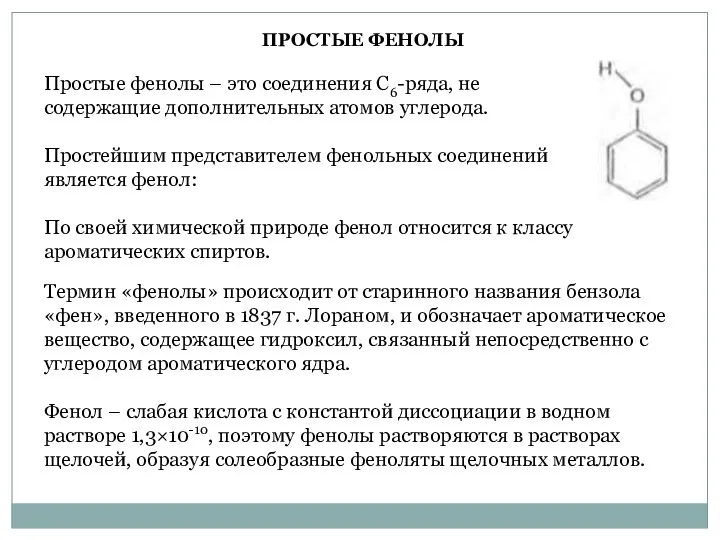
- 22. Простые фенолы – это соединения С6-ряда, не содержащие дополнительных атомов углерода. Простейшим представителем фенольных соединений является
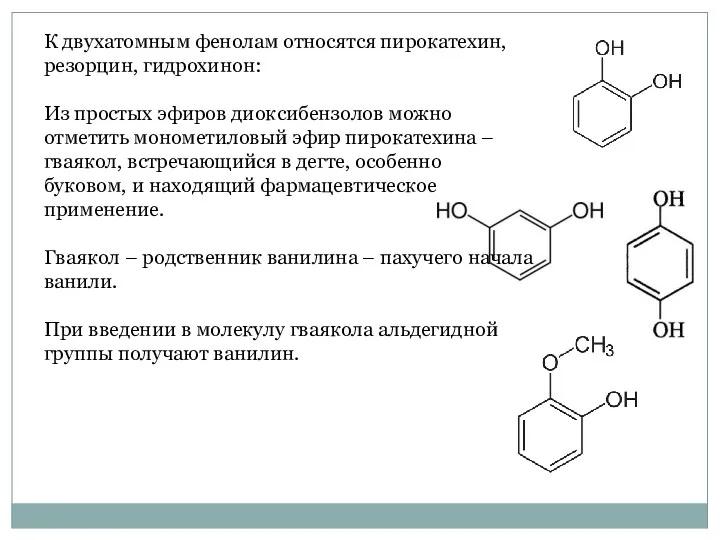
- 23. К двухатомным фенолам относятся пирокатехин, резорцин, гидрохинон: Из простых эфиров диоксибензолов можно отметить монометиловый эфир пирокатехина
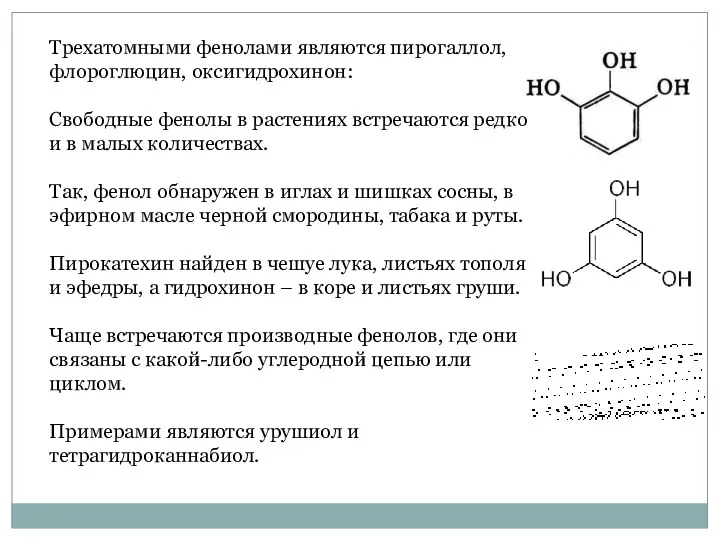
- 24. Трехатомными фенолами являются пирогаллол, флороглюцин, оксигидрохинон: Свободные фенолы в растениях встречаются редко и в малых количествах.
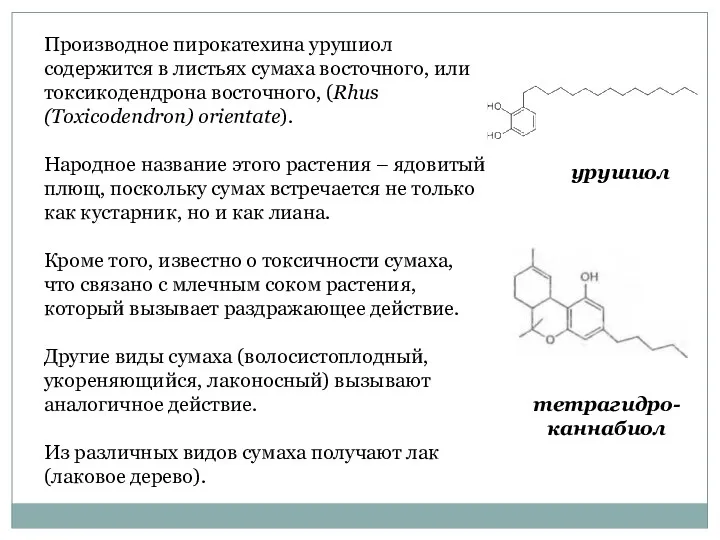
- 25. Производное пирокатехина урушиол содержится в листьях сумаха восточного, или токсикодендрона восточного, (Rhus (Toxicodendron) orientate). Народное название
- 26. Контакт с растением вызывает тяжелые дерматиты, причем достаточно 0,001 мл сока, чтобы вызвать интоксикацию. Млечный сок
- 27. С давних пор коноплю посевную (С. sativa) и коноплю индийскую (С. indica) использовали как лекарственные растения.
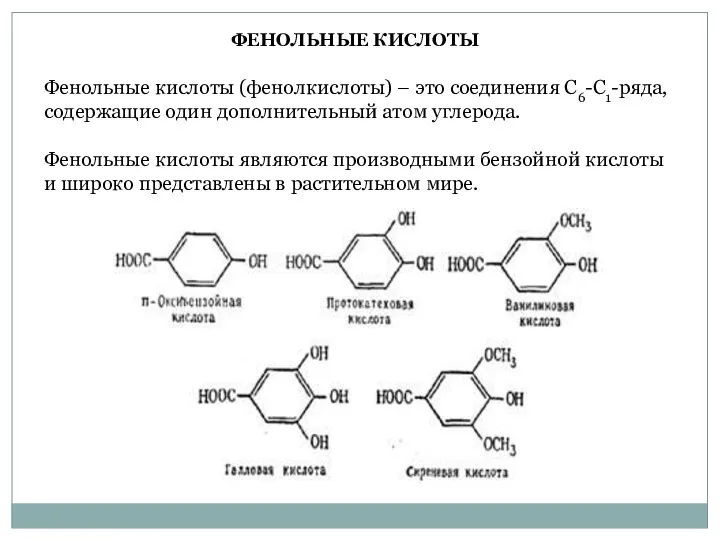
- 28. Фенольные кислоты (фенолкислоты) – это соединения С6-С1-ряда, содержащие один дополнительный атом углерода. Фенольные кислоты являются производными
- 29. Такие соединения как протокатеховая, n-оксибензойная, ванилиновая и галловая кислоты обнаружены практически у всех покрытосеменных растений. Чаще
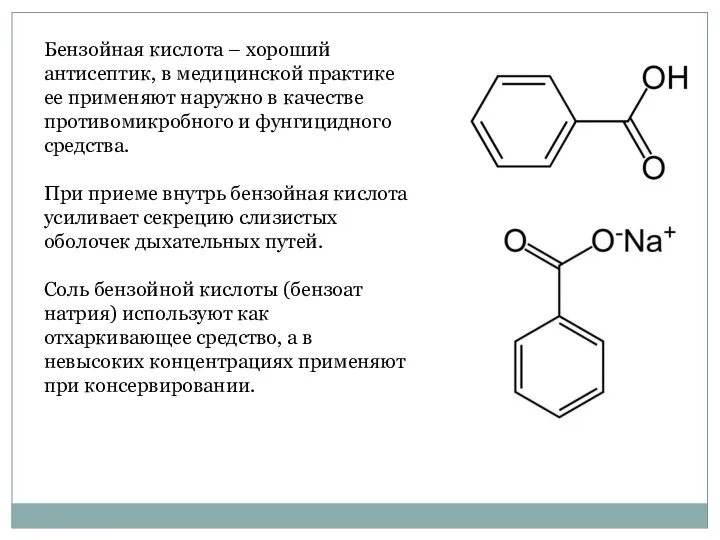
- 30. Бензойная кислота – хороший антисептик, в медицинской практике ее применяют наружно в качестве противомикробного и фунгицидного
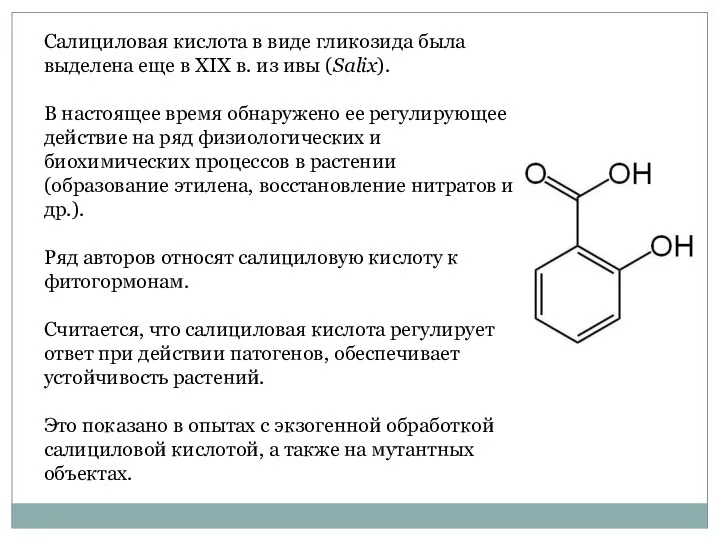
- 32. Салициловая кислота в виде гликозида была выделена еще в XIX в. из ивы (Salix). В настоящее
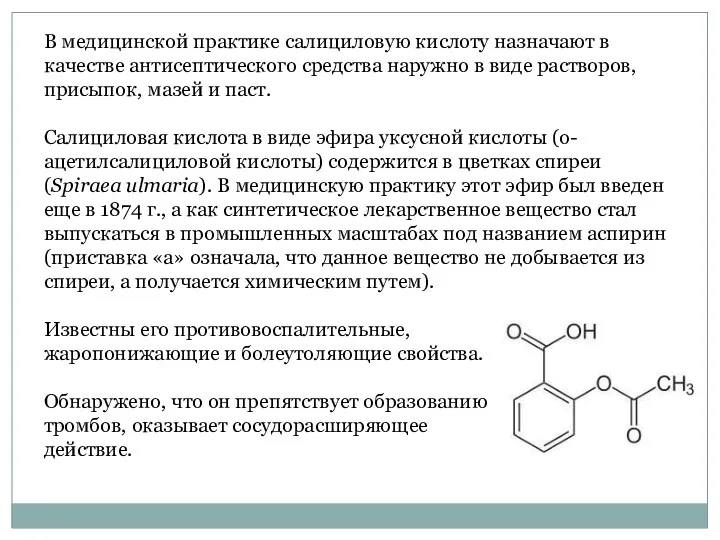
- 33. В медицинской практике салициловую кислоту назначают в качестве антисептического средства наружно в виде растворов, присыпок, мазей
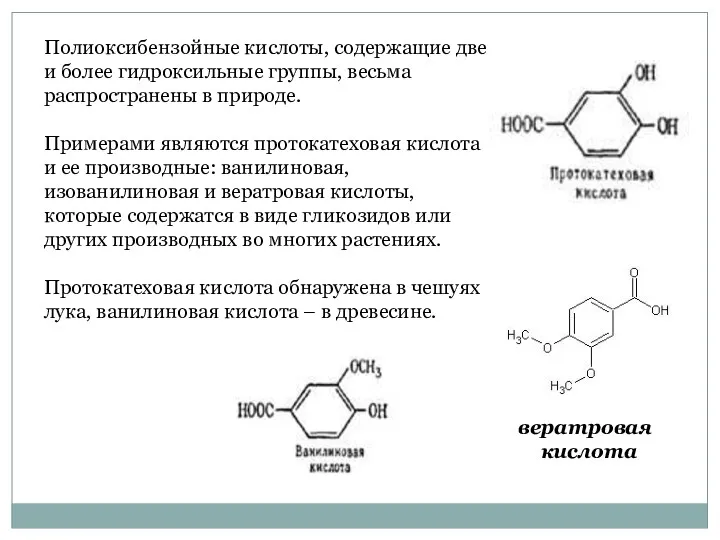
- 34. Полиоксибензойные кислоты, содержащие две и более гидроксильные группы, весьма распространены в природе. Примерами являются протокатеховая кислота
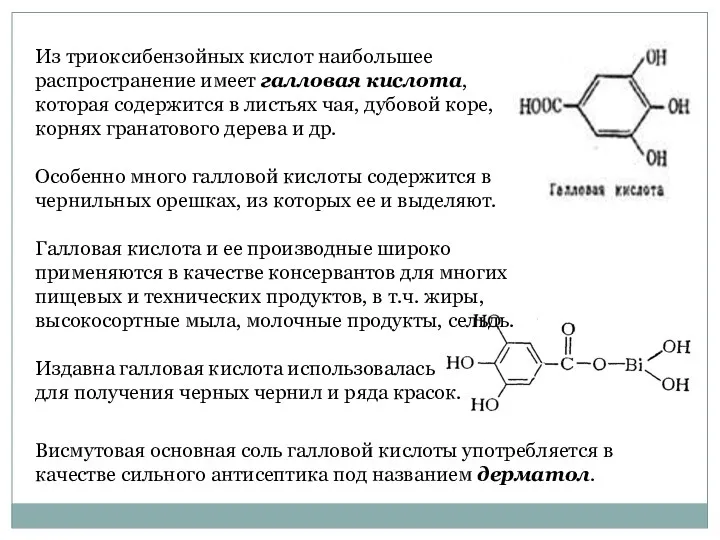
- 35. Из триоксибензойных кислот наибольшее распространение имеет галловая кислота, которая содержится в листьях чая, дубовой коре, корнях
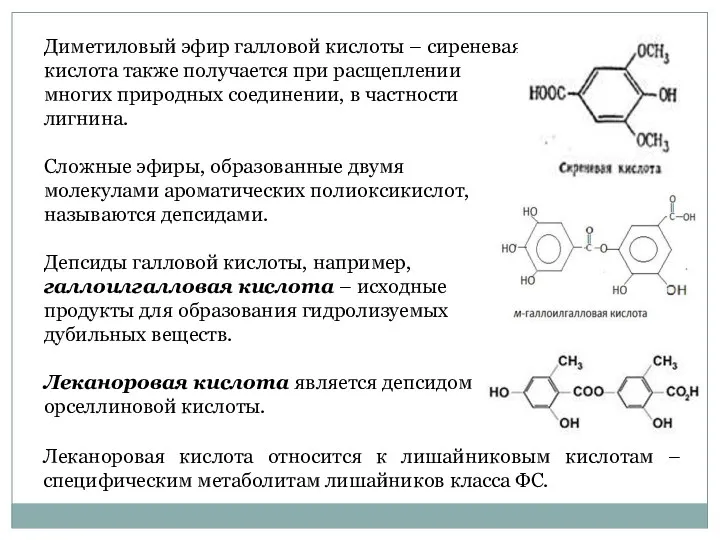
- 36. Диметиловый эфир галловой кислоты – сиреневая кислота также получается при расщеплении многих природных соединении, в частности
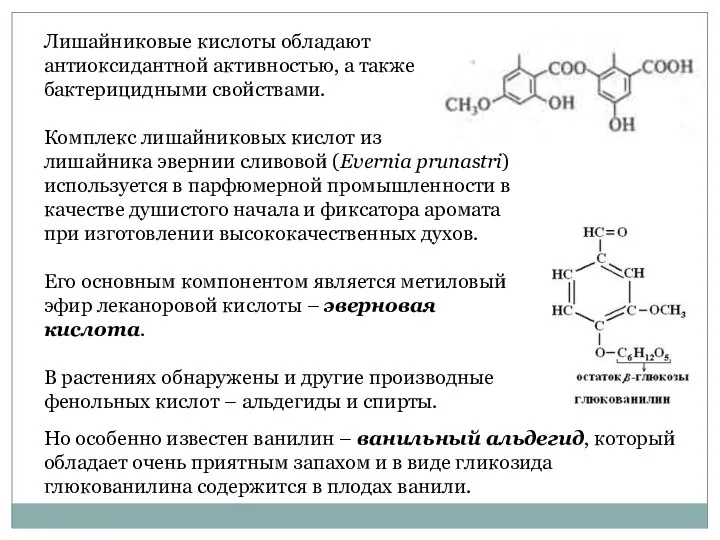
- 37. Лишайниковые кислоты обладают антиоксидантной активностью, а также бактерицидными свойствами. Комплекс лишайниковых кислот из лишайника эвернии сливовой
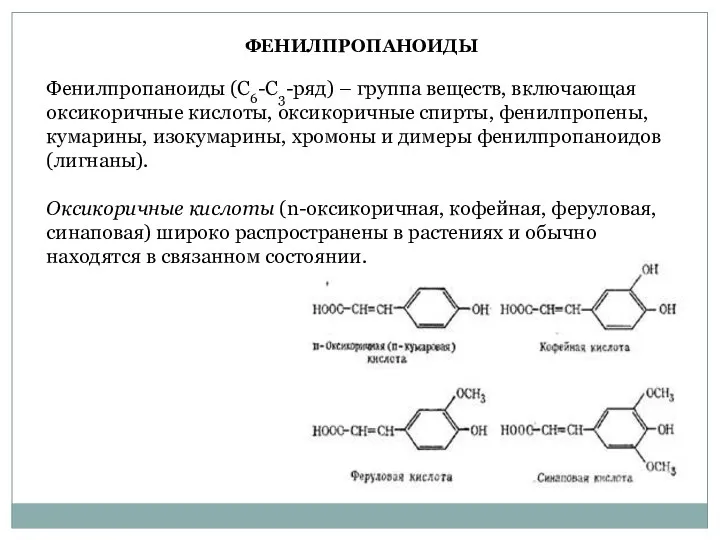
- 38. Фенилпропаноиды (С6-С3-ряд) – группа веществ, включающая оксикоричные кислоты, оксикоричные спирты, фенилпропены, кумарины, изокумарины, хромоны и димеры
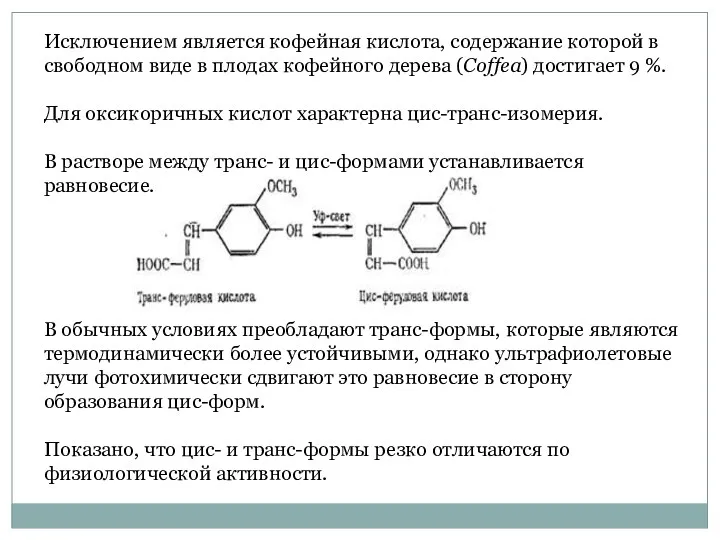
- 39. Исключением является кофейная кислота, содержание которой в свободном виде в плодах кофейного дерева (Coffea) достигает 9
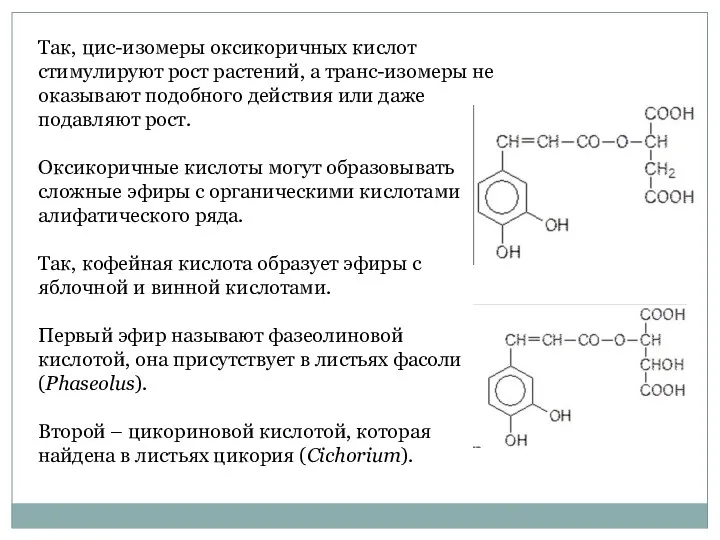
- 40. Так, цис-изомеры оксикоричных кислот стимулируют рост растений, а транс-изомеры не оказывают подобного действия или даже подавляют
- 41. Кофейная кислота часто образует димеры с алициклическими кислотами – хинной и шикимовой. Наиболее известна хлорогеновая (3-кофеилхинная)
- 42. Оксикоричные кислоты входят в состав полисахаридов и белков. Например, феруловая кислота найдена в ксиланах пшеничной муки
- 43. Кумарин – бесцветное кристаллическое вещество с приятным запахом свежескошенного сена. В растениях обычно присутствует не сам
- 44. Кумарин в настоящее время используют также в качестве отдушки для туалетного мыла, в косметике и как
- 45. В траве донника желтого (M. officinalis) и донника высокого (M. altissimus) обнаруживается до 0,4 % кумарина,
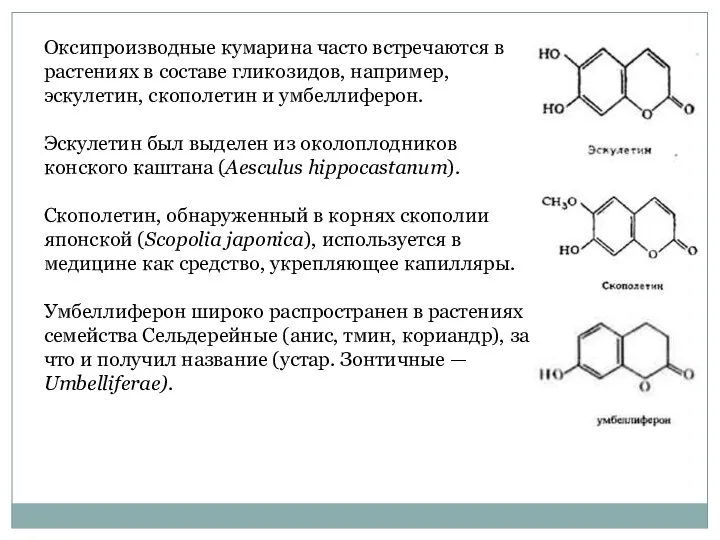
- 46. Оксипроизводные кумарина часто встречаются в растениях в составе гликозидов, например, эскулетин, скополетин и умбеллиферон. Эскулетин был
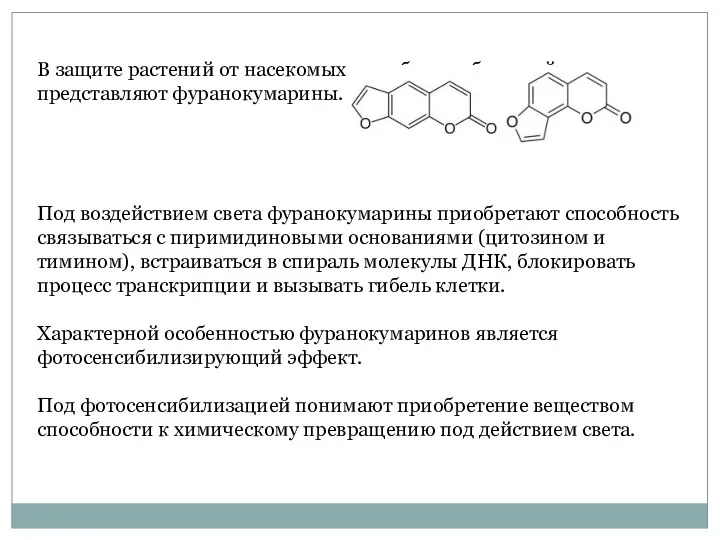
- 47. В защите растений от насекомых и грибов наибольший интерес представляют фуранокумарины. Под воздействием света фуранокумарины приобретают
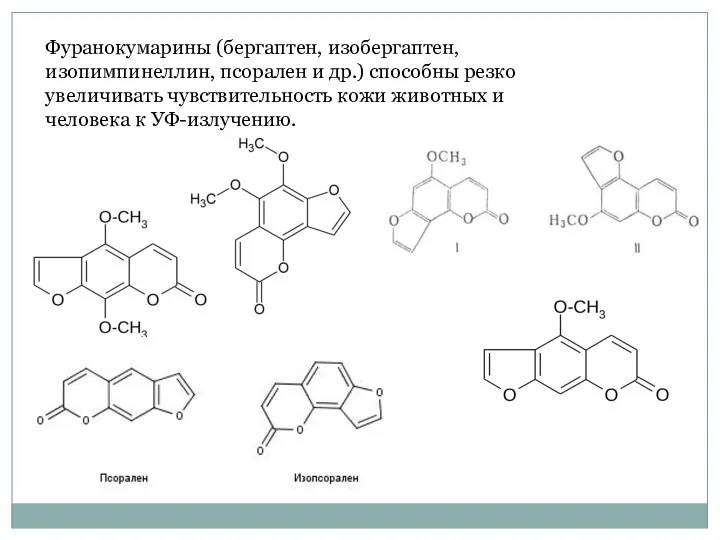
- 48. Фуранокумарины (бергаптен, изобергаптен, изопимпинеллин, псорален и др.) способны резко увеличивать чувствительность кожи животных и человека к
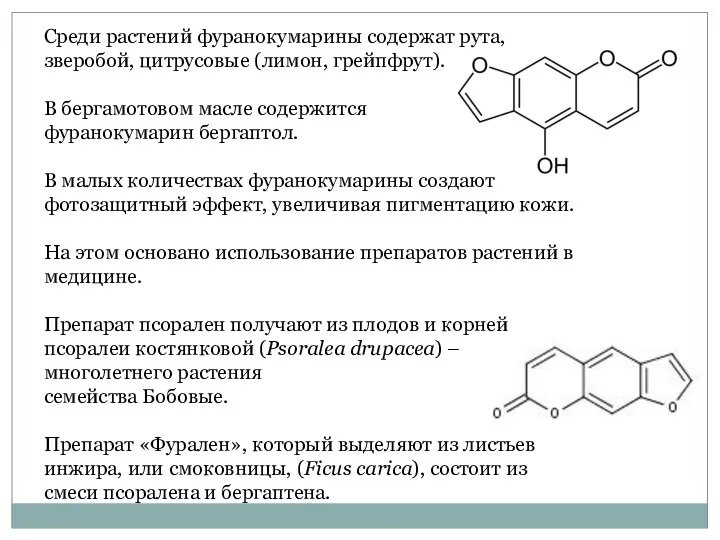
- 49. Среди растений фуранокумарины содержат рута, зверобой, цитрусовые (лимон, грейпфрут). В бергамотовом масле содержится фуранокумарин бергаптол. В
- 50. В высушенных листьях инжира обнаружено 0,28-0,49 % псоралена и 0,03-0,1 % бергаптена, а в дикорастущих формах
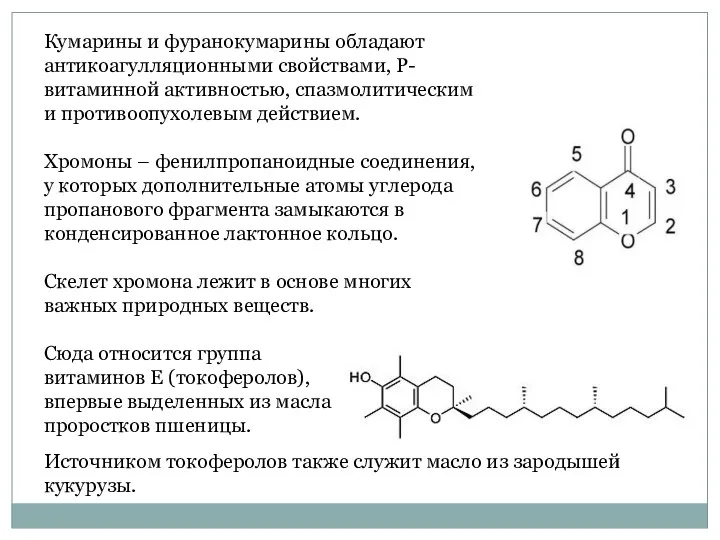
- 51. Кумарины и фуранокумарины обладают антикоагулляционными свойствами, Р-витаминной активностью, спазмолитическим и противоопухолевым действием. Хромоны – фенилпропаноидные соединения,
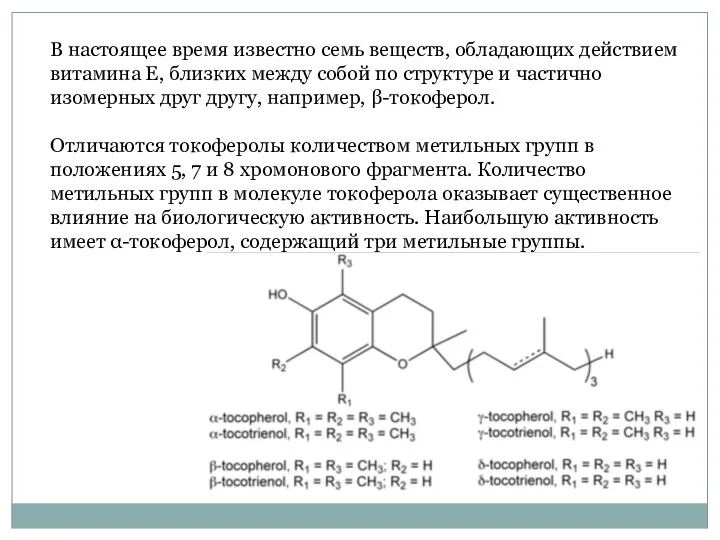
- 52. В настоящее время известно семь веществ, обладающих действием витамина Е, близких между собой по структуре и
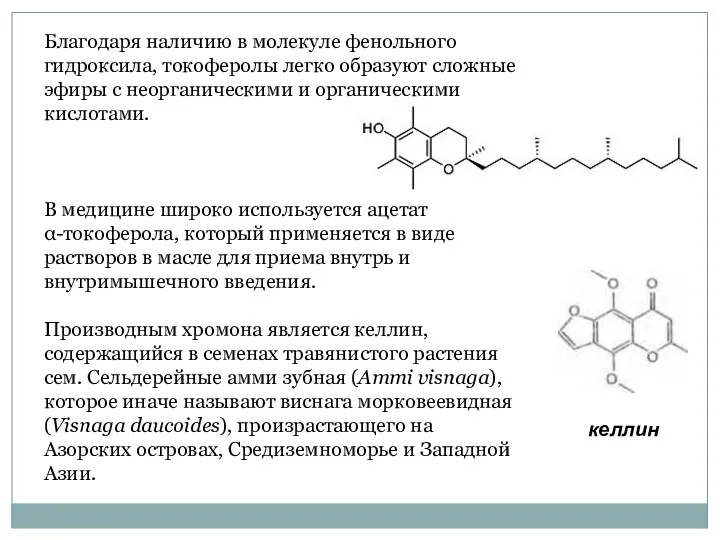
- 53. Благодаря наличию в молекуле фенольного гидроксила, токоферолы легко образуют сложные эфиры с неорганическими и органическими кислотами.
- 54. Уже в Древнем Египте это растениe использовалось при различных судорогах и спазмах. В Центральной Европе амми
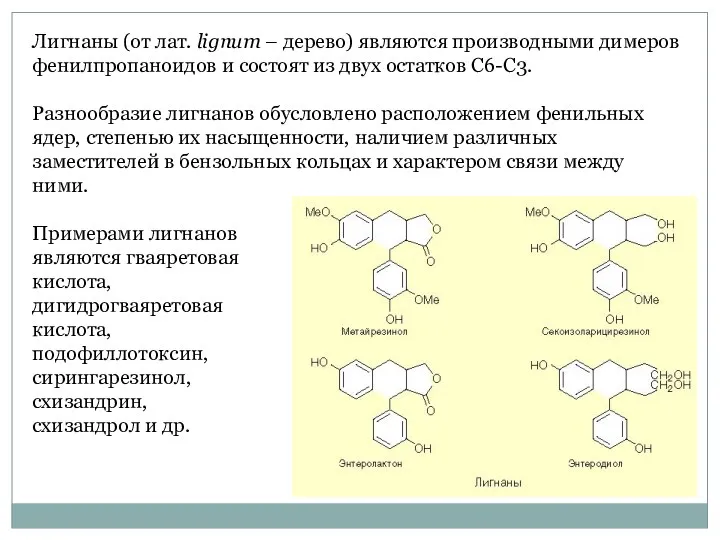
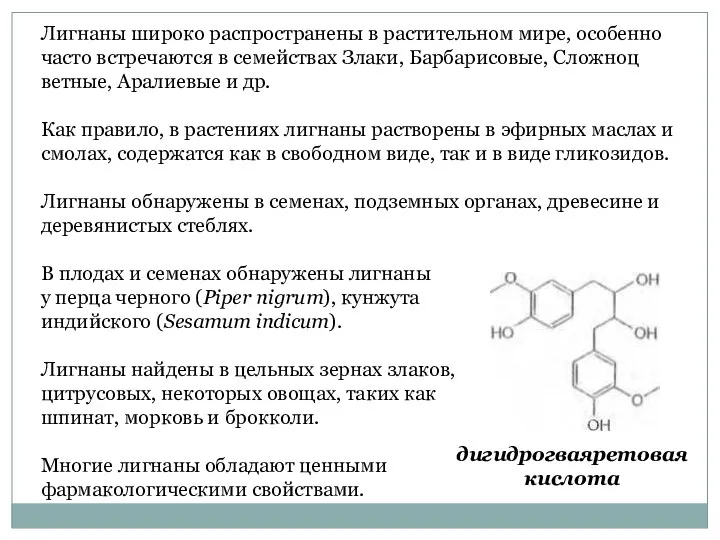
- 55. Лигнаны (от лат. lignum – дерево) являются производными димеров фенилпропаноидов и состоят из двух остатков С6-С3.
- 56. Лигнаны широко распространены в растительном мире, особенно часто встречаются в семействах Злаки, Барбарисовые, Сложноцветные, Аралиевые и
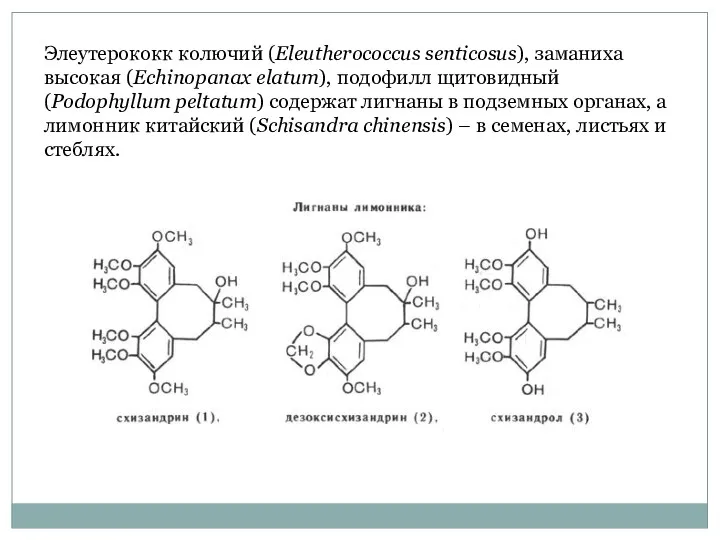
- 57. Элеутерококк колючий (Eleutherococcus senticosus), заманиха высокая (Echinopanax elatum), подофилл щитовидный (Podophyllum peltatum) содержат лигнаны в подземных
- 58. Из корневищ подофилла щитовидного (Podophyllum peltatum) – многолетнего травянистого растения семейства Барбарисовые получают смолу подофиллин, в
- 60. Скачать презентацию



















 Науқасқа және оның жанұясына қайғылы хабарды жеткізу
Науқасқа және оның жанұясына қайғылы хабарды жеткізу Вирусы. Возбудитель кровяных и трансмиссивных инфекций
Вирусы. Возбудитель кровяных и трансмиссивных инфекций Қан жүйесі туралы түсінік. Қанның қорғаныстық қызметі. Қан топтары
Қан жүйесі туралы түсінік. Қанның қорғаныстық қызметі. Қан топтары Хирургические инфекции
Хирургические инфекции Помощь при солнечном ударе и укусах
Помощь при солнечном ударе и укусах Хроническая болезнь почек
Хроническая болезнь почек Итоги деятельности службы медицинской профилактики за 2018 год, приоритетные направления на 2019 год
Итоги деятельности службы медицинской профилактики за 2018 год, приоритетные направления на 2019 год Болезнь Паркинсона. Редкие симптомы
Болезнь Паркинсона. Редкие симптомы Тиреоидиты. Классификация
Тиреоидиты. Классификация Технологическая нутрициология: жиры, липиды в пищевых продуктах
Технологическая нутрициология: жиры, липиды в пищевых продуктах Иммунодиагностика, иммунопрофилактика, иммунотерапия
Иммунодиагностика, иммунопрофилактика, иммунотерапия Основные понятия клинической химии
Основные понятия клинической химии Нарушение обмена веществ в организме и его тканях
Нарушение обмена веществ в организме и его тканях Хроническая сердечная недостаточность
Хроническая сердечная недостаточность ЖТД интернатурасы және ЖОО кейінгі білім беру
ЖТД интернатурасы және ЖОО кейінгі білім беру Раздражающие средства
Раздражающие средства Лептоспироз
Лептоспироз Методы исследования больных с заболеваниями органов пищеварения: расспрос, осмотр
Методы исследования больных с заболеваниями органов пищеварения: расспрос, осмотр Мостовидные протезы без опоры на коронку: Система CBW
Мостовидные протезы без опоры на коронку: Система CBW Методы иммунодиагностики и иммунопрофилактики инфекционных болезней
Методы иммунодиагностики и иммунопрофилактики инфекционных болезней Книжная выставка На страже здоровья
Книжная выставка На страже здоровья Высшие корковые функции и их нарушение. Поражение отдельных долей головного мозга
Высшие корковые функции и их нарушение. Поражение отдельных долей головного мозга Молекулярно-генетичні механізми онтогенезу. Порушення онтогенезу та їх місце в патології людини. Лекція 10
Молекулярно-генетичні механізми онтогенезу. Порушення онтогенезу та їх місце в патології людини. Лекція 10 Реабилитация детей с вирусными заболеваниями
Реабилитация детей с вирусными заболеваниями Варианты выполнения и обработки рентгеновских изображений
Варианты выполнения и обработки рентгеновских изображений Обучение и развитие детей с нарушениями слуха
Обучение и развитие детей с нарушениями слуха Өкпе гипертензиясы кезіндегі ЭКГ, ЭхоКГ және рентген көріністері
Өкпе гипертензиясы кезіндегі ЭКГ, ЭхоКГ және рентген көріністері Составление алгоритмов оказания неотложной доврачебной помощи
Составление алгоритмов оказания неотложной доврачебной помощи