Внеклассное мероприятие Экспериментальное исследование окислительно-восстановительных реакций презентация
Содержание
- 2. Цели и задачи: Формирование системных представлений об окислительно-восстановительных реакциях в ходе учебного исследования Сравнивать окислительно-восстановительную активность
- 3. Содержание: Демонстрация окислительно- восстановительных реакциий Процесс окисления Процесс восстановления Алгоритм записи
- 4. Окислительно-восстановительные реакции. Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, получили название
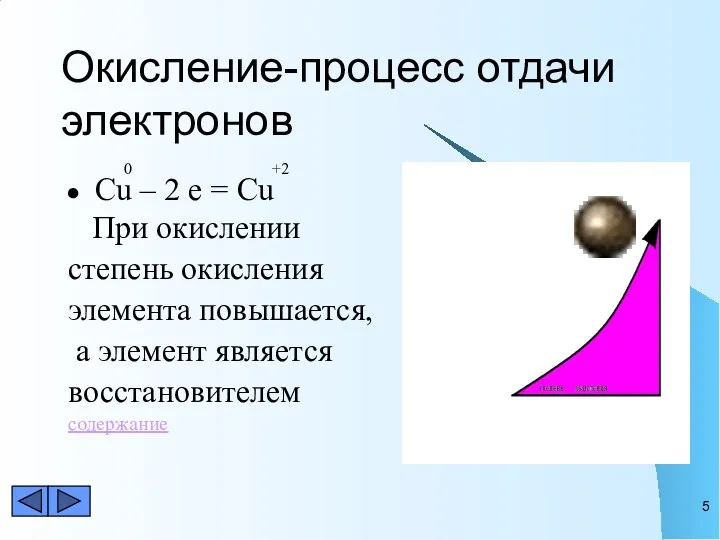
- 5. Окисление-процесс отдачи электронов 0 +2 Cu – 2 e = Cu При окислении степень окисления элемента
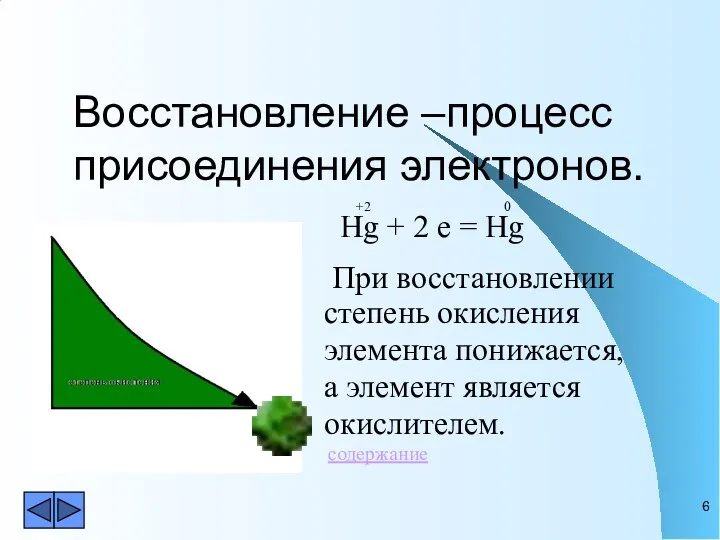
- 6. Восстановление –процесс присоединения электронов. +2 0 Hg + 2 e = Hg При восстановлении степень окисления
- 7. Важнейшие окислители KMn04 - перманганат калия K2Cr2O7 – дихромат калия MnO2 –оксид марганца Н2O2 – пероксид
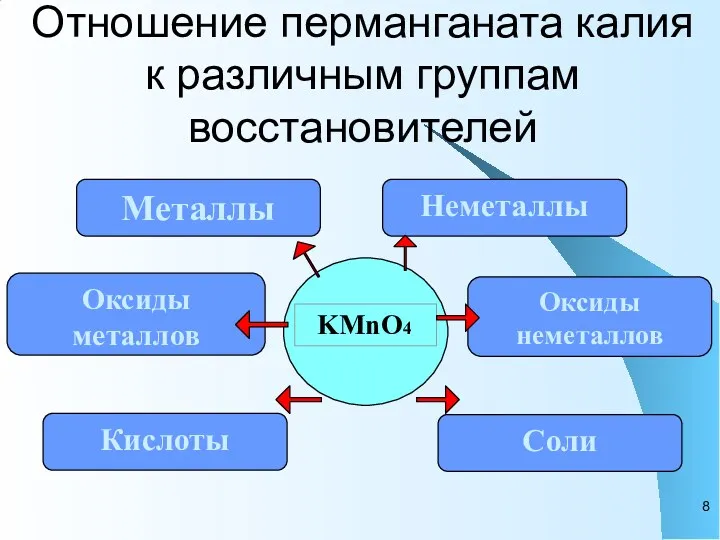
- 8. Отношение перманганата калия к различным группам восстановителей Металлы Неметаллы Оксиды неметаллов Оксиды металлов Соли Кислоты KMnO4
- 9. Взаимодействие подкисленного раствора перманганата калия с металлами Опыт №1. Взамодействие с цинком 2KMnO4+5Zn+8H2SO4=2MnSO4+5ZnSO4+K2SO4+8H2O Опыт №2. Взаимодействие
- 10. Взаимодействие подкисленного раствора перманганата калия с неметаллами Опыт №4. Окисление белого фосфора 2KMnO4+ 2P+3H2SO4= =2H3PO4+2MnSO4+K2SO4
- 11. Взаимодействие оксидов металлов с подкисленным раствором перманганата калия Опыт №5 Окисление оксида меди (I) 2KMnO4+5Cu2O+13H2SO4= =2MnSO4+10CuSO4+K2SO4+13H2O
- 12. Взаимодействие солей с подкисленным раствором перманганата калия Опыт №6 Окисление сульфида натрия 2KMnSO4+5Na2S+8H2SO4= =2MnSO4+5S+5Na2SO4+k2SO4+8H2O
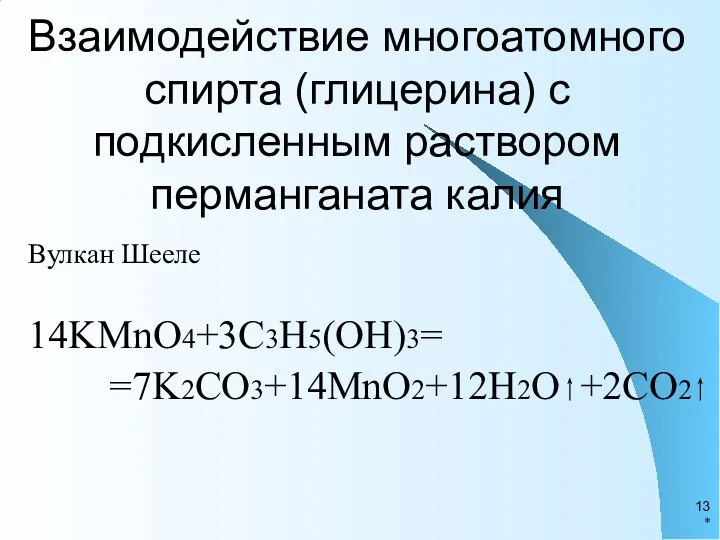
- 13. Взаимодействие многоатомного спирта (глицерина) с подкисленным раствором перманганата калия Вулкан Шееле 14KMnO4+3C3H5(OH)3= =7K2CO3+14MnO2+12H2O +2CO2 *
- 15. Скачать презентацию







 Использование информационных технологий в проектной деятельности
Использование информационных технологий в проектной деятельности Профессиональная деятельность социального педагога
Профессиональная деятельность социального педагога Все профессии важны. Выбор профессии
Все профессии важны. Выбор профессии Я и дорога
Я и дорога Современные подходы к организации образовательной деятельности детей в детском саду
Современные подходы к организации образовательной деятельности детей в детском саду Программа Летней площадки для детей “Мой мир”
Программа Летней площадки для детей “Мой мир” Презентация к классному часу на тему Компьютер- друг или враг?
Презентация к классному часу на тему Компьютер- друг или враг? Многоатомные спирты
Многоатомные спирты Формирование УУД средствами литературного чтения
Формирование УУД средствами литературного чтения Презентация Как научиться управлять классом
Презентация Как научиться управлять классом Моделирование как метод педагогического исследования
Моделирование как метод педагогического исследования Обработка древесиы
Обработка древесиы Общие основы педагогики
Общие основы педагогики Олимпийская азбука (часть 2)
Олимпийская азбука (часть 2) Своя игра
Своя игра Интерактивная игра Собери фрукты в вазу
Интерактивная игра Собери фрукты в вазу Игры с буквами и словами на уроках и дома
Игры с буквами и словами на уроках и дома Спортивный праздник Как составить свое расписание здоровья на летнее время
Спортивный праздник Как составить свое расписание здоровья на летнее время Внеклассное мероприятие Звездный час
Внеклассное мероприятие Звездный час Формы воспитательной работы
Формы воспитательной работы Родительское собрание
Родительское собрание Презентация к играм на сцене.
Презентация к играм на сцене. Классный час + презентация по теме Я и мое право
Классный час + презентация по теме Я и мое право Ұжымдық оқыту технолгиясы
Ұжымдық оқыту технолгиясы презентация к уроку Человек и его привычки 8 класс
презентация к уроку Человек и его привычки 8 класс Задачи и средства физического воспитания
Задачи и средства физического воспитания Формирование коммуникативных навыков подростков с нарушениями слуха
Формирование коммуникативных навыков подростков с нарушениями слуха Формирование школьных компетенций в рамках образовательной программы Перспективная начальная школа
Формирование школьных компетенций в рамках образовательной программы Перспективная начальная школа