Химические свойства аммиака
Реакции, идущие
с изменением степени окисления азота
NH3 – сильный
восстановитель
без изменения степени окисления азота
NH3 – слабое основание
1. Аммиак – непрочное соединение,
при нагревании разлагается:
2NH3 N2 + 3H2
2. Аммиак горит в кислороде:
NH3 + O2 → N2 + H2O
3. Окисление аммиака кислородом воздуха в присутствии катализатора:
NH3 + O2 NО + H2O
Pt, Rh
1. Аммиак реагирует с водой:
NH3 + H2O NH4OH NH4+ + OH−
гидроксид аммония
2. Аммиак реагирует с кислотами:
NH3 + HCl → NH4Cl
хлорид аммония



 Предмет та метод економічної теорії
Предмет та метод економічної теорії Методическая разработка. Проект во второй младшей группе
Методическая разработка. Проект во второй младшей группе Захотів наш спаситель померти за нас
Захотів наш спаситель померти за нас Презентация Мой класс- это мое отражение
Презентация Мой класс- это мое отражение Моделирование и расчет электропривода мостового крана грузоподъемностью 200 кН
Моделирование и расчет электропривода мостового крана грузоподъемностью 200 кН Продажи Red Bull
Продажи Red Bull Дамыта оқыту технологиясы. Дамыта оқыту жүйесі
Дамыта оқыту технологиясы. Дамыта оқыту жүйесі Тундра
Тундра Восстановление и ремонт изделий из композиционных материалов (ВКР)
Восстановление и ремонт изделий из композиционных материалов (ВКР) Игровая деятельность, как вид самостоятельной работы учащихся на уроках.
Игровая деятельность, как вид самостоятельной работы учащихся на уроках. Презентация из опыта работы по гендерному воспитанию детей дошкольного возраста на тему: Как и во что играют мальчики и девочки
Презентация из опыта работы по гендерному воспитанию детей дошкольного возраста на тему: Как и во что играют мальчики и девочки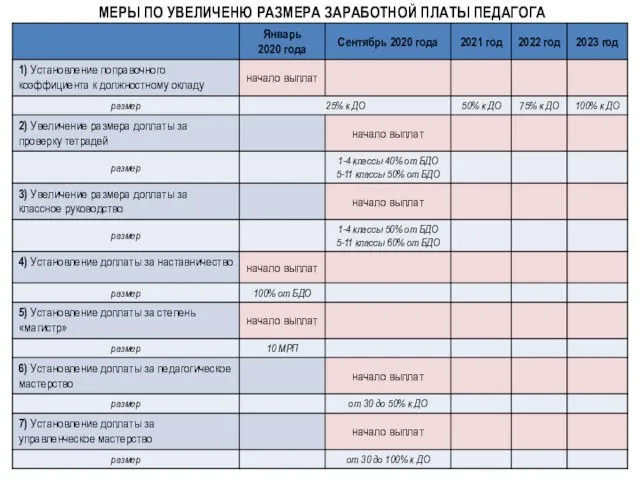 Меры по увеличению размера заработной платы педагога
Меры по увеличению размера заработной платы педагога Правление Ярослава Мудрого 1016 - 1054
Правление Ярослава Мудрого 1016 - 1054 Собрание
Собрание Занятие в ГПД Государственные символы России
Занятие в ГПД Государственные символы России Технология развития критического мышления
Технология развития критического мышления Физкультминутки в ДОУ
Физкультминутки в ДОУ Подушки EcoGel. Коллекция анатомических подушек
Подушки EcoGel. Коллекция анатомических подушек Стройка. Профессии строителей
Стройка. Профессии строителей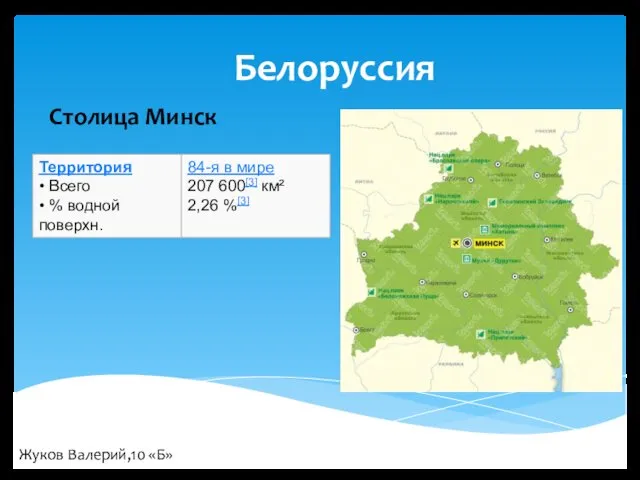 Республика Белоруссия
Республика Белоруссия Причини та профілактика зупинки кровообігу
Причини та профілактика зупинки кровообігу Взрыв, его поражающие факторы. Классификация взрывов. Способы защиты
Взрыв, его поражающие факторы. Классификация взрывов. Способы защиты Биохимия и молекулярная биология. Биоэнергетика (лекция 12)
Биохимия и молекулярная биология. Биоэнергетика (лекция 12) Quel temps fait-il? Leçon 8
Quel temps fait-il? Leçon 8 My favourite film
My favourite film Понятие инвестиционной стратегии и ее роль в развитии предприятия. Лекция 1
Понятие инвестиционной стратегии и ее роль в развитии предприятия. Лекция 1 Вакансии. Кировское областное государственное бюджетное учреждение здравоохранения Немская центральная районная больница
Вакансии. Кировское областное государственное бюджетное учреждение здравоохранения Немская центральная районная больница Пакистан. Государство в Южной Азии
Пакистан. Государство в Южной Азии