Содержание
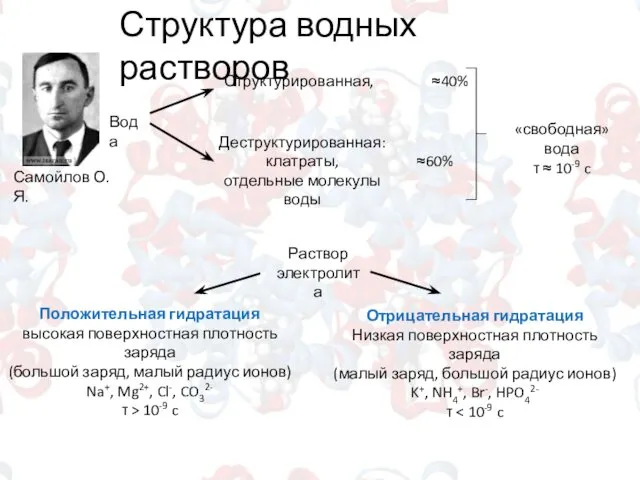
- 2. Структура водных растворов Самойлов О.Я. Вода Структурированная, ≈40% Деструктурированная: клатраты, отдельные молекулы воды ≈60% Раствор электролита
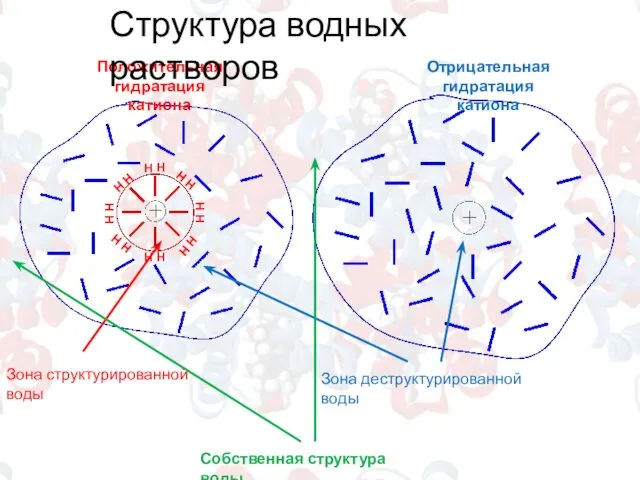
- 3. Положительная гидратация катиона Отрицательная гидратация катиона Зона структурированной воды Зона деструктурированной воды Собственная структура воды Структура
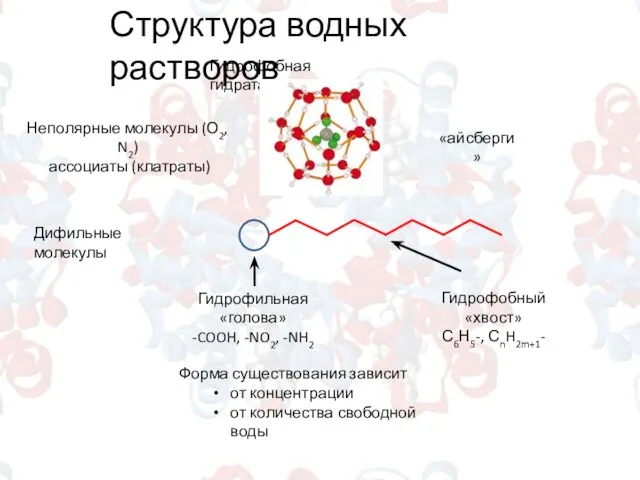
- 4. Структура водных растворов Гидрофобная гидратация Неполярные молекулы (О2, N2) ассоциаты (клатраты) «айсберги» Дифильные молекулы Гидрофильная «голова»
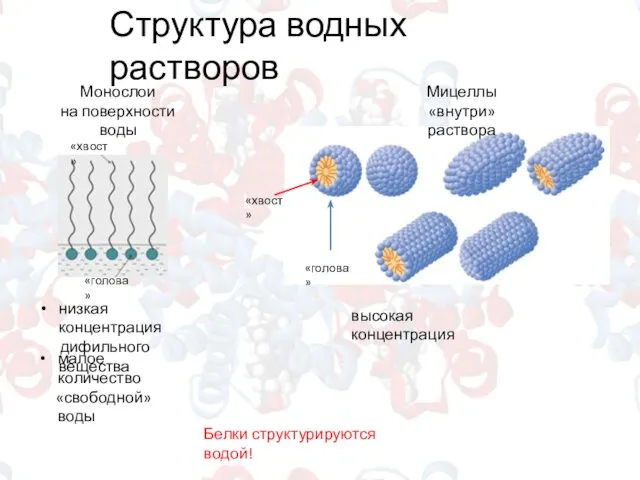
- 5. Структура водных растворов Белки структурируются водой! Монослои на поверхности воды Мицеллы «внутри» раствора низкая концентрация дифильного
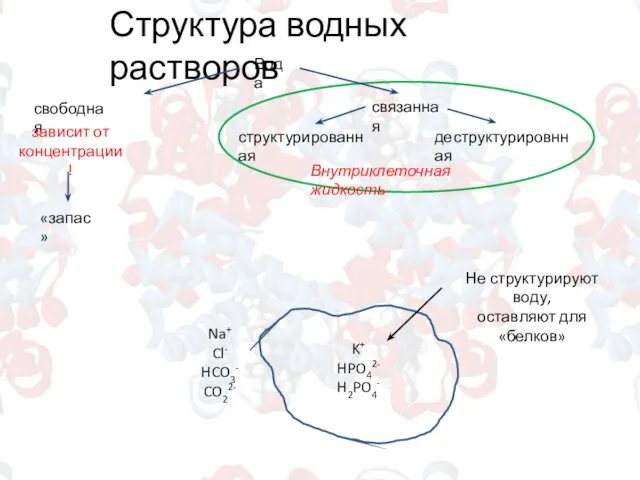
- 6. Структура водных растворов Вода свободная структурированная деструктурировнная связанная Внутриклеточная жидкость «запас» зависит от концентрации! K+ HPO42-
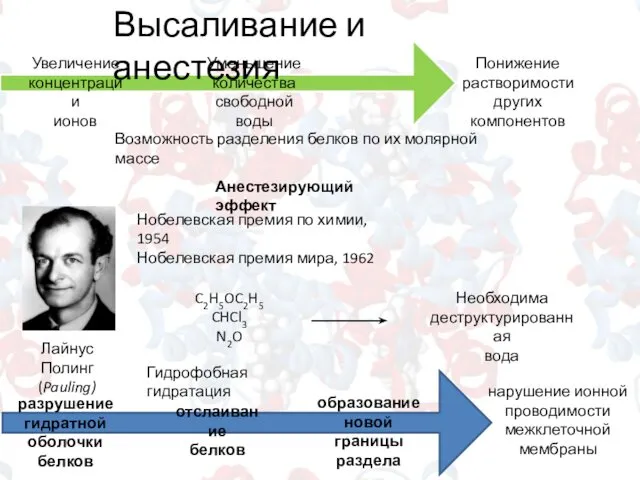
- 7. Высаливание и анестезия Увеличение концентрации ионов Уменьшение количества свободной воды Понижение растворимости других компонентов Возможность разделения
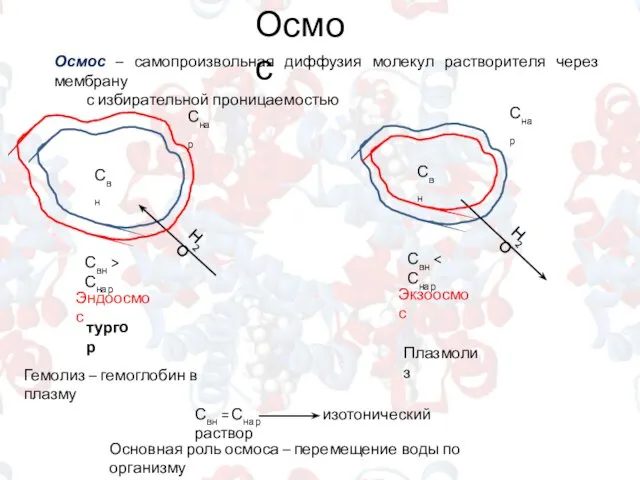
- 8. Осмос Осмос – самопроизвольная диффузия молекул растворителя через мембрану с избирательной проницаемостью Свн Снар Свн >
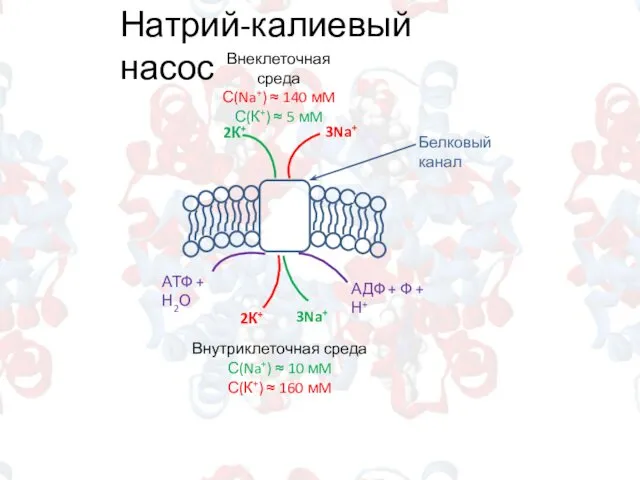
- 9. Натрий-калиевый насос Внеклеточная среда С(Na+) ≈ 140 мM С(К+) ≈ 5 мM Внутриклеточная среда С(Na+) ≈
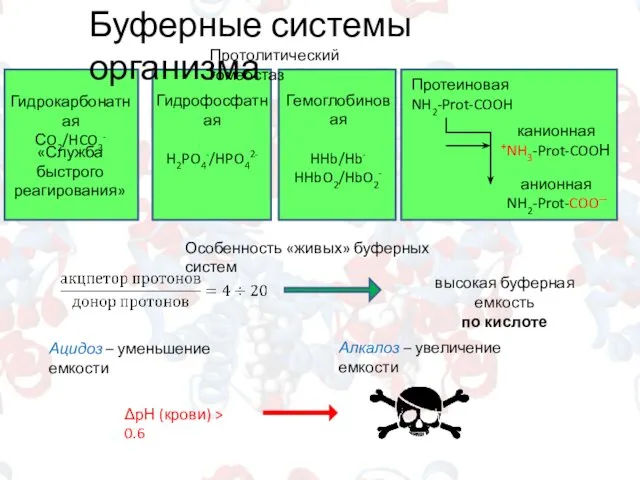
- 10. Буферные системы организма Гидрокарбонатная СO2/HCO3- «Служба быстрого реагирования» Гидрофосфатная H2PO4-/HPO42- Гемоглобиновая HHb/Hb- HHbO2/HbO2- Протолитический гомеостаз Протеиновая
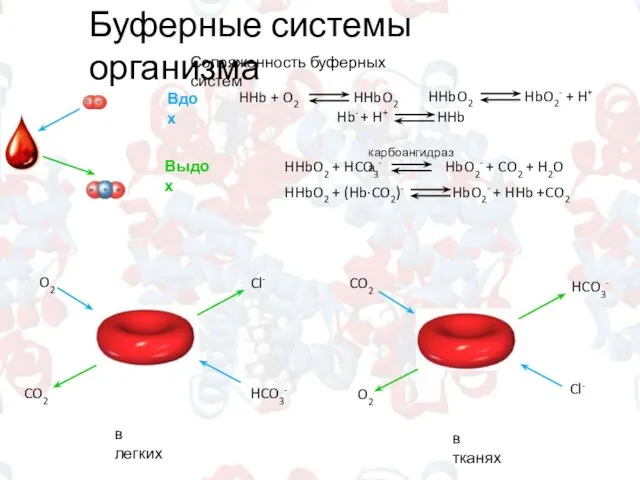
- 11. Буферные системы организма Сопряженность буферных систем карбоангидраза Вдох Выдох O2 HCO3- CO2 Cl- CO2 Cl- O2
- 12. Гетерогенные системы организма Плазма крови [Ca2+] = 1,1∙10-3 M [HPO42-] = 2,9∙10-4 M ИП = 3,2∙10-7
- 14. Скачать презентацию
![Гетерогенные системы организма Плазма крови [Ca2+] = 1,1∙10-3 M [HPO42-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/68515/slide-11.jpg)
 Предприятие как субъект и объект предпринимательской деятельности. Тема 2
Предприятие как субъект и объект предпринимательской деятельности. Тема 2 Урок-практическая работа.
Урок-практическая работа. Предварительно-напряженные листовые металлические конструкции
Предварительно-напряженные листовые металлические конструкции Анри де Тулуз-Лотрек 1864–1901
Анри де Тулуз-Лотрек 1864–1901 Есептеуіш техниканың даму келешегі
Есептеуіш техниканың даму келешегі Вацлав Леопольдович Серошевский, польский писатель
Вацлав Леопольдович Серошевский, польский писатель Воды недр 6 класс
Воды недр 6 класс Материалы к уроку Природа арктических пустынь_тундры и лесотундры
Материалы к уроку Природа арктических пустынь_тундры и лесотундры День матери
День матери Глагол. Обобщение знаний
Глагол. Обобщение знаний классный час Битва за Берлин
классный час Битва за Берлин Письменность и знания древних египтян. Тест
Письменность и знания древних египтян. Тест Цветик семицветик. Анализ строения предметов, сравнение картинок между собой
Цветик семицветик. Анализ строения предметов, сравнение картинок между собой Проблема адаптации баскетболисток при переходе в команды высокой квалификации
Проблема адаптации баскетболисток при переходе в команды высокой квалификации Материнська плата. Призначення материнської плати
Материнська плата. Призначення материнської плати Литературное краеведение Оренбургской области.Дело Пугачева.
Литературное краеведение Оренбургской области.Дело Пугачева. Почвы и почвенные ресурсы. Главные типы почв России
Почвы и почвенные ресурсы. Главные типы почв России Проект: Пусть нетрудным будет путь
Проект: Пусть нетрудным будет путь Государственные, муниципальные предприятия и учреждения, их классификация
Государственные, муниципальные предприятия и учреждения, их классификация Возраст и становление личности
Возраст и становление личности КРД engine indicating расходомеры топлива. Engine indicating. Расходомеры топлива
КРД engine indicating расходомеры топлива. Engine indicating. Расходомеры топлива Сравнительная характеристика газобаллонных и бензиновых автомобилей
Сравнительная характеристика газобаллонных и бензиновых автомобилей Дорожные ловушки для пешеходов
Дорожные ловушки для пешеходов Қазақстанның машина жасау өнеркәсібі
Қазақстанның машина жасау өнеркәсібі Пушкин в живописи ХХ – XXI веков – отсутствие интеллигентности, вызов классическим традициям или нестандартное мироощущение
Пушкин в живописи ХХ – XXI веков – отсутствие интеллигентности, вызов классическим традициям или нестандартное мироощущение Маркетинговые исследования
Маркетинговые исследования Усовершенствование магистерской программы
Усовершенствование магистерской программы Детское экспериментирование со звуком
Детское экспериментирование со звуком