Содержание
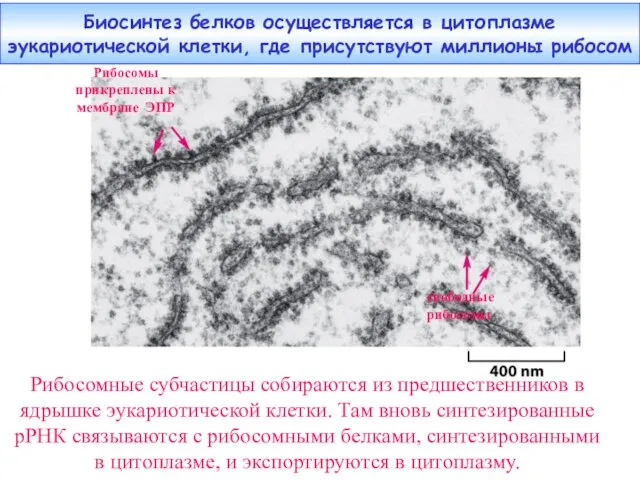
- 2. Биосинтез белков осуществляется в цитоплазме эукариотической клетки, где присутствуют миллионы рибосом свободные рибосомы Рибосомы прикреплены к
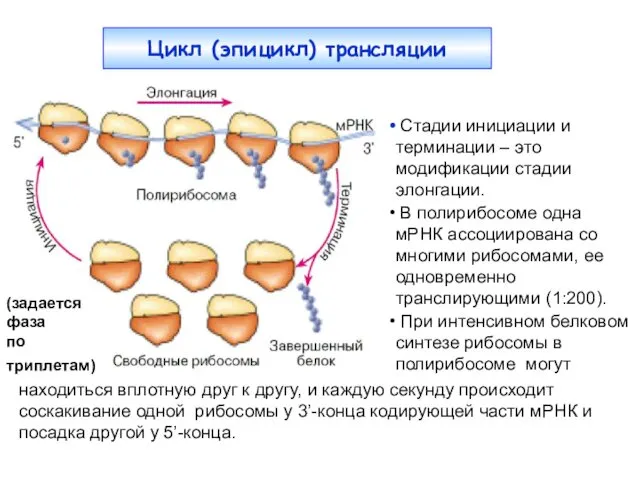
- 3. Цикл (эпицикл) трансляции (задается фаза по триплетам) находиться вплотную друг к другу, и каждую секунду происходит
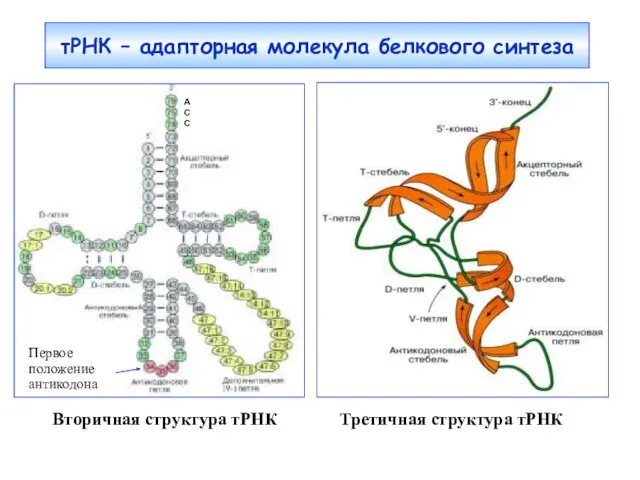
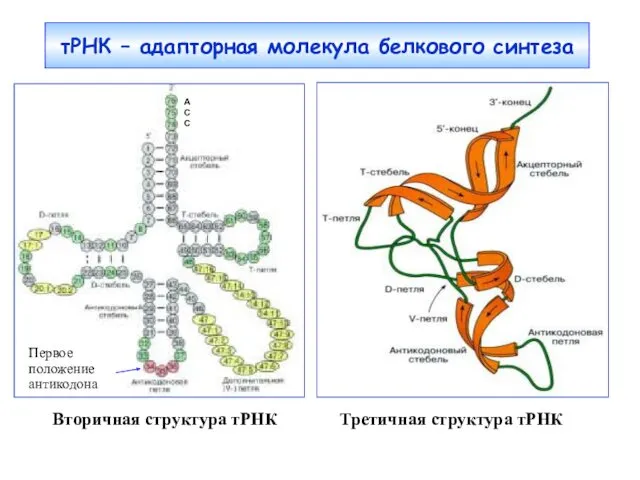
- 4. тРНК – адапторная молекула белкового синтеза Вторичная структура тРНК Третичная структура тРНК A C C Первое
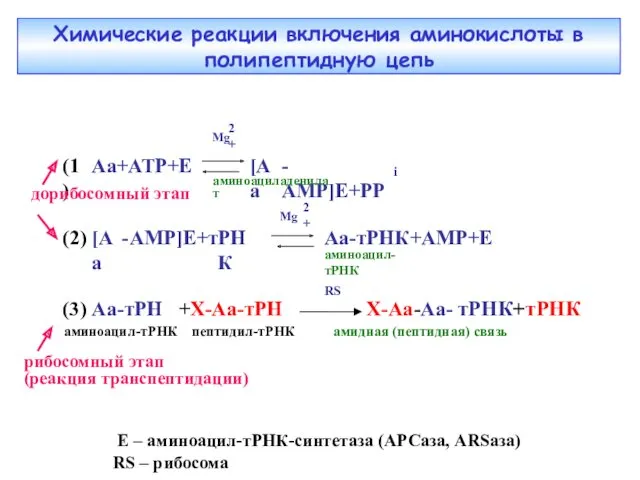
- 5. Химические реакции включения аминокислоты в полипептидную цепь рибосомный этап (реакция транспептидации)
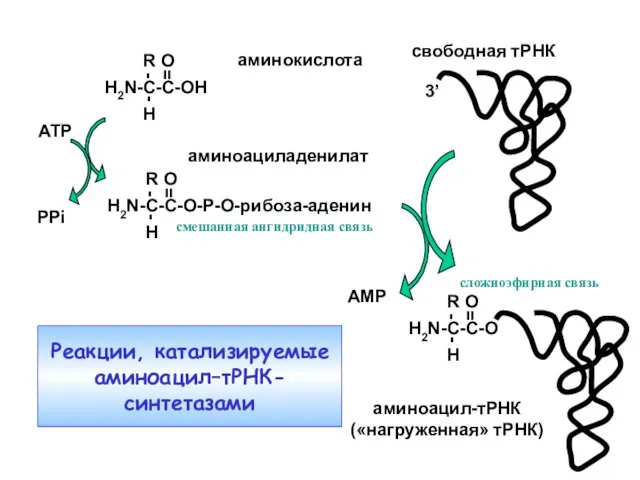
- 6. ATP аминокислота аминоациладенилат PPi свободная тРНК аминоацил-тРНК («нагруженная» тРНК) AMP 3’ Amino acid activation and tRNA
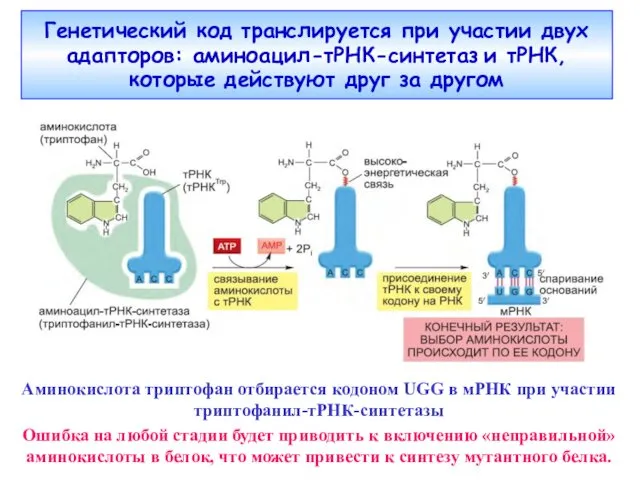
- 7. Генетический код транслируется при участии двух адапторов: аминоацил-тРНК-синтетаз и тРНК, которые действуют друг за другом Аминокислота
- 8. Аминоацил-тРНК-синтетазы катализируют активацию аминокислот и аминоацилирование тРНК: в большинстве клеток для каждой из 20 аминокислот имеется
- 9. Два класса аминоацил-тРНК-синтетаз Активируемые аминокислоты Arg Leu Cys Met Gln Trp Glu Tyr Ile Val Ala
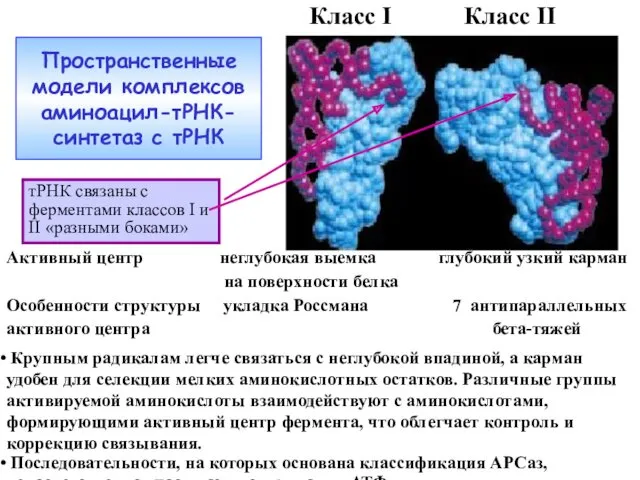
- 10. Пространственные модели комплексов аминоацил-тРНК-синтетаз с тРНК Класс I Класс II Активный центр неглубокая выемка глубокий узкий
- 11. тРНК – адапторная молекула белкового синтеза Вторичная структура тРНК Третичная структура тРНК A C C Первое
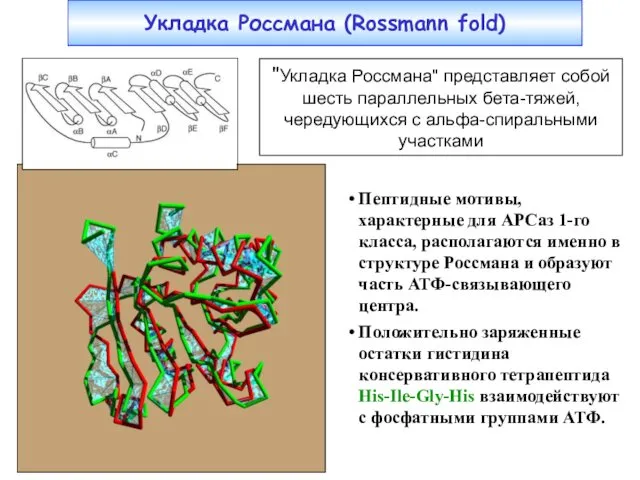
- 12. Укладка Россмана (Rossmann fold) Пептидные мотивы, характерные для АРСаз 1-го класса, располагаются именно в структуре Россмана
- 13. 1. Два типа возможных ошибок аминоацил-тРНК-синтетазы (отбор «неправильной» аминокислоты и «неправильной» тРНК) приводят к одинаковому ошибочному
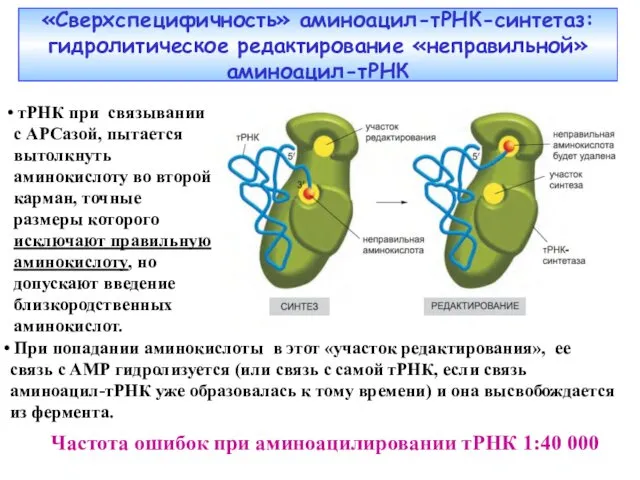
- 14. «Сверхспецифичность» аминоацил-тРНК-синтетаз: гидролитическое редактирование «неправильной» аминоацил-тРНК Частота ошибок при аминоацилировании тРНК 1:40 000 тРНК при связывании
- 15. Элементы, определяющие «индивидуальность» (identity) тРНК, или элементы распознавания: черты, воспринимаемые своей АРСазой, как «притягательные», а остальными
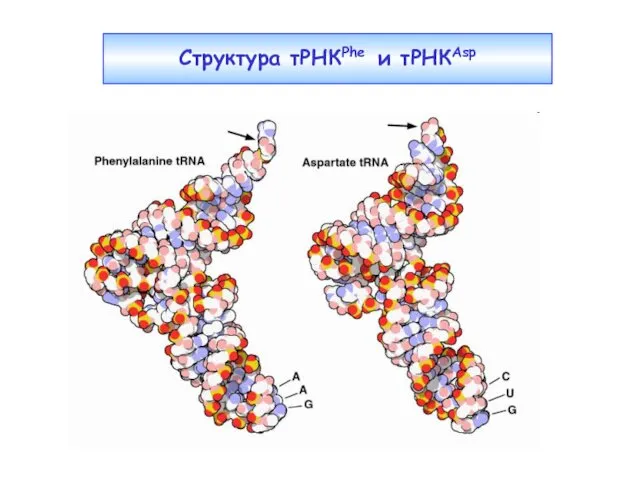
- 16. Структура тРНКPhe и тРНКAsp
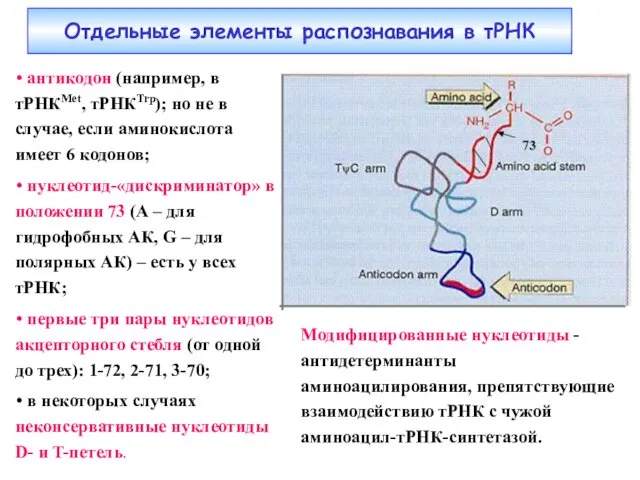
- 17. Отдельные элементы распознавания в тРНК антикодон (например, в тРНКMet, тРНКTrp); но не в случае, если аминокислота
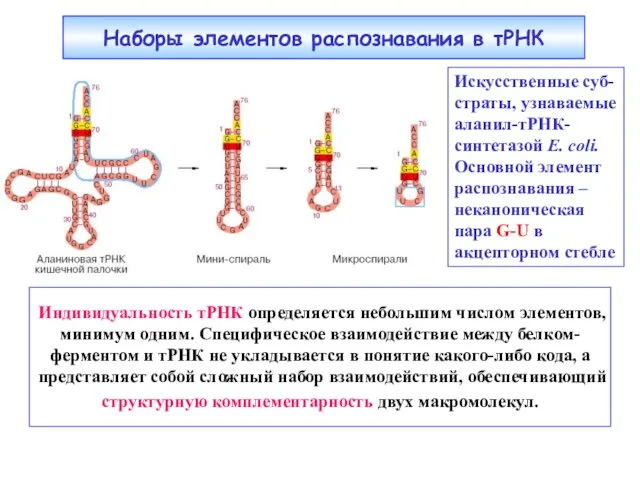
- 18. Наборы элементов распознавания в тРНК Индивидуальность тРНК определяется небольшим числом элементов, минимум одним. Специфическое взаимодействие между
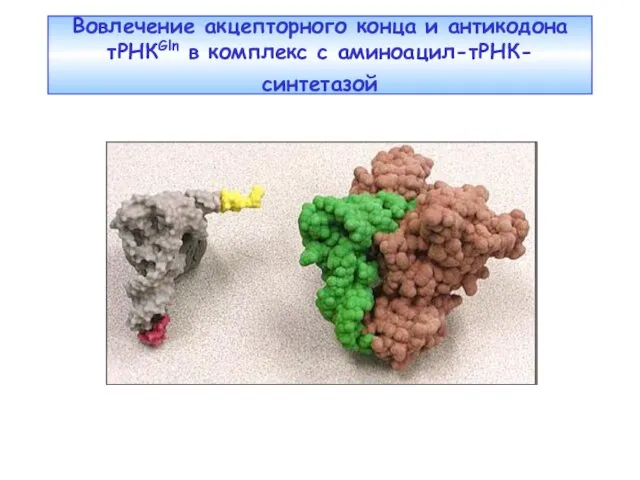
- 19. Вовлечение акцепторного конца и антикодона тРНКGln в комплекс с аминоацил-тРНК-синтетазой
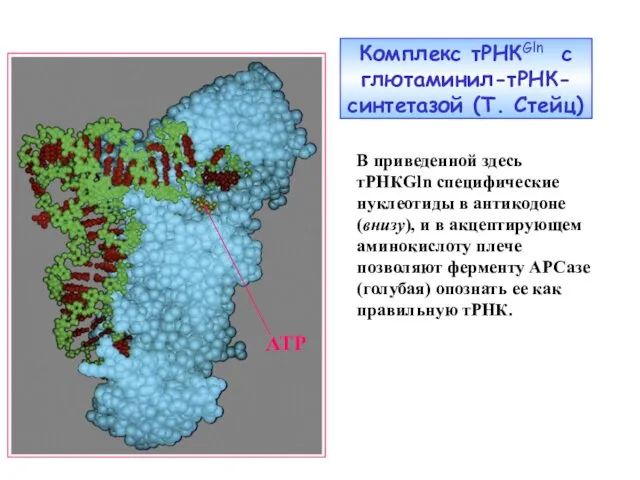
- 20. Комплекс тРНКGln с глютаминил-тРНК-синтетазой (Т. Стейц) АТР В приведенной здесь тРНКGln специфические нуклеотиды в антикодоне (внизу),
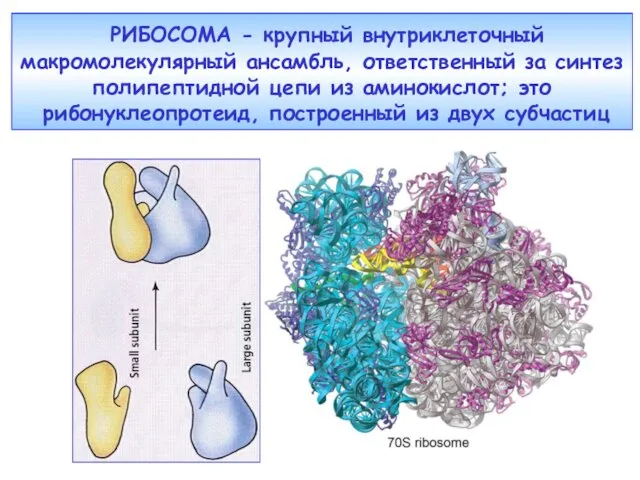
- 21. РИБОСОМА - крупный внутриклеточный макромолекулярный ансамбль, ответственный за синтез полипептидной цепи из аминокислот; это рибонуклеопротеид, построенный
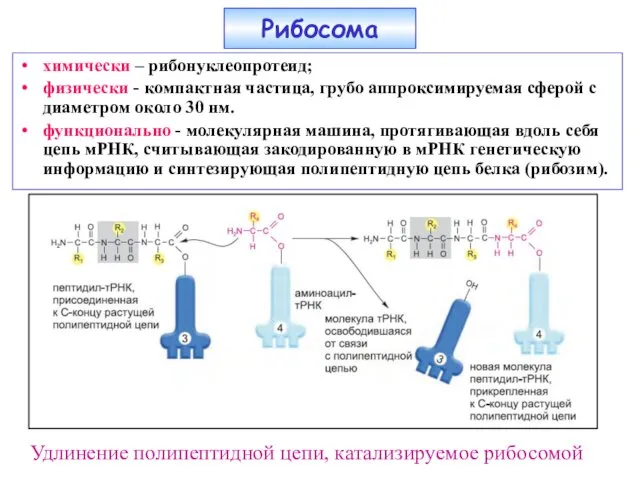
- 22. химически – рибонуклеопротеид; физически - компактная частица, грубо аппроксимируемая сферой с диаметром около 30 нм. функционально
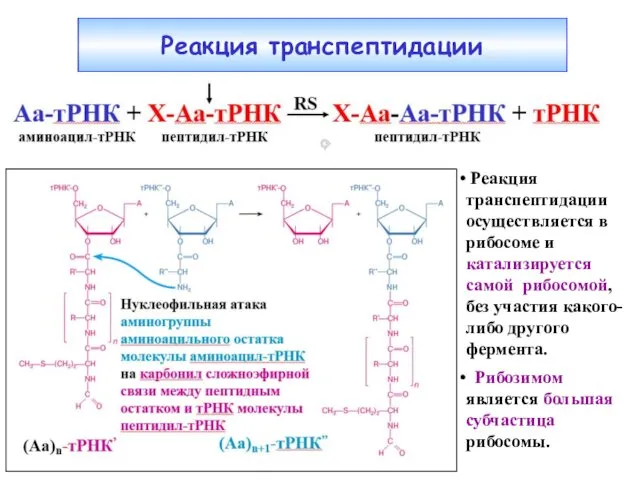
- 23. Реакция транспептидации Реакция транспептидации осуществляется в рибосоме и катализируется самой рибосомой, без участия какого-либо другого фермента.
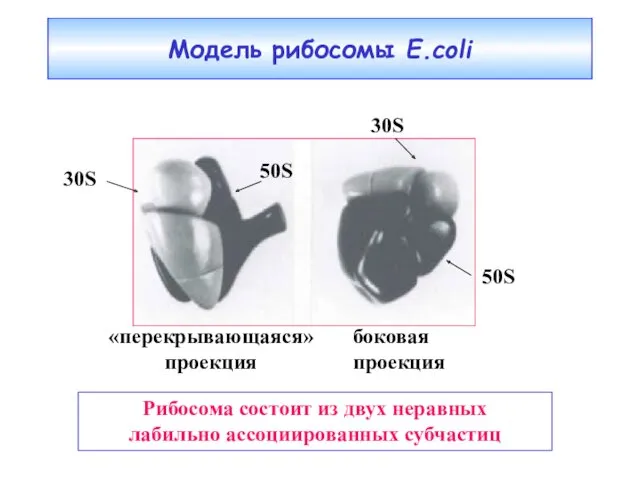
- 24. Модель рибосомы E.coli «перекрывающаяся» проекция боковая проекция 30S 50S Рибосома состоит из двух неравных лабильно ассоциированных
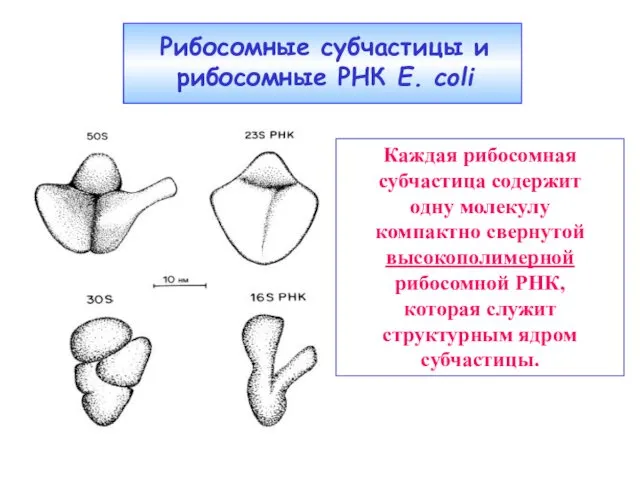
- 25. Каждая рибосомная субчастица содержит одну молекулу компактно свернутой высокополимерной рибосомной РНК, которая служит структурным ядром субчастицы.
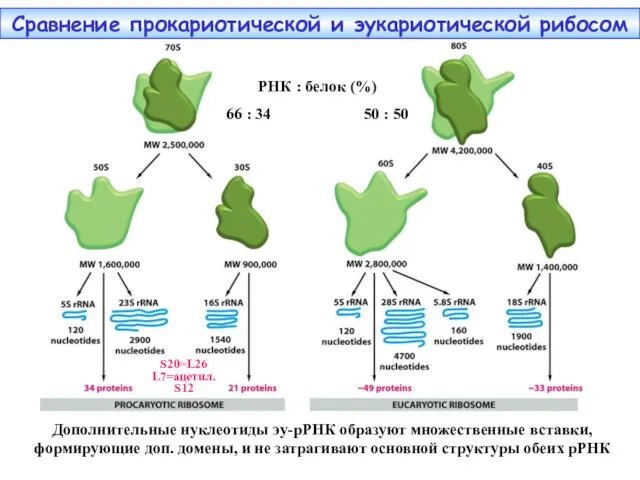
- 26. Сравнение прокариотической и эукариотической рибосом S20=L26 L7=ацетил.S12 РНК : белок (%) 66 : 34 50 :
- 27. Рибосомные белки Разделение индивидуальных белков бактериальной (E. coli) 70S-рибосомы путём дву-мерного электрофореза в полиакриламидном геле. Каждый
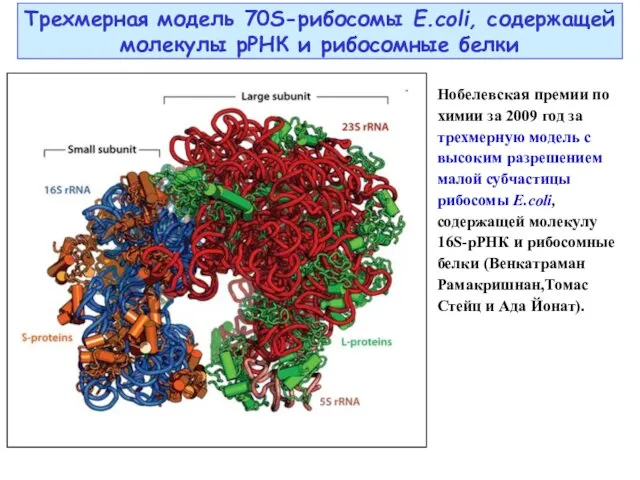
- 28. Трехмерная модель 70S-рибосомы E.coli, содержащей молекулы рРНК и рибосомные белки Нобелевская премии по химии за 2009
- 29. Типы рибосом
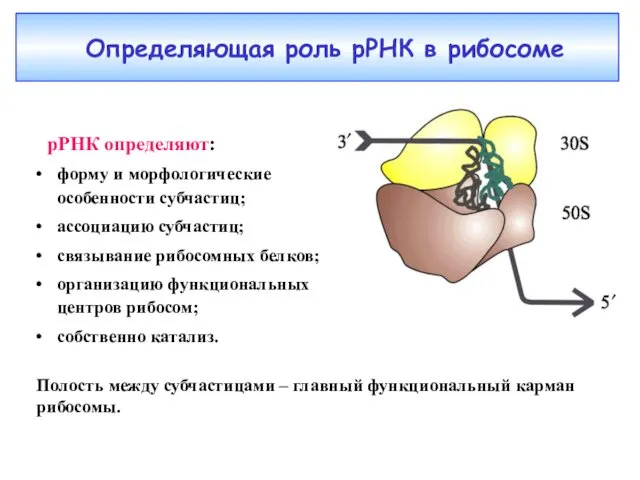
- 30. Определяющая роль рРНК в рибосоме Полость между субчастицами – главный функциональный карман рибосомы. рРНК определяют: форму
- 31. Участки связывания тРНК в рибосоме Рибосома содержит четыре участка связывания молекул РНК: один предназначен для мРНК,
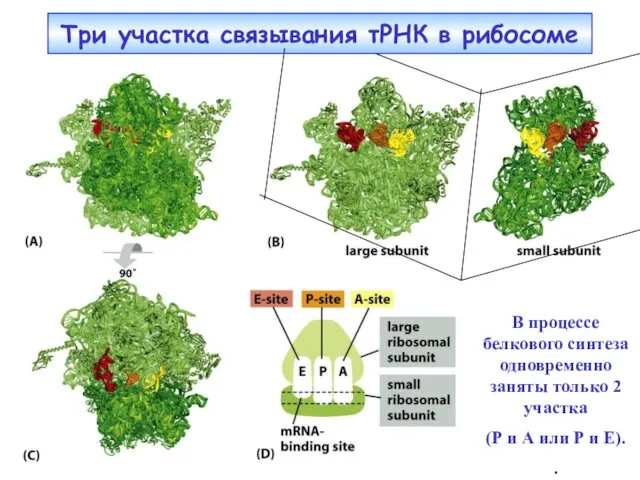
- 32. Три участка связывания тРНК в рибосоме В процессе белкового синтеза одновременно заняты только 2 участка (Р
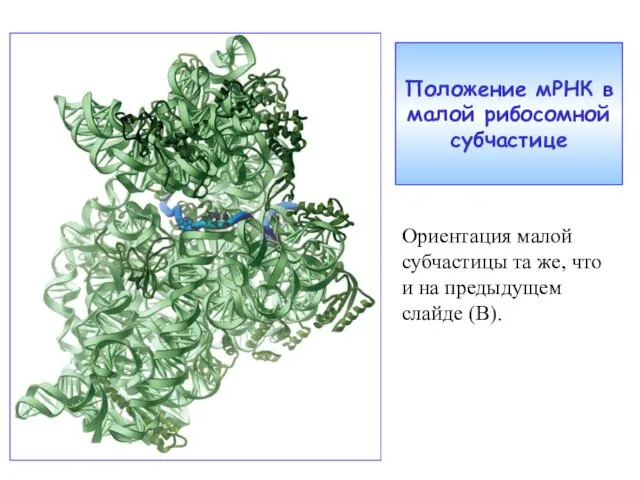
- 33. Положение мРНК в малой рибосомной субчастице Ориентация малой субчастицы та же, что и на предыдущем слайде
- 34. Разделение декодирующей и энзиматической функций между субчастицами Рибосома выполняет одновременно три функции: Генетическую, или декодирующую –
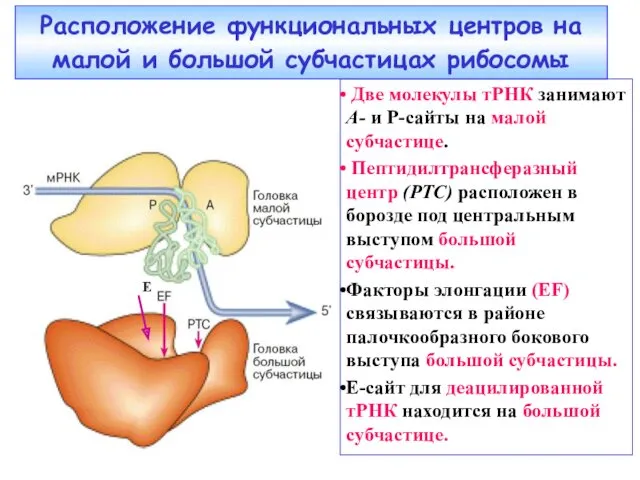
- 35. Расположение функциональных центров на малой и большой субчастицах рибосомы Две молекулы тРНК занимают А- и Р-сайты
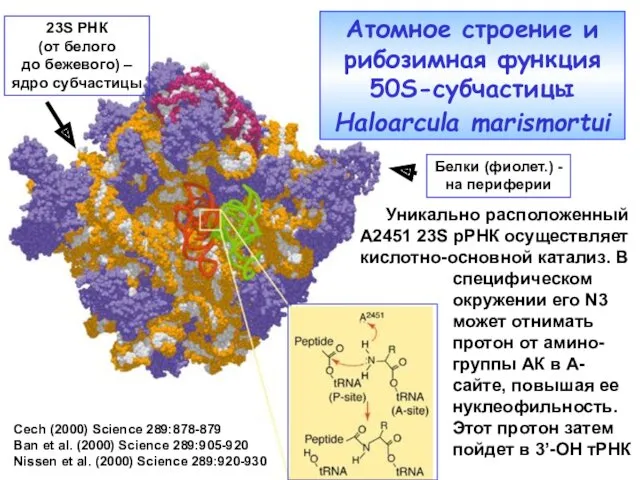
- 36. Cech (2000) Science 289:878-879 Ban et al. (2000) Science 289:905-920 Nissen et al. (2000) Science 289:920-930
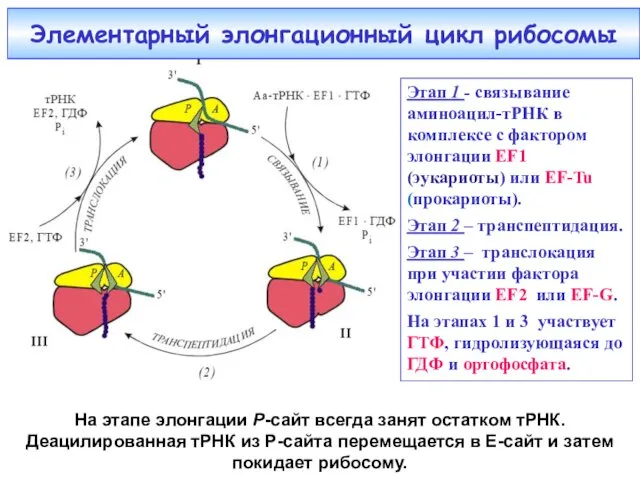
- 37. Этап 1 - связывание аминоацил-тРНК в комплексе с фактором элонгации EF1 (эукариоты) или EF-Tu (прокариоты). Этап
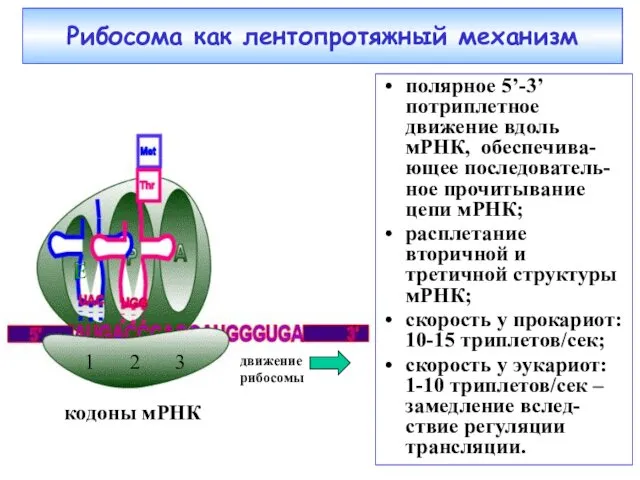
- 38. кодоны мРНК 1 3 2 движение рибосомы Рибосома как лентопротяжный механизм полярное 5’-3’ потриплетное движение вдоль
- 39. Конформационная подвижность рибосомы Взаимная подвижность двух рибосомных субчастиц; подвижность “головки” малой рибосомной субчастицы относительно ее “тела”;
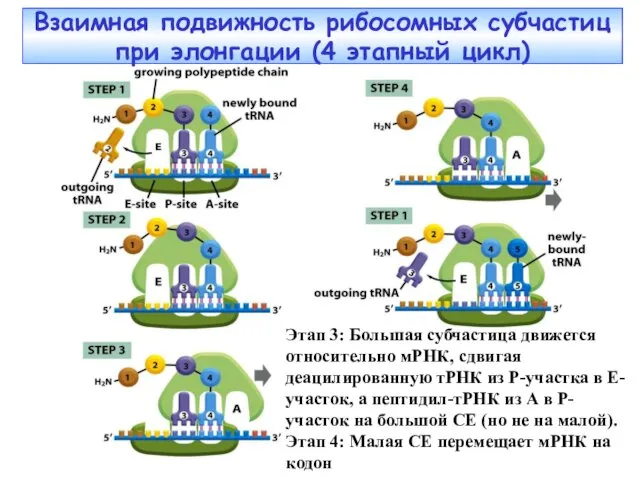
- 40. Взаимная подвижность рибосомных субчастиц при элонгации (4 этапный цикл) Этап 3: Большая субчастица движется относительно мРНК,
- 41. Доп. слайды
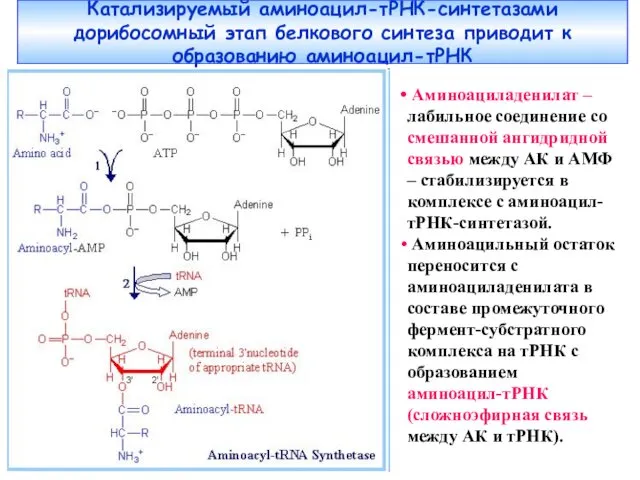
- 42. Катализируемый аминоацил-тРНК-синтетазами дорибосомный этап белкового синтеза приводит к образованию аминоацил-тРНК Аминоациладенилат – лабильное соединение со смешанной
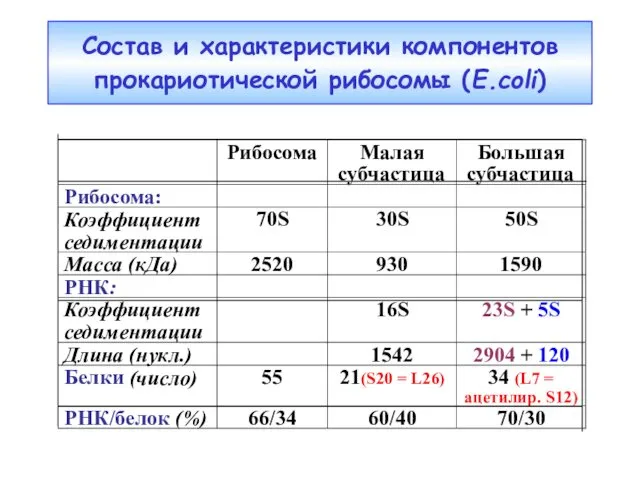
- 43. Состав и характеристики компонентов прокариотической рибосомы (E.coli)
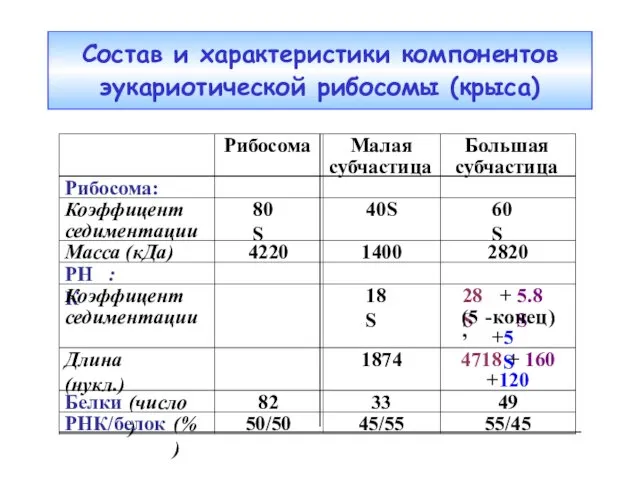
- 44. Состав и характеристики компонентов эукариотической рибосомы (крыса)
- 45. Трехмерная модель с высоким разрешением малой субчастицы рибосомы E.coli, содержащей молекулу 16S-рРНК и рибосомные белки (В.
- 46. Трехмерная модель с низким разрешением большой субчастицы рибосомы E.coli, содержащей молекулу 23S-рРНК и рибосомные белки (Т.
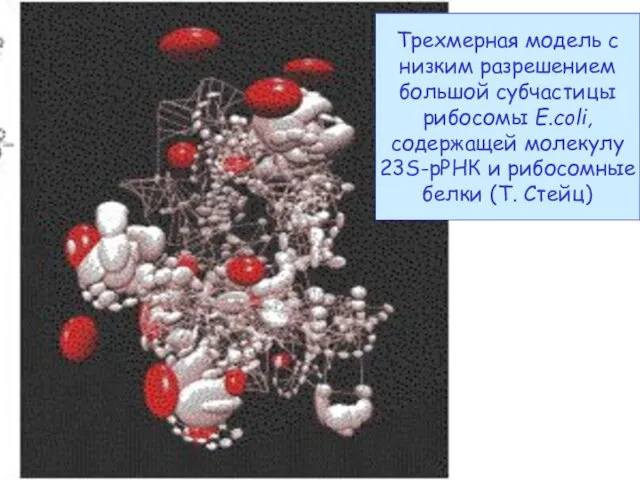
- 48. Скачать презентацию











 Числовые промежутки
Числовые промежутки Возникновение жизни на Земле
Возникновение жизни на Земле Лев Николаевич Толстой (1828 – 1910)
Лев Николаевич Толстой (1828 – 1910) Конституція України - Основний закон держави
Конституція України - Основний закон держави Гидролиз солей
Гидролиз солей Основные средства предприятия
Основные средства предприятия презентация Герои Великой Отечественной войны А. Мнацаканов
презентация Герои Великой Отечественной войны А. Мнацаканов Мікропроцесорна техніка PSoC Creator 4.2 Designing with PSoC 3/5. (Лекція 5)
Мікропроцесорна техніка PSoC Creator 4.2 Designing with PSoC 3/5. (Лекція 5) Новогодняя открытка у году обезьяны
Новогодняя открытка у году обезьяны A little bit about Spimun
A little bit about Spimun Ценности западной культуры по мнению М. Вебера
Ценности западной культуры по мнению М. Вебера Поколения авиационных ГТД
Поколения авиационных ГТД Крыжацкая і татарская навала
Крыжацкая і татарская навала Презентация Проектная деятельность
Презентация Проектная деятельность О нашем классе.
О нашем классе. Царь колокол
Царь колокол Ты во мне поёшь, Азербайджан
Ты во мне поёшь, Азербайджан Печатающие устройства
Печатающие устройства Глагол can
Глагол can Пропорциональность отрезков хорд, касательных и секущих
Пропорциональность отрезков хорд, касательных и секущих Отчет о работе педагога группы № 4 за 2014-2015 учебный год
Отчет о работе педагога группы № 4 за 2014-2015 учебный год Электроснабжение ремонтно-механического цеха
Электроснабжение ремонтно-механического цеха Компьютерные игры в жанре экшен
Компьютерные игры в жанре экшен Дистрофии. Гипотрофия. Паратрофия. Гипостатура. Симптомы, диагностика, лечение, профилактика
Дистрофии. Гипотрофия. Паратрофия. Гипостатура. Симптомы, диагностика, лечение, профилактика Множества и операции над ними
Множества и операции над ними Система образования Германии
Система образования Германии Формула души. Обучающий курс
Формула души. Обучающий курс Интерактивная игра. Географическое лото. Африка.
Интерактивная игра. Географическое лото. Африка.