Содержание
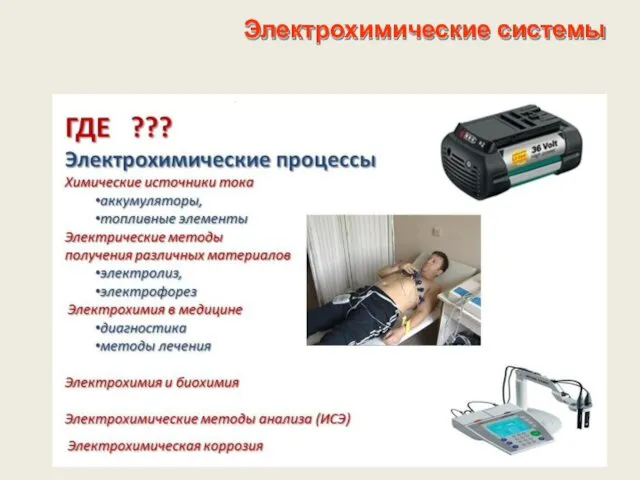
- 2. Электрохимические системы Электрохимические процессы – это процессы взаимного превращения двух видов энергии Химической в электрическую –
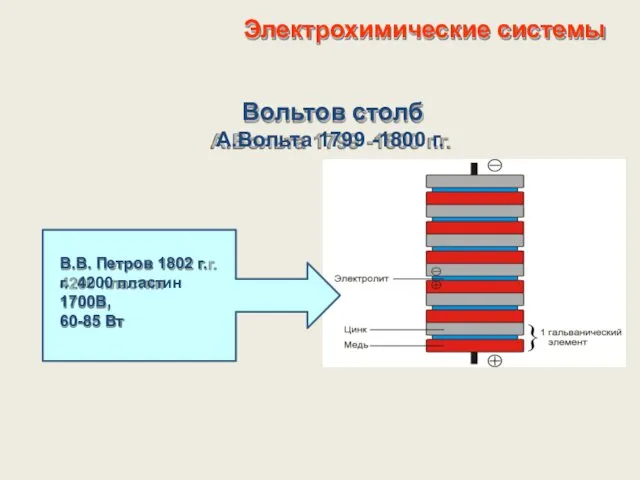
- 3. Электрохимические системы Вольтов столб А.Вольта 1799 -1800 г.г. В.В. Петров 1802 г.г. 4200 пластин 1700В, 60-85
- 4. Электрохимические системы
- 5. Электрохимические системы
- 6. Электрохимические системы
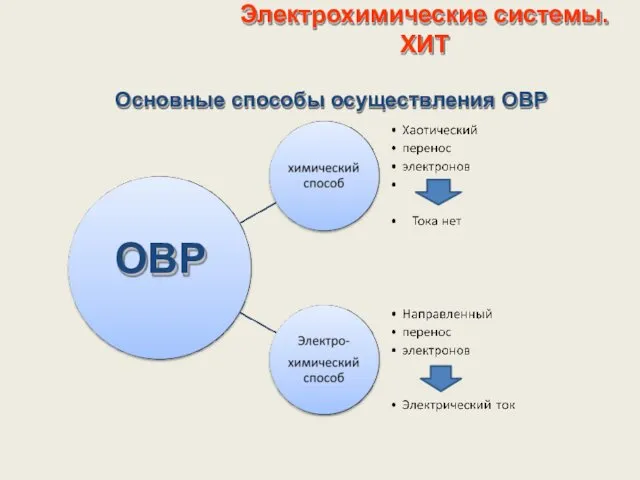
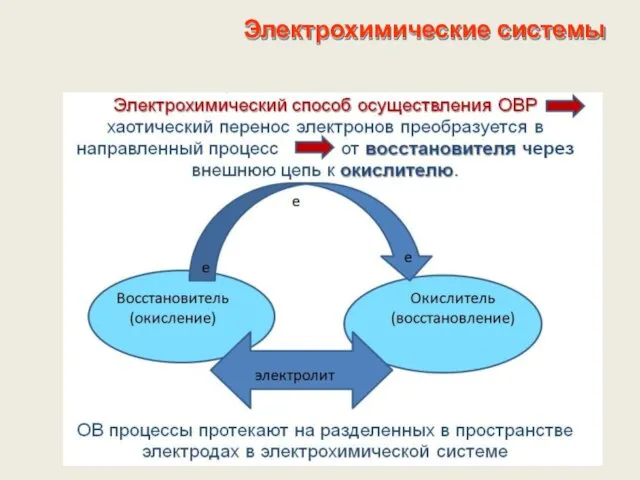
- 7. Электрохимические системы. ХИТ ОВР Основные способы осуществления ОВР
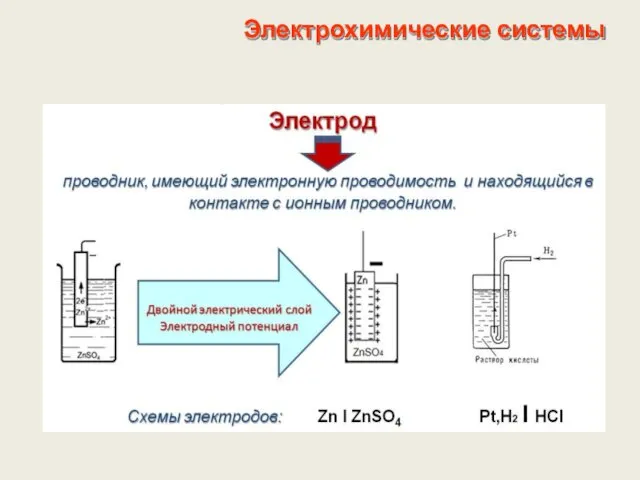
- 8. Электрохимические системы
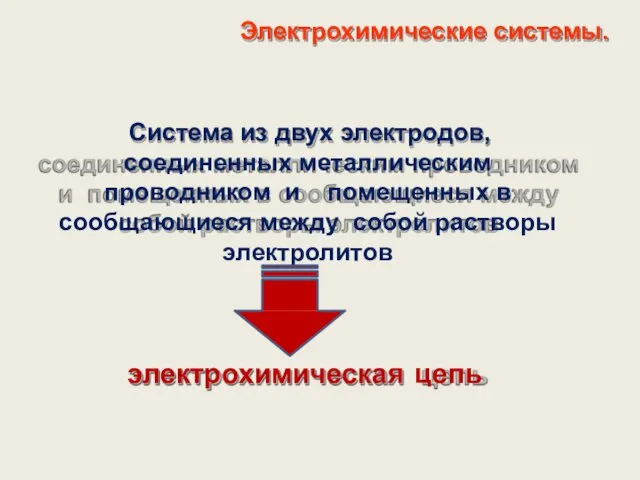
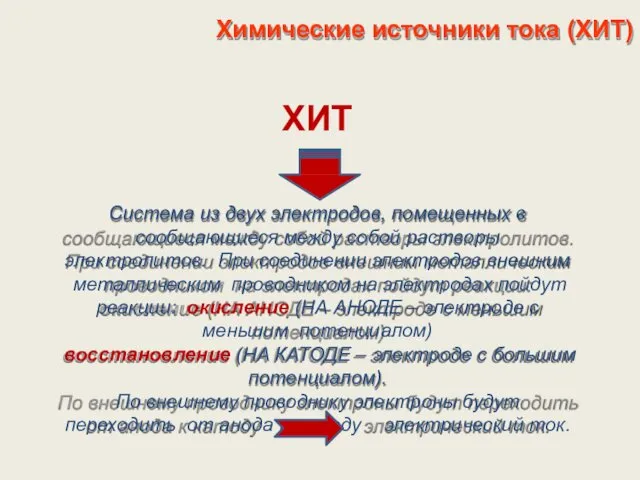
- 9. Электрохимические системы. Система из двух электродов, соединенных металлическим проводником и помещенных в сообщающиеся между собой растворы
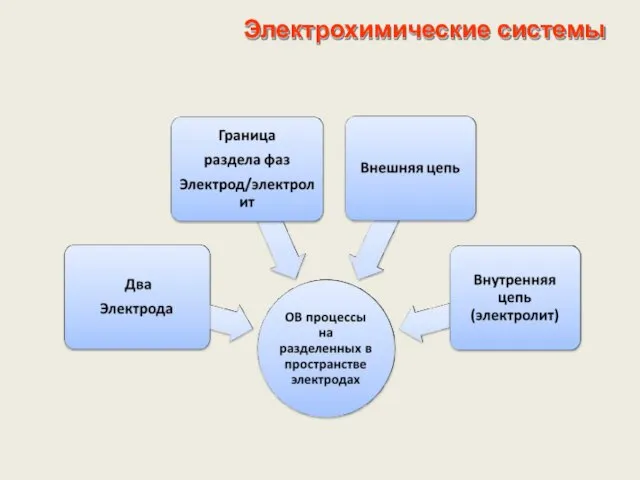
- 10. Электрохимические системы
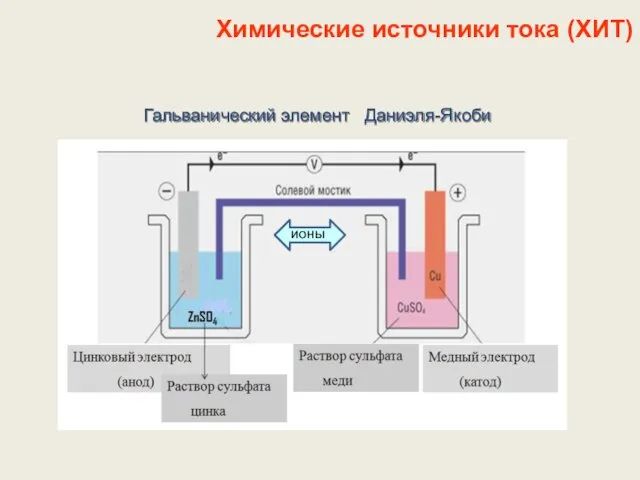
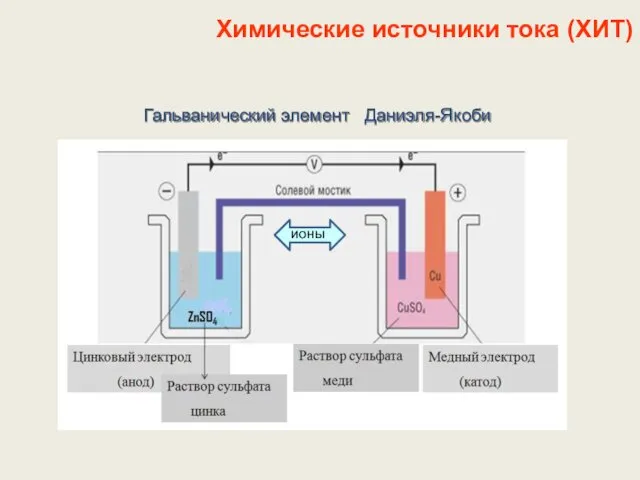
- 11. Химические источники тока (ХИТ) Гальванический элемент Даниэля-Якоби ионы
- 12. Электрохимические системы
- 13. Электрохимические системы
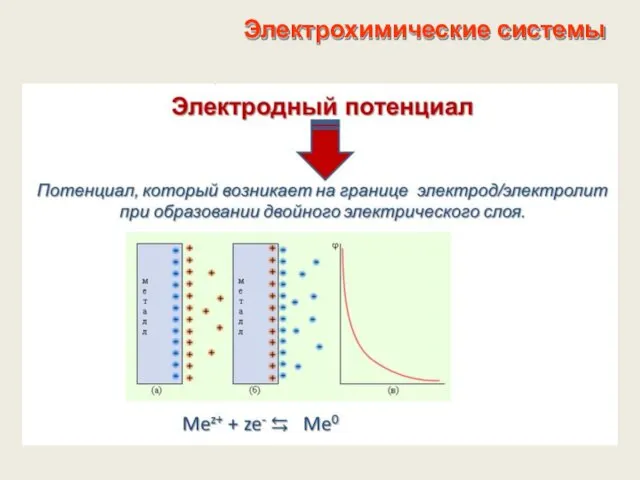
- 14. Электрохимические системы Двойной электрический слой слой из разделенных в пространстве электрических зарядов противоположного знака. Возникает в
- 15. Электрохимические системы
- 16. Электрохимические системы
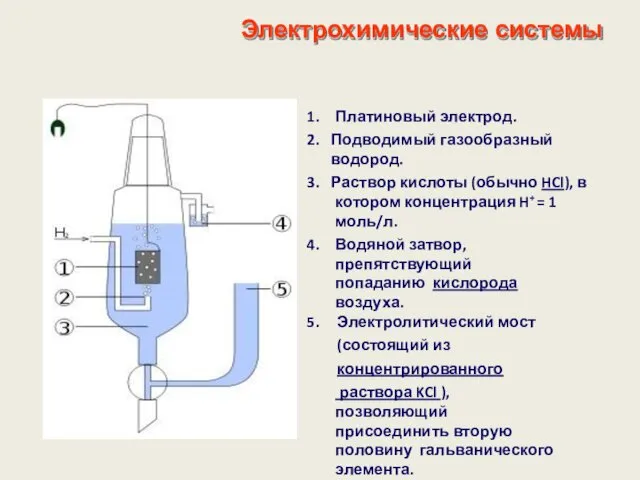
- 17. Электрохимические системы Платиновый электрод. Подводимый газообразный водород. Раствор кислоты (обычно HCl), в котором концентрация H+ =
- 18. Электрохимические системы Уравнение Нернста
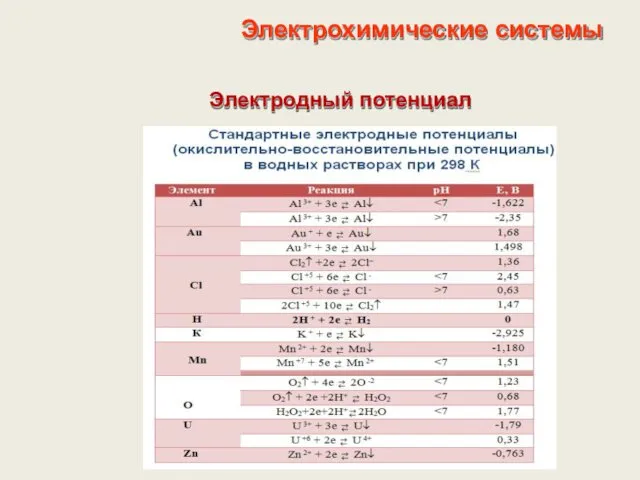
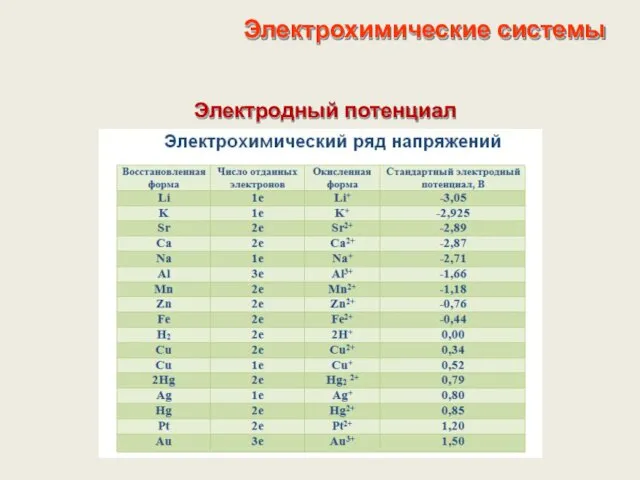
- 19. Электрохимические системы Электродный потенциал
- 20. Электрохимические системы Электродный потенциал
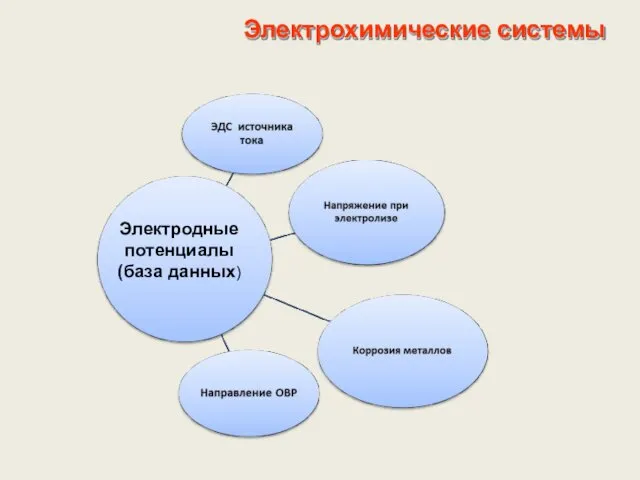
- 21. Электрохимические системы Электродные потенциалы (база данных)
- 22. Химические источники тока (ХИТ) ХИТ электрохимическая система, в которой самопроизвольно энергия химической реакции (ОВР), протекающей на
- 23. Химические источники тока (ХИТ) ХИТ Система из двух электродов, помещенных в сообщающиеся между собой растворы электролитов.
- 24. Химические источники тока (ХИТ) Гальванический элемент Даниэля-Якоби ионы
- 25. Химические источники тока (ХИТ)
- 26. Химические источники тока (ХИТ) Уравнение Нернста для ЭДС ХИТ, составленного из двух металлических электродов
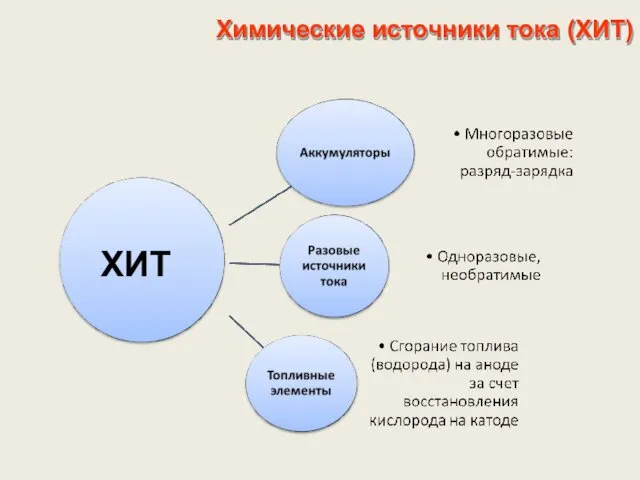
- 27. Химические источники тока (ХИТ) ХИТ
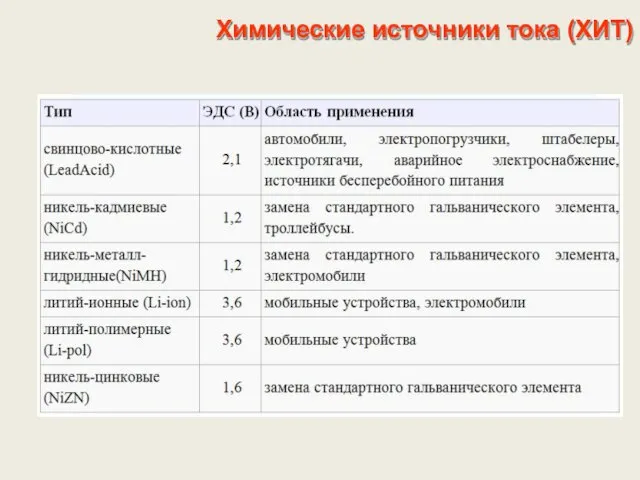
- 28. Химические источники тока (ХИТ)
- 29. Химические источники тока (ХИТ) Свинцово-кислотный аккумулятор (СА) является химическим источником тока (ХИТ), открытым Гастоном Планте в
- 30. Необратимые гальванические элементы Cухие гальванические элементы Zn - 2e → Zn2+ 2NH4++2MnO2+2e→Mn2O3+2NH3+H2O Zn+2NH4Cl+2MnO2→ZnCl2 + Mn2O3+2NH3+H2O Химические
- 31. Водородно-кислородный топливный элемент На катализаторе анода молекулярный водород диссоциирует и теряет электроны Протоны проводятся через мембрану
- 32. Химические источники тока (ХИТ)
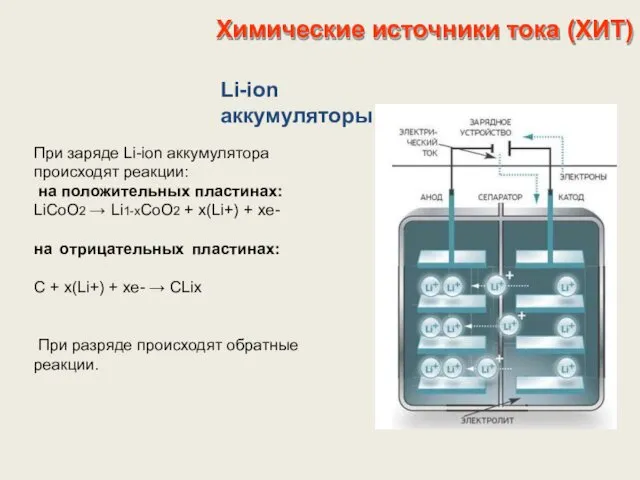
- 33. Химические источники тока (ХИТ) Li-ion аккумуляторы При заряде Li-ion аккумулятора происходят реакции: на положительных пластинах: LiCoO2
- 35. Скачать презентацию













 Базовые требования к проектированию тепловых сетей. Лекция №7
Базовые требования к проектированию тепловых сетей. Лекция №7 Дни воинской славы
Дни воинской славы Психология развития и возрастная психология
Психология развития и возрастная психология 1С:ERP Управление предприятием. Корректный учет доходов розничных продаж и реклассификация расходов для организаций на УСН
1С:ERP Управление предприятием. Корректный учет доходов розничных продаж и реклассификация расходов для организаций на УСН Презентация по природоведению 5 класса Что у земли внутри
Презентация по природоведению 5 класса Что у земли внутри Шаблон Фракталы-1
Шаблон Фракталы-1 Предметно-развивающая среда
Предметно-развивающая среда Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4
Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4 Возрастная анатомия, физиология и гигиена. №1
Возрастная анатомия, физиология и гигиена. №1 Комплексное освоение подземного пространства
Комплексное освоение подземного пространства 20231024_delfin
20231024_delfin Презентация Здравствуй, Масленица
Презентация Здравствуй, Масленица Автобіографія Буранної Каріни
Автобіографія Буранної Каріни Курс R00: Системы и оборудование РЦ
Курс R00: Системы и оборудование РЦ Сюжетно-ролевая игра Семья
Сюжетно-ролевая игра Семья М.А. Булгаков. Сатирические произведения
М.А. Булгаков. Сатирические произведения Виды технического оборудования на предприятиях общественного питания
Виды технического оборудования на предприятиях общественного питания математика 14апреля
математика 14апреля Презентация моих достижений
Презентация моих достижений каталоги и картотеки
каталоги и картотеки Игра Звёздный час Растения леса
Игра Звёздный час Растения леса CPLD - сложные программируемые логические устройства
CPLD - сложные программируемые логические устройства Фразеологизмы. Что это? Как их понять?
Фразеологизмы. Что это? Как их понять? Метод моделирования на уроках географии
Метод моделирования на уроках географии Производственная программа предприятия
Производственная программа предприятия Лексикология. Словообразование. Морфология
Лексикология. Словообразование. Морфология Валянцін Лукша
Валянцін Лукша T7 Electrical Schematic
T7 Electrical Schematic