Содержание
- 2. Вещества ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ Неэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток. Электролиты –
- 3. Почему растворы электролитов проводят электрический ток? Сванте Аррениус (1859-1927) Создал теорию электролитической диссоциации. За исследования в
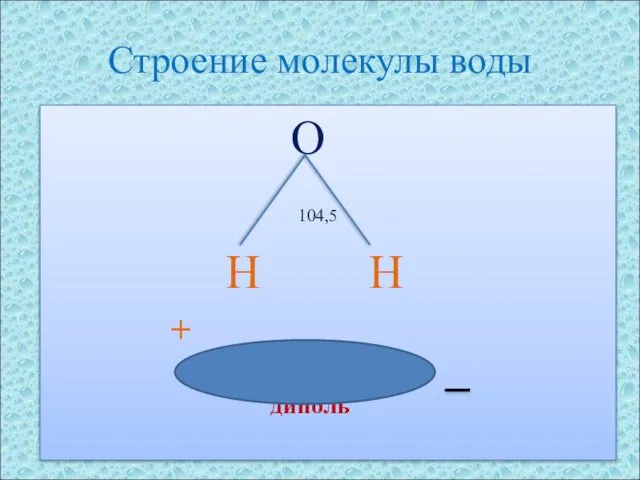
- 4. Строение молекулы воды O 104,5 H H + диполь
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
- 6. Легче всего диссоциируют вещества с ионной и ковалентной полярной связью: Кислоты : HCl, H2SO4, HF, HNO3
- 7. Последовательность процессов, происходящих при электролитической диссоциации: Ориентация молекул – диполей воды около ионов; Гидратация (взаимодействие) молекул
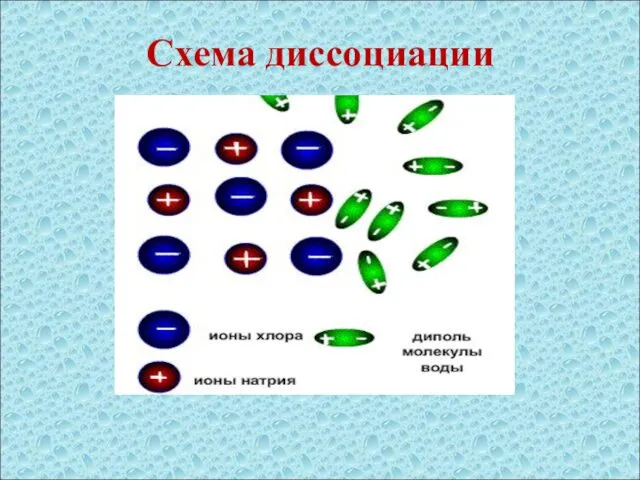
- 8. Схема диссоциации
- 9. Уравнение реакции: NaCl = Na+ + Cl- NaCl – молекула хлорида натрия Na+ - ион натрия
- 10. Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц
- 11. Степень диссоциации выражают в долях или процентах. При ά = 0 диссоциация отсутствует При ά =
- 12. Электролиты Сильные все растворимые соли; сильные кислоты H2SO4, HCl, HNO3 все щелочи NaOH, KOH Слабые слабые
- 14. Скачать презентацию









 Принципы построения систем селекции движущихся целей
Принципы построения систем селекции движущихся целей Биохимия почек
Биохимия почек Шрифты чертежные. 7 класс
Шрифты чертежные. 7 класс Экологические проблемы
Экологические проблемы Производство в Агрохолдинге
Производство в Агрохолдинге Дивное время — зима
Дивное время — зима Meine sommerferien
Meine sommerferien Загальні відомості, будова та принцип роботи систем та пристроїв радіолокаційних станцій (РЛС). Радіоприймальні пристрої ЗРЛ
Загальні відомості, будова та принцип роботи систем та пристроїв радіолокаційних станцій (РЛС). Радіоприймальні пристрої ЗРЛ Хип-хоп. Субкультура
Хип-хоп. Субкультура Физические качества и их развитие
Физические качества и их развитие Гнойные заболевания железистых органов и обширных клетчаточных пространств
Гнойные заболевания железистых органов и обширных клетчаточных пространств Кредитная организация
Кредитная организация Экологический прект
Экологический прект ПАО Газпром
ПАО Газпром Смешанные числа 5. класс
Смешанные числа 5. класс 8-разрядные микроконтроллеры серии AVR Архитектура. Принцип работы. Аппаратные особенности
8-разрядные микроконтроллеры серии AVR Архитектура. Принцип работы. Аппаратные особенности Туристские фирмы и экскурсионные маршруты г. Сочи
Туристские фирмы и экскурсионные маршруты г. Сочи Георгий Победоносец, великомученик. День памяти: 6 мая
Георгий Победоносец, великомученик. День памяти: 6 мая Изосерология. Группы крови
Изосерология. Группы крови Урок по естествознанию Звук и его распространение 5 класс
Урок по естествознанию Звук и его распространение 5 класс день знаний во 2 классе
день знаний во 2 классе Рождество Христово
Рождество Христово Общая характеристика земноводных
Общая характеристика земноводных Усиление металлических конструкций
Усиление металлических конструкций Совместная деятельность
Совместная деятельность Лучше гор могут быть только горы. Фотогалерея гор
Лучше гор могут быть только горы. Фотогалерея гор Энергетические характеристики сталеплавильного производства
Энергетические характеристики сталеплавильного производства Классификация Транспортных судов
Классификация Транспортных судов