Содержание
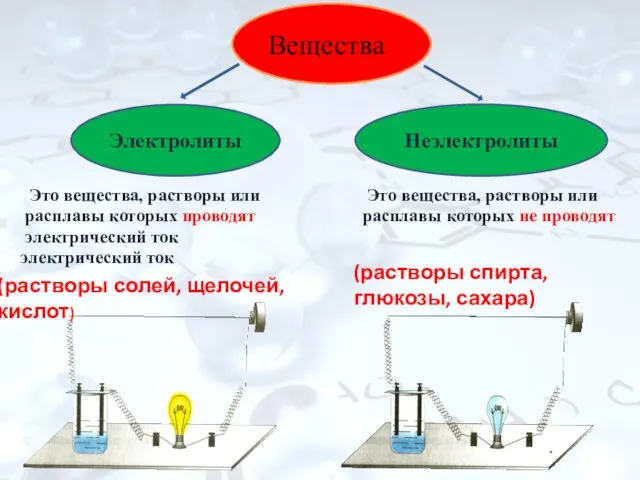
- 3. Это вещества, растворы или Это вещества, растворы или расплавы которых проводят расплавы которых не проводят электрический
- 4. Вид химической связи: ионная или ковалентная сильнополярная Растворимые основания (щелочи): Примеры: NaOH, KOH, Ca(OH)2, Вa(OH)2 Растворимые
- 5. Шведский ученый Сванте Аррениус в 1877 г. пришел к выводу, что причиной электропроводности является наличие в
- 6. Электролитическая диссоциация – процесс распада электролита на ионы при растворении в воде или при расплавлении. Процесс
- 7. Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали,
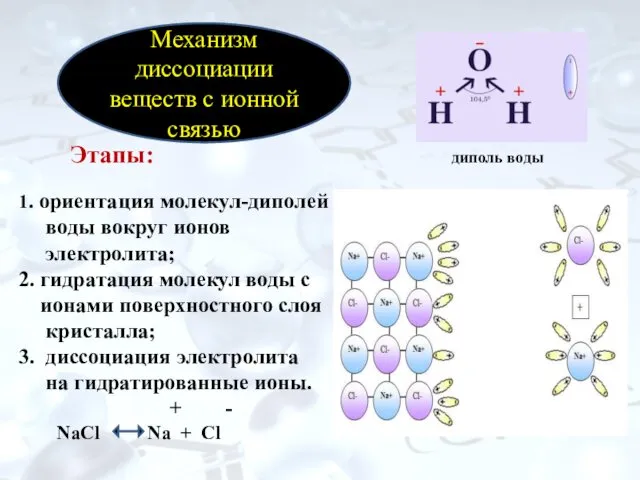
- 8. Этапы: диполь воды 1. ориентация молекул-диполей воды вокруг ионов электролита; 2. гидратация молекул воды с ионами
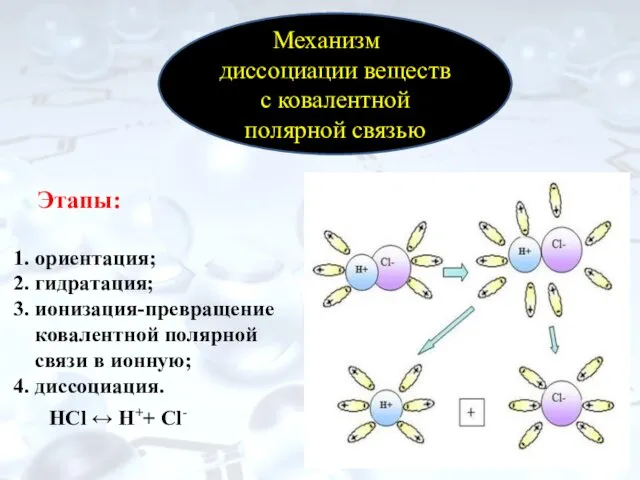
- 10. Этапы: 1. ориентация; 2. гидратация; 3. ионизация-превращение ковалентной полярной связи в ионную; 4. диссоциация. Механизм диссоциации
- 11. Диссоциация, как и растворение, зависит от природы веществ. Одни вещества практически полностью распадаются на ионы, другие
- 12. Степень диссоциации (альфа)- это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц
- 13. При уменьшении концентрации электролита степень его диссоциации возрастает.
- 14. Классификация электролитов Средние Сильные α→1 (α >30%) (α от 3% до 30%) Н2SO4 HCl H3PO4 HNO2
- 16. Скачать презентацию










 Лукойл. Нефтяная компания
Лукойл. Нефтяная компания Презентация к мероприятию Здоровый образ жизни
Презентация к мероприятию Здоровый образ жизни Предмет курса Религиоведение
Предмет курса Религиоведение Как выполнить задание вида Расставить коэффициенты в схемах реакций (8 класс)
Как выполнить задание вида Расставить коэффициенты в схемах реакций (8 класс) Агрегатные станки
Агрегатные станки Презентация к празднику весны 8 Марта
Презентация к празднику весны 8 Марта Обособленные определения
Обособленные определения Ядовитые грибы
Ядовитые грибы Agriculture Dialogue 2015
Agriculture Dialogue 2015 Особенности воспитания детей в буддийских семьях
Особенности воспитания детей в буддийских семьях презентация к литературно - музыкальной композиции Детство, опаленное войной
презентация к литературно - музыкальной композиции Детство, опаленное войной Оптимизация систем электроснабжения и автоматизация технологического процесса котельной станции
Оптимизация систем электроснабжения и автоматизация технологического процесса котельной станции Предвыборная программа Студенческого совета ИУЭС ИТА ЮФУ
Предвыборная программа Студенческого совета ИУЭС ИТА ЮФУ Работа Солнечной электростанции
Работа Солнечной электростанции Валеология на уроках химии. Часть I.
Валеология на уроках химии. Часть I. Такие разные жуки. Коллекции. Занятие №1. Запуск. Постановка проблемы и пути ее решения
Такие разные жуки. Коллекции. Занятие №1. Запуск. Постановка проблемы и пути ее решения На Неве в древние времена
На Неве в древние времена Новые типы редакционных структур
Новые типы редакционных структур Викторина Собаки, страна в которой выведены и для чего?
Викторина Собаки, страна в которой выведены и для чего? Закон нормального распределения в психологии. Общие принципы проверки статистических гипотез в психологии
Закон нормального распределения в психологии. Общие принципы проверки статистических гипотез в психологии Вышивка
Вышивка 9 мая 1945 – День победы
9 мая 1945 – День победы Управление государственными и частными предприятиями
Управление государственными и частными предприятиями Исполнение токовых цифровых защит
Исполнение токовых цифровых защит История России. Роль и место России в мировой истории. (6 класс)
История России. Роль и место России в мировой истории. (6 класс) Установка дверных и оконных петель
Установка дверных и оконных петель Загрузка и выгрузка транспортных средств(
Загрузка и выгрузка транспортных средств( 20230707_1.a.svoystvo_stepeni_s_naturalnym_pokazatelem
20230707_1.a.svoystvo_stepeni_s_naturalnym_pokazatelem