1. В каком из перечисленных соединений степень окисления фосфора +3
А)
Р2О5; Б) NaPO3; В) PCl3
2. В какой из приведенных пар оба вещества взаимодействуют с фосфором:
А) кальций и соляная кислота; Б) натрий и хлор; В) кислород и соляная кислота.
А
Б
В
3. Составьте уравнение реакции фосфора с кальцием. Коэффициент перед
формулой окислителя: А) 2; Б) 3); В) 1.
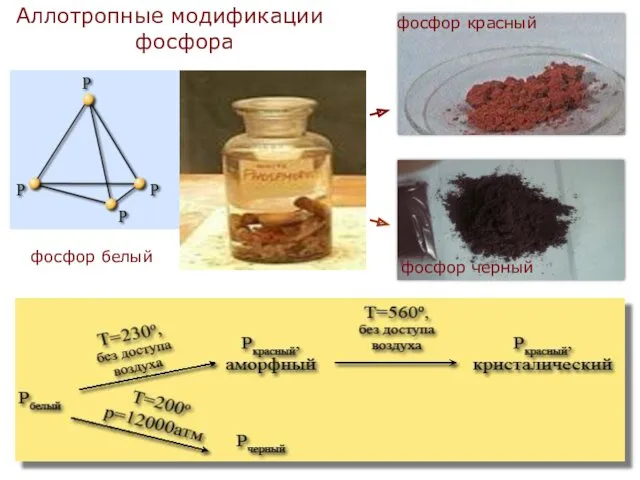
4. Как хранят красный фосфор в лаборатории:
А) под слоем воды; Б) под слоем керосина; В) в обычных условиях.
В
5. Фосфор образует простое вещество с молекулярной кристаллической решеткой,
в узлах которой находятся молекулы Р4. какой цвет имеет такой фосфор:
А) красный; Б) желтый; В) зеленый.
Б
6. Степень окисления фосфора увеличивается в ряду:
А) PH3, P2O3, H3PO4; Б) Na3PO4, P2O5, HPO3; В) Ca3P2, PH3, NaPO3
А
7. Какое из утверждений неверно: «Атом фосфора по сравнению с атомом азота
имеет»:
А) больший радиус; Б) больший заряд ядра;
В) более ярко выраженные неметаллические свойства.
В













 Выделение нуклеиновых кислот из различного клинического материала. ПЦР и электрофорез в медицинской генетике
Выделение нуклеиновых кислот из различного клинического материала. ПЦР и электрофорез в медицинской генетике Воспитательная система класса
Воспитательная система класса Дионисий (около 1440 - около 1505)
Дионисий (около 1440 - около 1505) Конспект и презентация к занятию Декоративная бабочка
Конспект и презентация к занятию Декоративная бабочка Основные климатические факторы и их воздействия на здания
Основные климатические факторы и их воздействия на здания Психотропные средства. Нейролептики. Транквилизаторы
Психотропные средства. Нейролептики. Транквилизаторы Численное дифференцирование и интегрирование функций
Численное дифференцирование и интегрирование функций Портландцемент. Химический состав
Портландцемент. Химический состав Инновационные технологии социальной работы с пожилыми людьми
Инновационные технологии социальной работы с пожилыми людьми Презентация Что такое библиотека
Презентация Что такое библиотека 562г Метелинское. ООО Башнефть-Добыча
562г Метелинское. ООО Башнефть-Добыча Ар намысты, қадір-қасиетті және іскерлік бедел
Ар намысты, қадір-қасиетті және іскерлік бедел Приемы письменного сложения и вычитания в пределах 1000
Приемы письменного сложения и вычитания в пределах 1000 Выборы и референдумы. Участие граждан в политической жизни. Опасность политического экстремизма
Выборы и референдумы. Участие граждан в политической жизни. Опасность политического экстремизма Презентация к статье Я-сетевой преподаватель
Презентация к статье Я-сетевой преподаватель Тепловые схемы теплогенерирующих установок
Тепловые схемы теплогенерирующих установок Лекции - Операционные усилители(1)
Лекции - Операционные усилители(1) Дидактические игры на автоматизацию и дифференциацию звуков.
Дидактические игры на автоматизацию и дифференциацию звуков. I like english
I like english Проект по развитию исторической части города Череповца Сердце города
Проект по развитию исторической части города Череповца Сердце города Организация режима дня школьника
Организация режима дня школьника Компоненты СВЧ. Особенности волн СВЧ диапазона
Компоненты СВЧ. Особенности волн СВЧ диапазона Портфолио педагога дополнительного образования (Презентация)
Портфолио педагога дополнительного образования (Презентация) Движение воздуха. Ветер
Движение воздуха. Ветер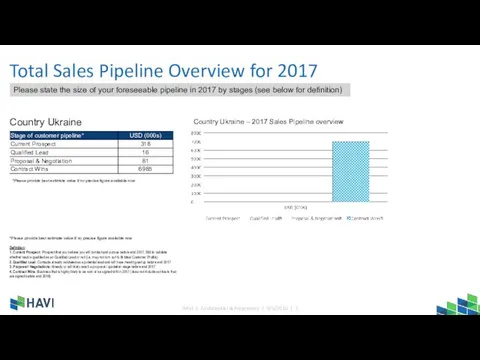 Total Sales Pipeline Overview for 2017
Total Sales Pipeline Overview for 2017 This page: Possible style suggestion Pages 2 – 20 – the sketch items
This page: Possible style suggestion Pages 2 – 20 – the sketch items Открытое занятие по народоведению Чувашская Республика
Открытое занятие по народоведению Чувашская Республика Анатомия и физиология кровообращения. Синдром малого выброса
Анатомия и физиология кровообращения. Синдром малого выброса