Содержание
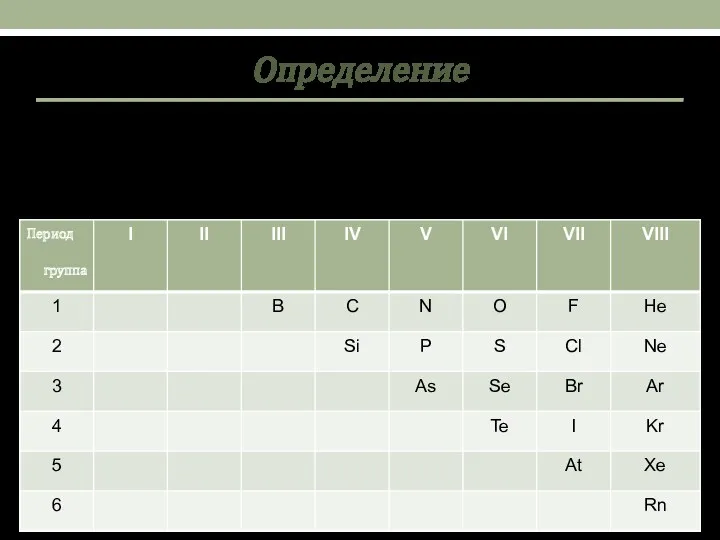
- 2. Определение Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
- 3. Химическая связь В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая
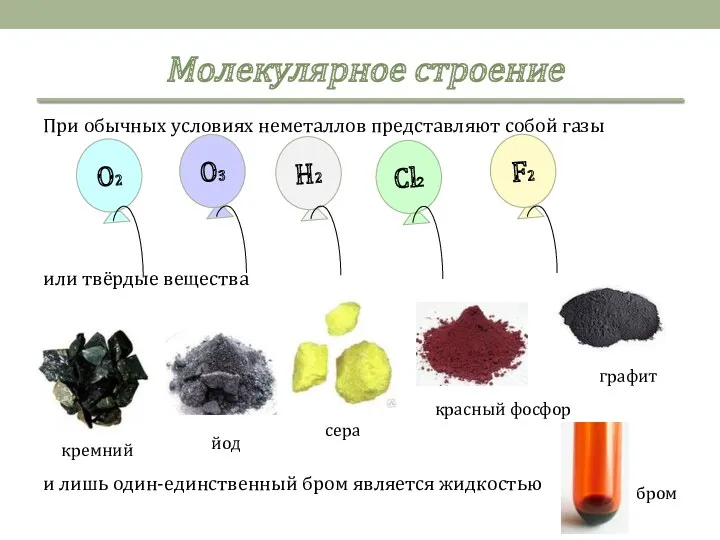
- 4. Молекулярное строение При обычных условиях неметаллов представляют собой газы или твёрдые вещества и лишь один-единственный бром
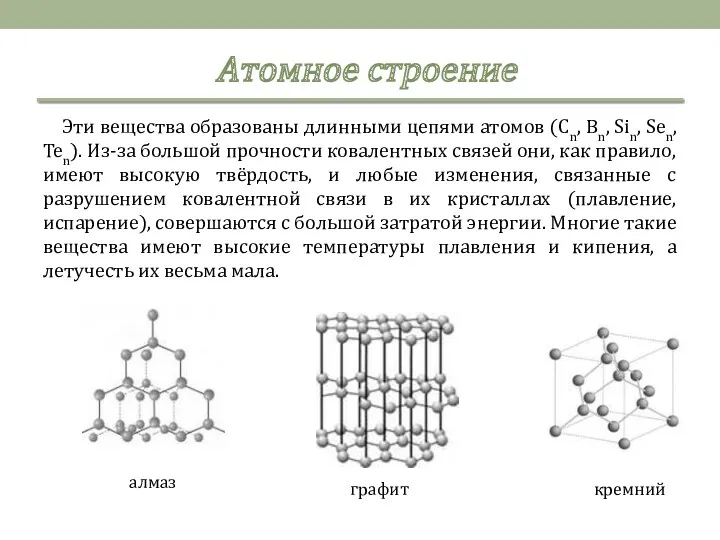
- 5. Эти вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten). Из-за большой прочности ковалентных связей
- 6. Химические свойства Для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные,
- 7. Окислительные свойства сульфид натрия хлорид железа(III) нитрид магния
- 8. Окислительные свойства сероводород хлороводород аммиак t◦ свет p,t◦, катал.
- 9. Окислительные свойства H, Si, As, P, Se, C, S, I, Br, Cl, N, O, F Усиление
- 10. Окислительные свойства
- 11. Окислительные свойства
- 12. Окислительные свойства свет
- 13. Восстановительные свойства t◦ t◦ несолеобразующий оксид солеобразующий кислотный оксид
- 14. Восстановительные свойства t◦ t◦
- 15. Восстановительные свойства
- 17. Скачать презентацию











 Show What Animals you know
Show What Animals you know Химическая промышленность США
Химическая промышленность США Миотоническая дистрофия Россолимо-Штейнерта-Куршманна-Баттена
Миотоническая дистрофия Россолимо-Штейнерта-Куршманна-Баттена Рабочая программа педагога в соответствии с ФГОС ДОО
Рабочая программа педагога в соответствии с ФГОС ДОО Политические партии в России в начале XX века
Политические партии в России в начале XX века Обобщение знаний по теме Изучение природы
Обобщение знаний по теме Изучение природы Итоговое сочинение. Критерии оценивания
Итоговое сочинение. Критерии оценивания Гимнастика для глаз (физкультминутка)
Гимнастика для глаз (физкультминутка) Игумения Агния (Благовещенская)
Игумения Агния (Благовещенская) Жан-Батист Поклен (Мольер)
Жан-Батист Поклен (Мольер)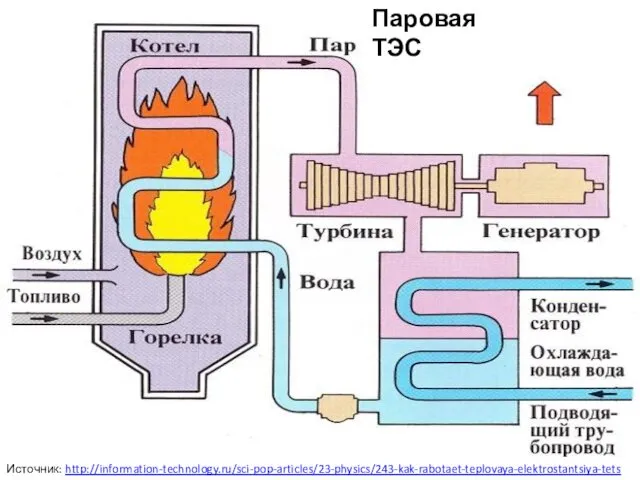 Паровая ТЭС
Паровая ТЭС Развитие учащихся 1 класса в процессе формирования универсальных учебных действий по программе ПНШ.
Развитие учащихся 1 класса в процессе формирования универсальных учебных действий по программе ПНШ. Канский технологический колледж
Канский технологический колледж Фотоотчет воспитательной работы в 1 Б классе за 2014-2015 учебный год
Фотоотчет воспитательной работы в 1 Б классе за 2014-2015 учебный год Захар Прилепин
Захар Прилепин Традыцыйная матэрыяльная культура Беларусаў
Традыцыйная матэрыяльная культура Беларусаў Решение квадратных уравнений
Решение квадратных уравнений NAMT_prezintatsia
NAMT_prezintatsia Книга Иисуса Навина. Завоевание Земли Обетованной
Книга Иисуса Навина. Завоевание Земли Обетованной Сочинения по тексту Ю. Олеши
Сочинения по тексту Ю. Олеши Использование сказок в коррекционно - профилактической работе с целью решения проблем эмоциональной нестабильности у дошкольников
Использование сказок в коррекционно - профилактической работе с целью решения проблем эмоциональной нестабильности у дошкольников История из жизни солдата…
История из жизни солдата… Карьера специалиста по работе с молодежью
Карьера специалиста по работе с молодежью Конкурсное задание - Методический семинар, презентация
Конкурсное задание - Методический семинар, презентация Человеческие расы, их родство и происхождение
Человеческие расы, их родство и происхождение справочник по химии для 8 класса
справочник по химии для 8 класса Барак Обама
Барак Обама Взаимодействие ребёнок-педагог-родитель в образовательном пространстве МУ ДО Красноселькупский центр дополнительного образования детей
Взаимодействие ребёнок-педагог-родитель в образовательном пространстве МУ ДО Красноселькупский центр дополнительного образования детей