Содержание
- 2. Установите соответствие: 1. Молекулы движутся с огромными скоростями. 2. Тела сохраняют форму и объем. 3. Атомы
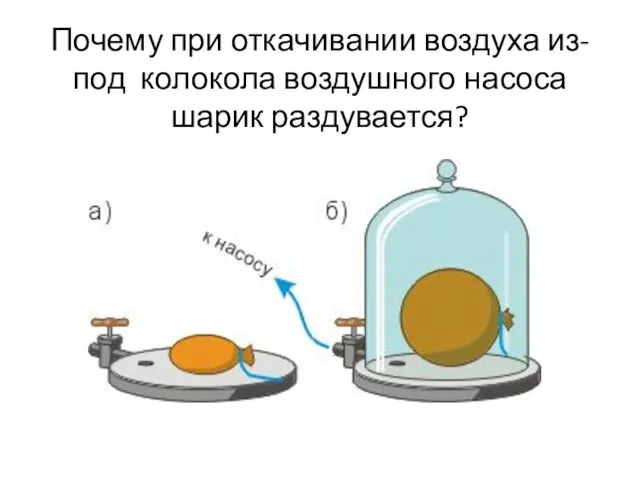
- 4. Почему при откачивании воздуха из-под колокола воздушного насоса шарик раздувается?
- 5. Макроскопические параметры Величины, характеризующие состояние макроскопических тел без учёта их молекулярного строения, называют макроскопическими или термодинамическими
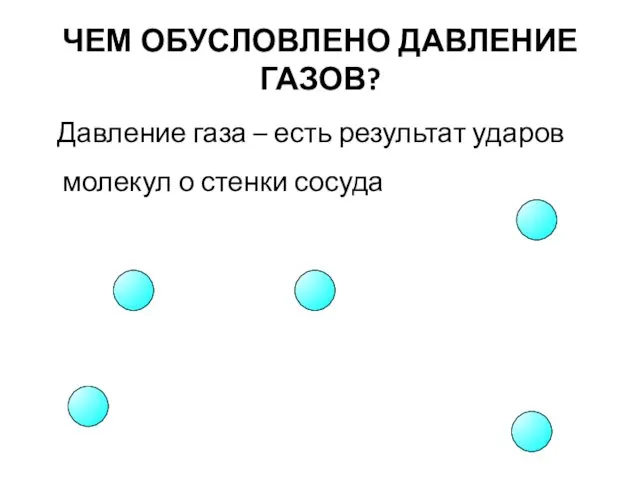
- 6. ЧЕМ ОБУСЛОВЛЕНО ДАВЛЕНИЕ ГАЗОВ? Давление газа – есть результат ударов молекул о стенки сосуда
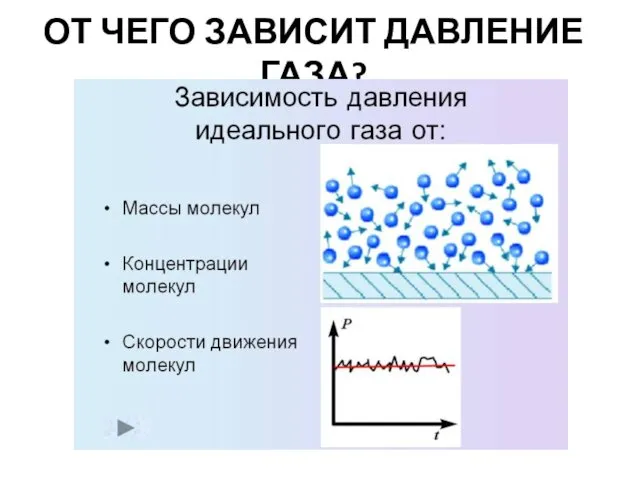
- 7. ОТ ЧЕГО ЗАВИСИТ ДАВЛЕНИЕ ГАЗА?
- 8. Идеальный газ – модель реального газа, согласно которой молекулы газа можно рассматривать как материальные точки, взаимодействие
- 9. Идеальный газ Расстояние между молекулами >d. Молекулы упругие шары. Силы притяжения стремятся к 0. Отталкивание –
- 10. Идеальный газ Реальный газ 1. Совокупность большого числа молекул массой m0, размерами молекул пренебрегают. 2. Молекулы
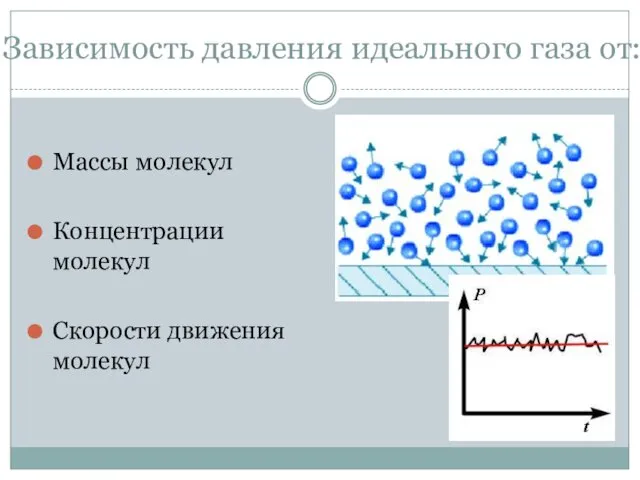
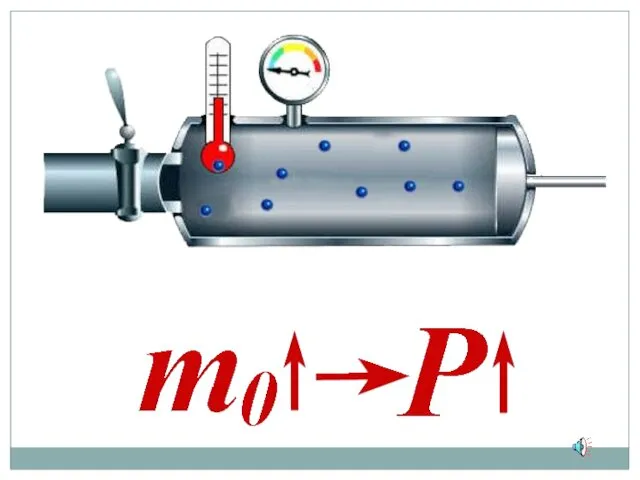
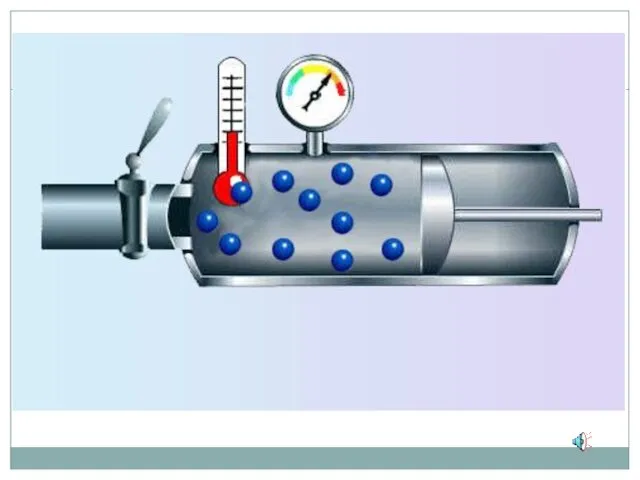
- 12. Зависимость давления идеального газа от: Массы молекул Концентрации молекул Скорости движения молекул
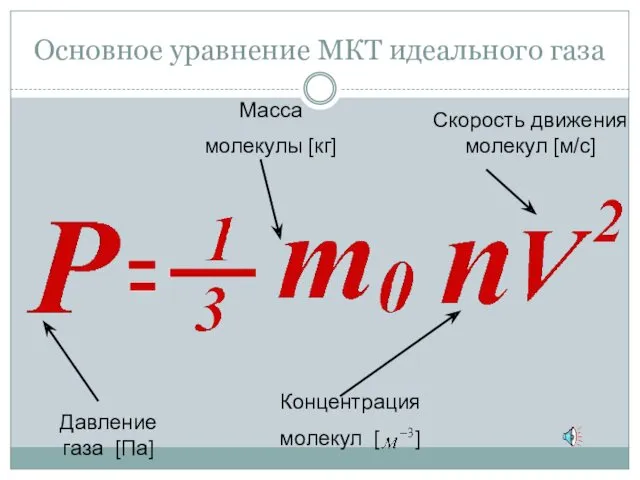
- 17. Основное уравнение МКТ идеального газа
- 18. Основное уравнение МКТ Давление идеального газа прямо пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату
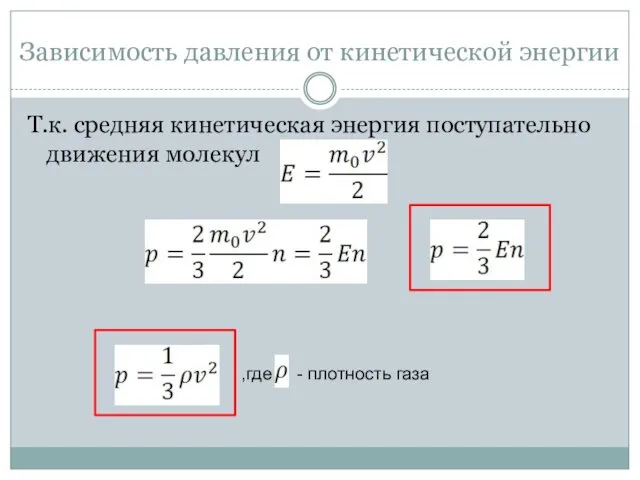
- 19. Зависимость давления от кинетической энергии Т.к. средняя кинетическая энергия поступательно движения молекул ,где - плотность газа
- 20. Задача. Каково давление азота, если средняя квадратичная скорость его молекул 500 м/с, а его плотность 1,35?
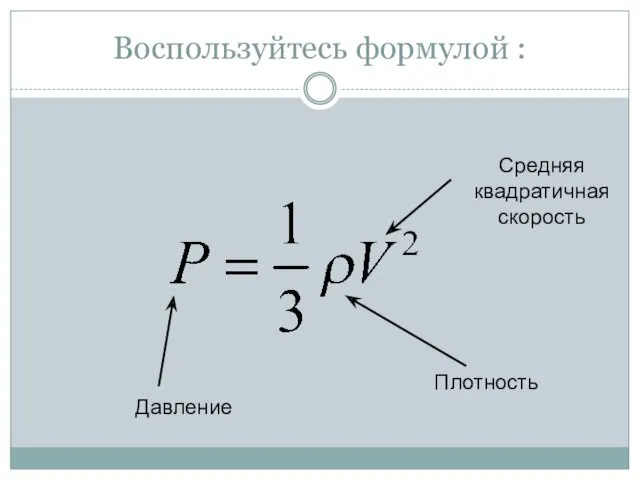
- 21. Плотность Воспользуйтесь формулой :
- 22. Решение: Ответ: 112,5кПа
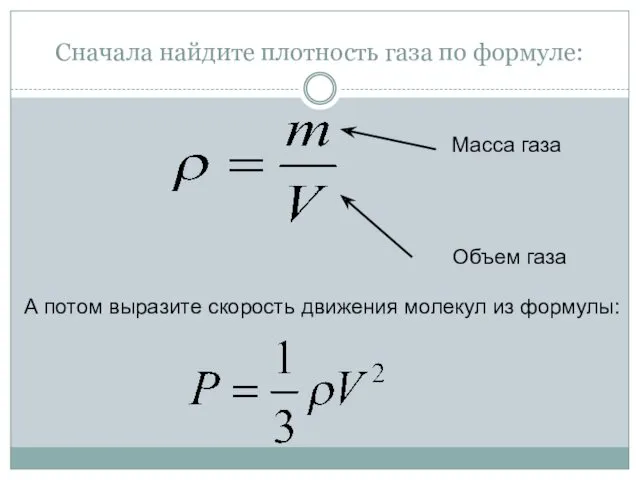
- 23. Сначала найдите плотность газа по формуле: А потом выразите скорость движения молекул из формулы:
- 24. Решение: Ответ: 707 м/с
- 26. Скачать презентацию












 Уроженцы Бабушкинского района - Герои Советского Союза
Уроженцы Бабушкинского района - Герои Советского Союза Парадоксы жизни
Парадоксы жизни Тест по теме Арктические пустыни, тундра, лесотундра
Тест по теме Арктические пустыни, тундра, лесотундра Образовательной программы дошкольной образовательной организации
Образовательной программы дошкольной образовательной организации ТРЕНАЖЕРНО- ИНФОРМАЦИОННАЯ СИСТЕМА ТИСА В ШКОЛЬНОЙ ПРОГРАММЕ НА УРОКАХ ЛФК
ТРЕНАЖЕРНО- ИНФОРМАЦИОННАЯ СИСТЕМА ТИСА В ШКОЛЬНОЙ ПРОГРАММЕ НА УРОКАХ ЛФК Dwayne Douglas Johnson
Dwayne Douglas Johnson Операционные усилители
Операционные усилители Бизнес-планирование. Модуль 6
Бизнес-планирование. Модуль 6 Похититель рассудка
Похититель рассудка Осложнения повреждений опорно-двигательного аппарата
Осложнения повреждений опорно-двигательного аппарата Past Simple
Past Simple speakout
speakout Жилища народов России в старину
Жилища народов России в старину Спектры и спектральный анализ
Спектры и спектральный анализ Заболевания сердечно-сосудистой системы
Заболевания сердечно-сосудистой системы Достижения педагога
Достижения педагога Эксперту: Структура и содержание устной части
Эксперту: Структура и содержание устной части дыхательная недостаточность
дыхательная недостаточность fb-5fa0bf70
fb-5fa0bf70 Презентация Развиваем мелкую моторику рук
Презентация Развиваем мелкую моторику рук Презентация Озера
Презентация Озера Массаж
Массаж Дополнительные авторские программы художественно - эстетической направленности: ХУДОЖЕСТВЕННЫЙ ЯЗЫК ИЗОБРАЗИТЕЛЬНОГО ИСКУССТВА, СМОТРЮ НА МИР ГЛАЗАМИ ХУДОЖНИКА, ВОЛШЕБНЫЕ СЕКРЕТЫ ХУДОЖНИКА, В МИРЕ ХУДОЖ
Дополнительные авторские программы художественно - эстетической направленности: ХУДОЖЕСТВЕННЫЙ ЯЗЫК ИЗОБРАЗИТЕЛЬНОГО ИСКУССТВА, СМОТРЮ НА МИР ГЛАЗАМИ ХУДОЖНИКА, ВОЛШЕБНЫЕ СЕКРЕТЫ ХУДОЖНИКА, В МИРЕ ХУДОЖ Tsesnabank
Tsesnabank Технология культурных практик (коллекционирование)
Технология культурных практик (коллекционирование) Военно-промышленный комплекс
Военно-промышленный комплекс Понятие об органах растений. Корень
Понятие об органах растений. Корень РАЗВИВАЮЩАЯ СРЕДА В КОРРЕКЦИОННОЙ ГРУППЕ ЗНАЙКИ ПО ФГОС
РАЗВИВАЮЩАЯ СРЕДА В КОРРЕКЦИОННОЙ ГРУППЕ ЗНАЙКИ ПО ФГОС