Содержание
- 2. Преподаватель Калинина Мария Александровна д.х.н. (специальности – физическая химия, коллоидная химия), профессор РАН Ведущий научный сотрудник
- 3. Индустриальная коллоидная химия: программа Современная коллоидная химия: основные понятия и положения Прикладные аспекты химии поверхностно-активных веществ
- 4. Знать ≠ понимать Понимать значение и структуру коллоидной химии Получить мотивацию в ее изучении Закрепить уверенность
- 5. Утро в коллоидном лесу
- 6. Современная коллоидная химия: основные понятия и положения
- 7. Коллоиды в нашей жизни Пены Молоко Пена Аэрогель Краски Кровь Смог Моющие средства Косметика
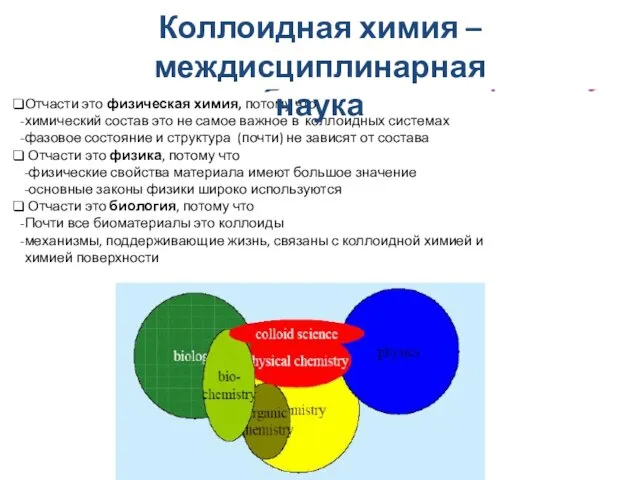
- 8. Коллоидная химия – междисциплинарная область Отчасти это физическая химия, потому что: химический состав это не самое
- 9. Что такое коллоидные системы? Простого определения не существует Промежуточное состояние между суспензией и раствором Состоят из
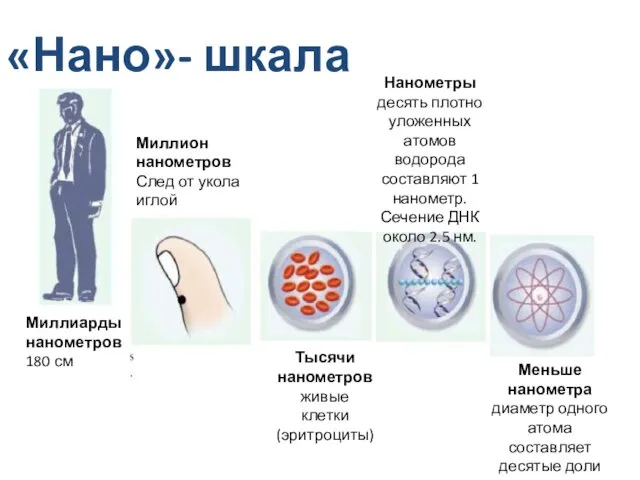
- 10. «Нано»- шкала Миллиарды нанометров 180 см Миллион нанометров След от укола иглой Тысячи нанометров живые клетки
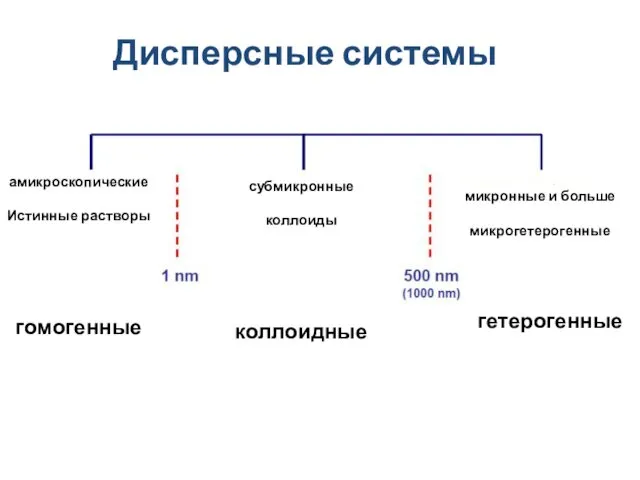
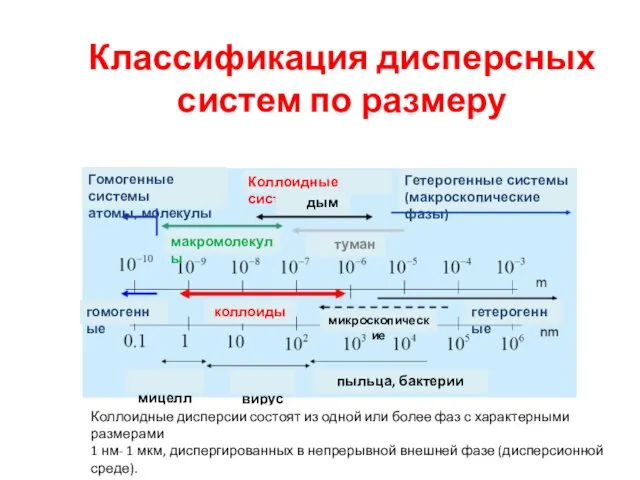
- 11. Дисперсные системы амикроскопические Истинные растворы гомогенные микронные и больше микрогетерогенные субмикронные коллоиды коллоидные гетерогенные
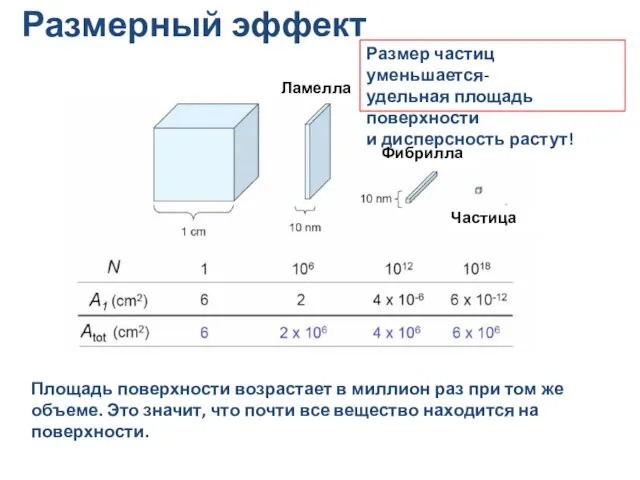
- 12. Размерный эффект Ламелла Фибрилла Частица Площадь поверхности возрастает в миллион раз при том же объеме. Это
- 13. Классификация дисперсных систем по размеру Истинные растворы («молекулярные дисперсии») молекулы, ионы в газовой или жидкой фазе
- 14. Классификация дисперсных систем по размеру Гомогенные системы атомы, молекулы Гетерогенные системы (макроскопические фазы) гетерогенные гомогенные Коллоидные
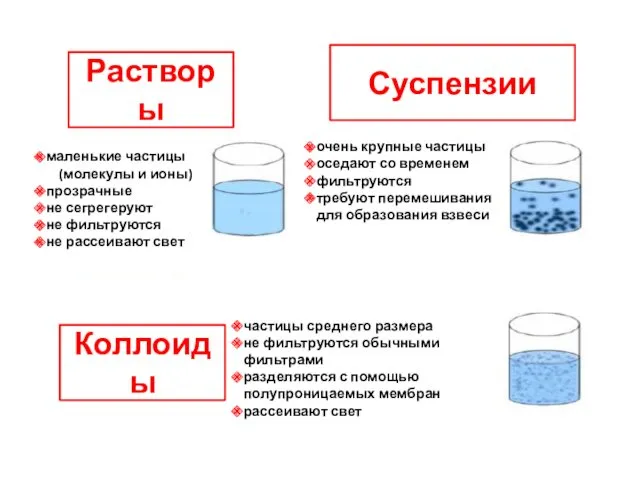
- 15. Растворы Коллоиды Суспензии маленькие частицы (молекулы и ионы) прозрачные не сегрегеруют не фильтруются не рассеивают свет
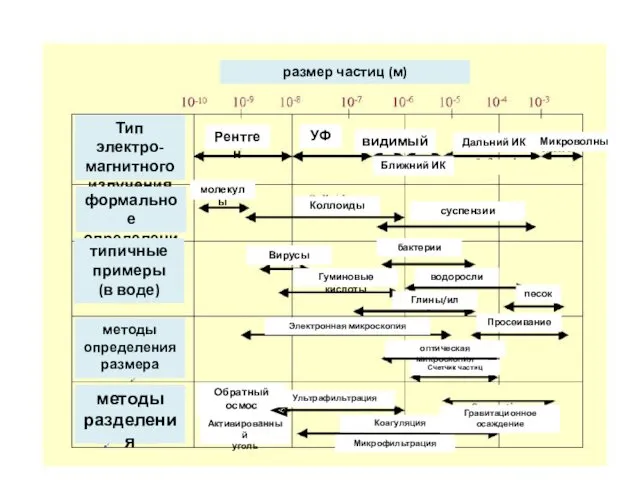
- 16. размер частиц (м) Тип электро-магнитного излучения формальное определение типичные примеры (в воде) методы определения размера методы
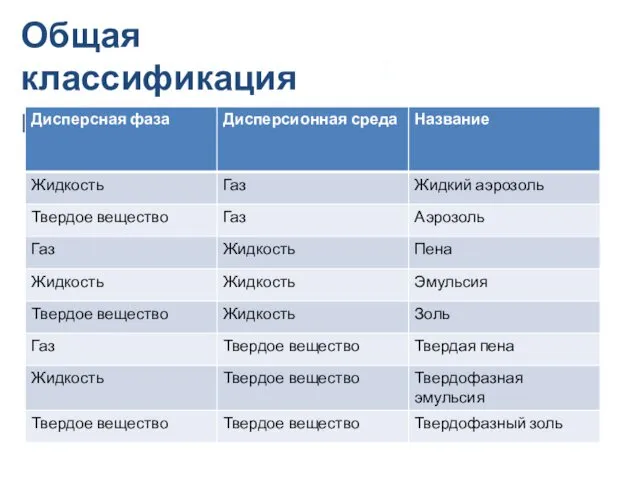
- 17. Общая классификация коллоидов
- 18. Классификация дисперсных систем по агрегатному/фазовому состоянию Ж/Г: туман, водяная дымка, спрей (жидкие аэрозоли) Т/Г: дым, зола,
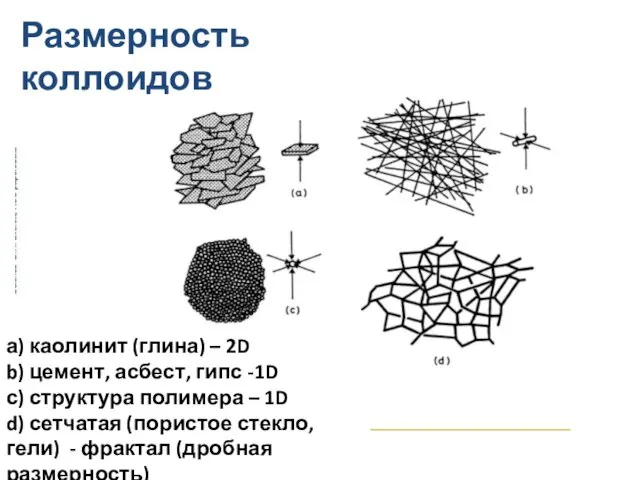
- 19. Размерность коллоидов а) каолинит (глина) – 2D b) цемент, асбест, гипс -1D с) структура полимера –
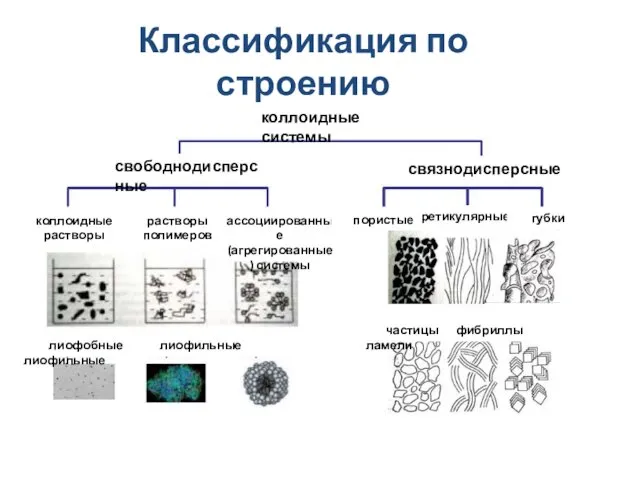
- 20. Классификация по строению коллоидные системы свободнодисперсные связнодисперсные коллоидные растворы растворы полимеров ассоциированные (агрегированные) системы пористые ретикулярные
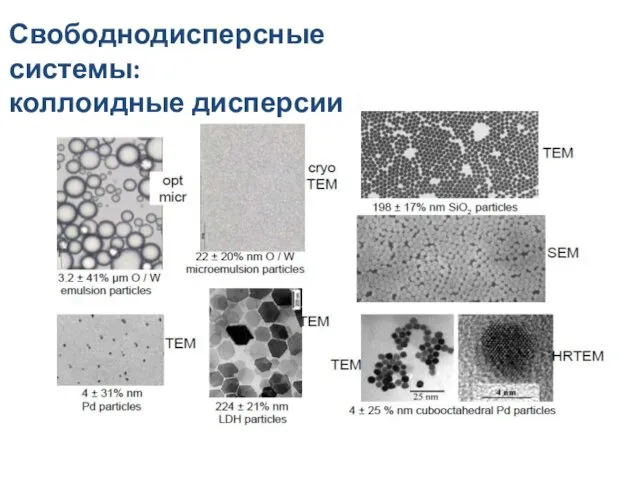
- 21. Свободнодисперсные системы: коллоидные дисперсии
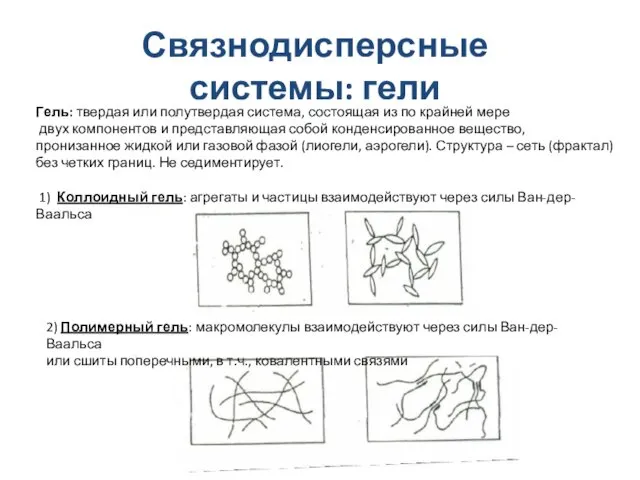
- 22. Связнодисперсные системы: гели Гель: твердая или полутвердая система, состоящая из по крайней мере двух компонентов и
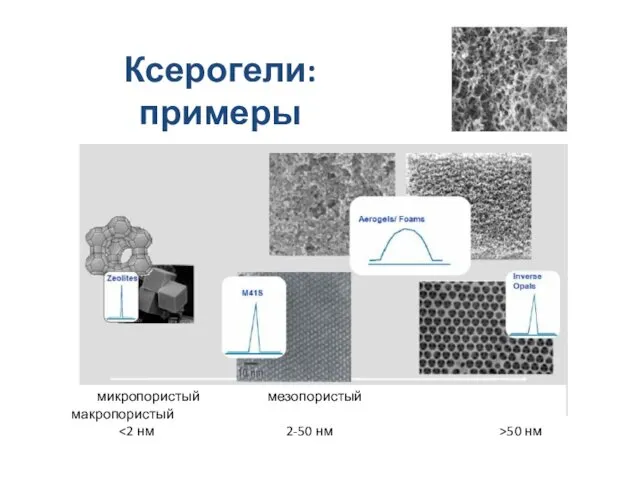
- 23. Связнодисперсные системы: ксерогели и аэрогели Жидкая среда удалена, пористость увеличивается, структура связей между частицами сохраняется, вес
- 24. Ксерогели: примеры микропористый мезопористый макропористый 50 нм
- 25. Связнодисперсные системы: лиогели (гидрогели и органогели) Желатин (гидрогель)
- 26. Устойчивость лиофильных и и лиофобных коллоидов Коллоидные дисперсии: лиофобные коллоиды Термодинамически нестабильны, могут обладать кинетической устойчивостью
- 27. Неустойчивость коллоидных дисперсий Взаимодействия между молекулами одного вещества с молекулами другого почти всегда требуют большей энергии
- 28. Флокуляция Потерю устойчивости коллоидной системы можно разбить на несколько стадий. отдельные частицы димеры агрегат гравитационное осаждение
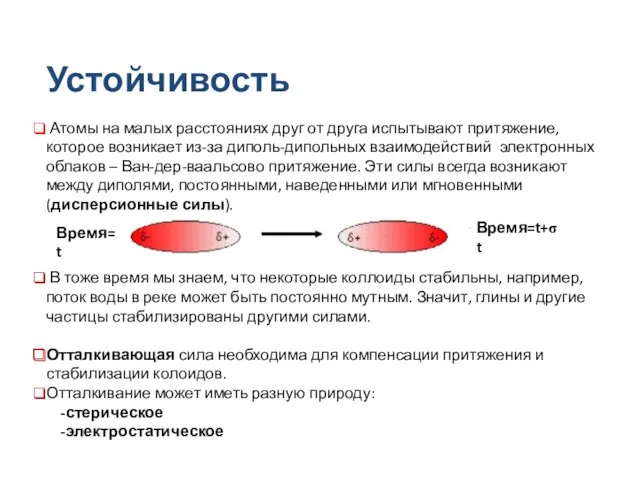
- 29. Устойчивость коллоидов Атомы на малых расстояниях друг от друга испытывают притяжение, которое возникает из-за диполь-дипольных взаимодействий
- 30. Устойчивость коллоидов В воде и водных растворах подавляющее большинство поверхностей электрически заряжены. Заряд может возникать по
- 31. Электростатическое отталкивание Заряд на поверхности приводит к возникновению двойного электрического слоя вблизи твердой поверхности. Слой зарядов
- 32. Дебаевская длина Дебаевская длина это мера толщины диффузного слоя. Диффузный слой распространяется от поверхности в глубину
- 33. Правило Харди-Шульца Флокуляция зависит от валентности противоиона (добавленного электролита с зарядом, противоположным заряду поверхности) Для снятия
- 34. Структурно-механический барьер В случаях, когда на поверхности коллоидной частицы адсорбирован «пушистый» слой полимера, часто наблюдается короткодействующее
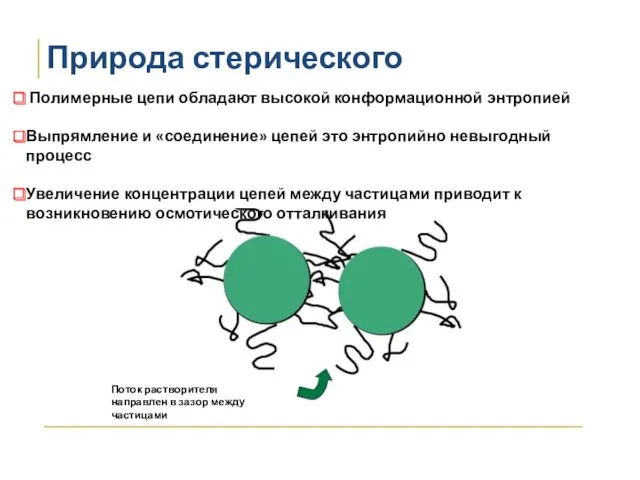
- 35. Природа стерического отталкивания Полимерные цепи обладают высокой конформационной энтропией Выпрямление и «соединение» цепей это энтропийно невыгодный
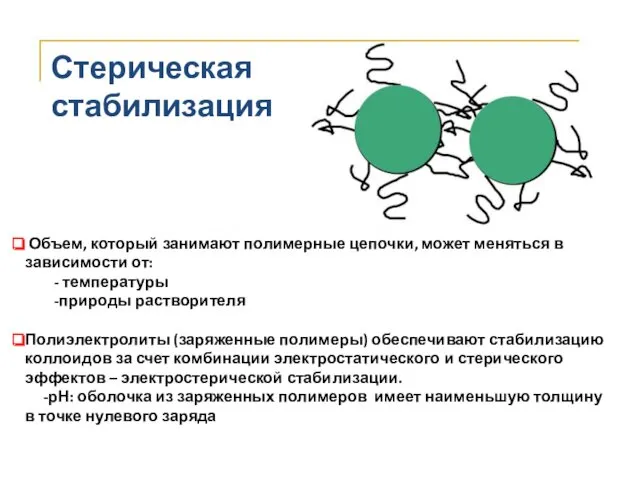
- 36. Стерическая стабилизация Объем, который занимают полимерные цепочки, может меняться в зависимости от: - температуры -природы растворителя
- 37. Факторы неустойчивости коллоидов Коагуляция и флокуляция это процессы, приводящие к потере устойчивости коллоидной системы с образованием
- 38. Осмос, фильтрация и диализ
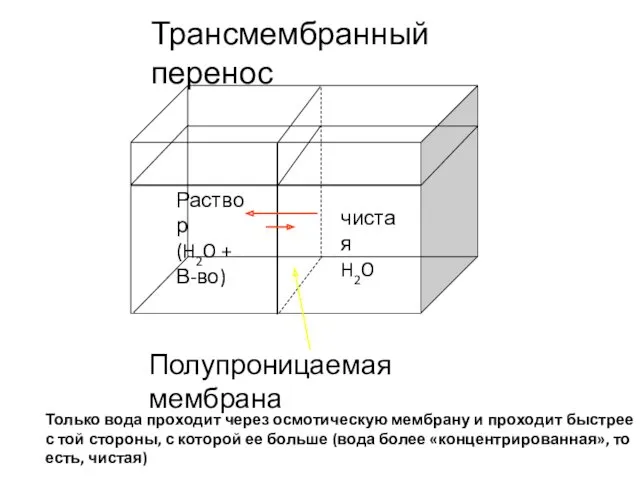
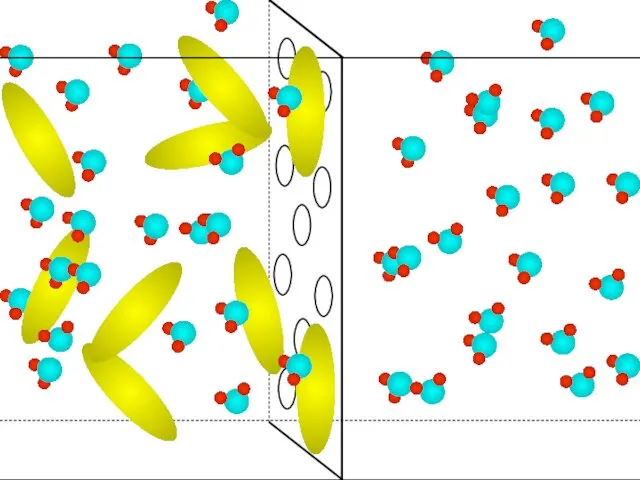
- 39. Полупроницаемая мембрана чистая H2O Раствор (H2O + В-во) Трансмембранный перенос Только вода проходит через осмотическую мембрану
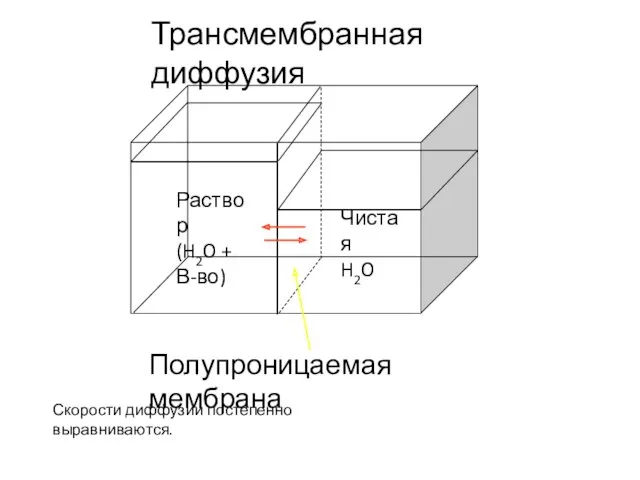
- 40. Полупроницаемая мембрана Чистая H2O Раствор (H2O + В-во) Трансмембранная диффузия Скорости диффузии постепенно выравниваются.
- 42. H2O H2O + В-во Осмотическое давление Если приложенное давление слишком мало, H2O вода течет в область
- 43. H2O H2O + В-во Осмотическое давление Если приложенное давление слишком высокое, то вода потечет в сторону
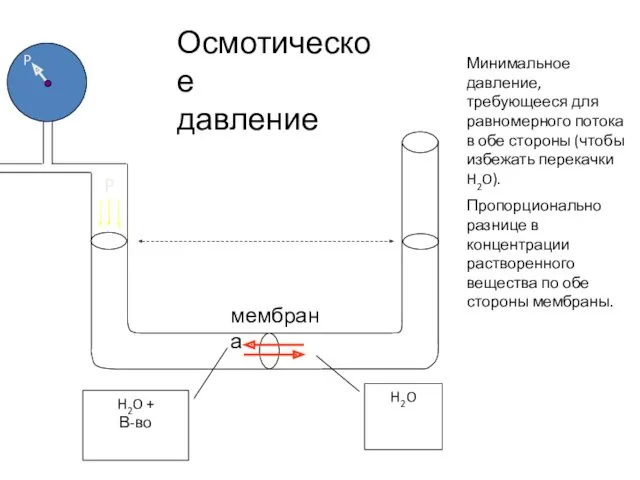
- 44. H2O H2O + В-во Осмотическое давление Минимальное давление, требующееся для равномерного потока в обе стороны (чтобы
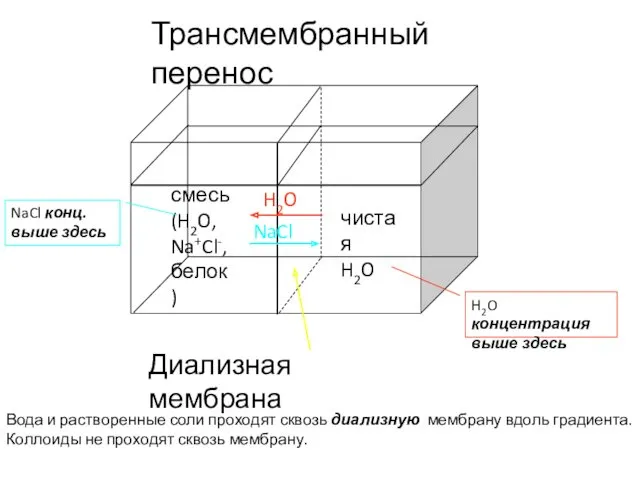
- 45. Диализная мембрана чистая H2O смесь (H2O, Na+Cl-, белок) Трансмембранный перенос Вода и растворенные соли проходят сквозь
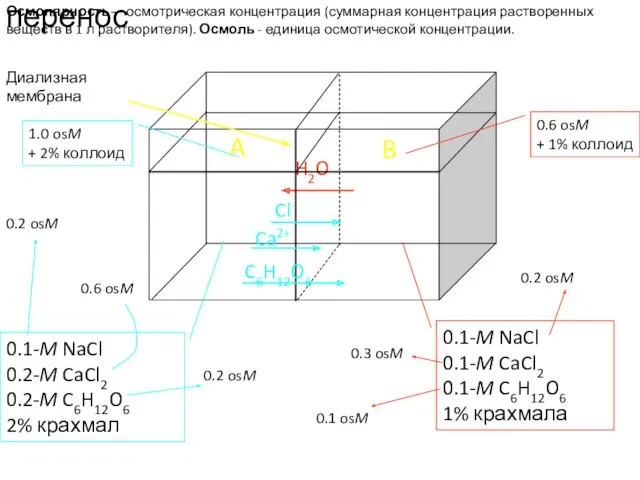
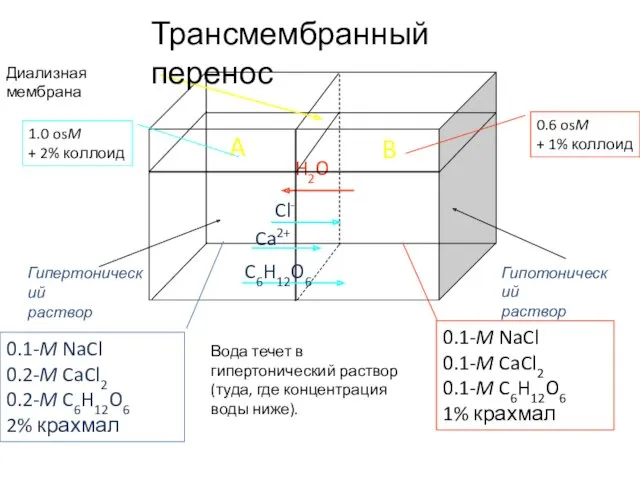
- 46. Диализная мембрана Трансмембранный перенос 0.1-M NaCl 0.1-M CaCl2 0.1-M C6H12O6 1% крахмала 0.1-M NaCl 0.2-M CaCl2
- 47. Диализная мембрана Трансмембранный перенос 0.1-M NaCl 0.1-M CaCl2 0.1-M C6H12O6 1% крахмал 0.1-M NaCl 0.2-M CaCl2
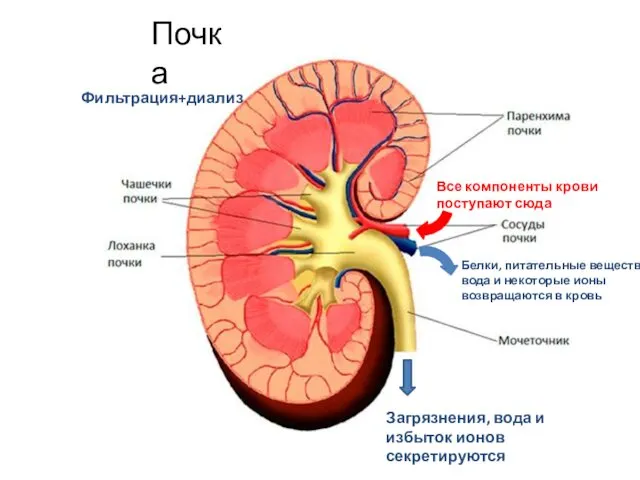
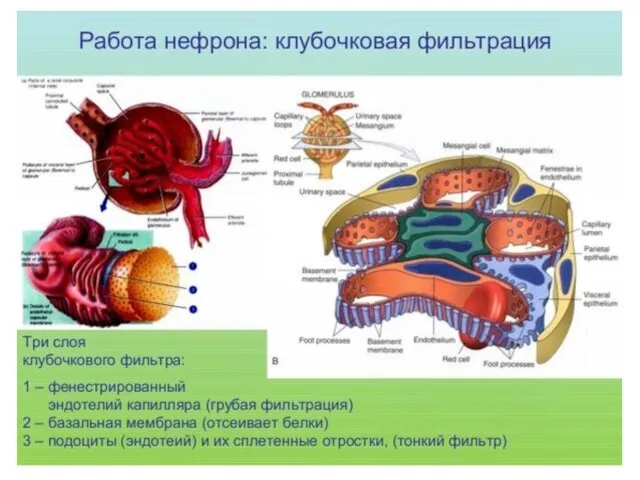
- 48. Почка Фильтрация+диализ Все компоненты крови поступают сюда Белки, питательные вещества, вода и некоторые ионы возвращаются в
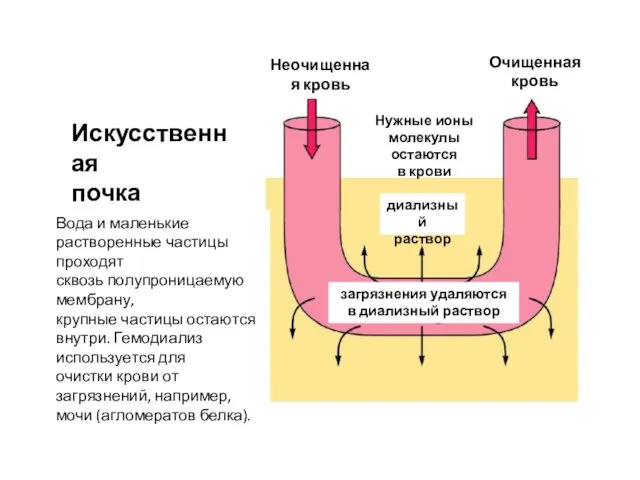
- 50. Искусственная почка Вода и маленькие растворенные частицы проходят сквозь полупроницаемую мембрану, крупные частицы остаются внутри. Гемодиализ
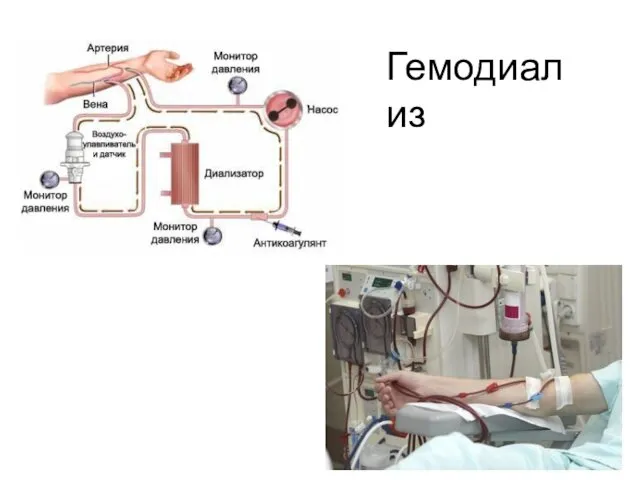
- 51. Гемодиализ
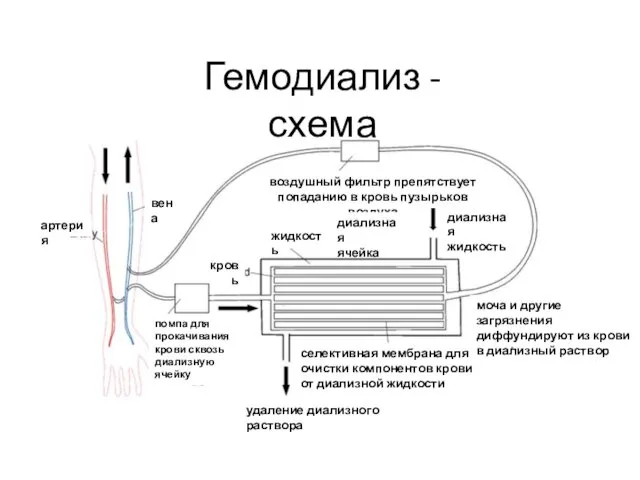
- 52. Гемодиализ - схема артерия вена помпа для прокачивания крови сквозь диализную ячейку удаление диализного раствора селективная
- 53. Solution Concentrations Expressed as a ratio of the amount of solute to the total amount of
- 54. Примеры коллоидных систем Пример Тип (классификация) Дымка Молоко Кровь Кость Асфальт Майонез Зубная паста Дым Опал
- 55. Osmolarity Calculating Total of molarities of all types of solute particles in the solution. For ionic
- 56. Osmolarity Solute, M Osmolarity 0. 25-M C6H12O6 (molecular) 0. 25-osM 0. 25-M NaCl (ionic) 0. 50-osM
- 58. Скачать презентацию



























 Подсчет запасов и оценка ресурсов нефти и газа на различных стадиях ГРР и разработки. Вероятностная оценка
Подсчет запасов и оценка ресурсов нефти и газа на различных стадиях ГРР и разработки. Вероятностная оценка Modern methods of shallow foundation strengthening of high school building
Modern methods of shallow foundation strengthening of high school building Kia Motors. EN Body Electrical
Kia Motors. EN Body Electrical Пословицы и поговорки. Народные приметы. Осенние загадки. Инсценирование произведения Н. Сладкова Осень
Пословицы и поговорки. Народные приметы. Осенние загадки. Инсценирование произведения Н. Сладкова Осень Городской детский праздник Книжкина неделя, г. Санкт-Петербург
Городской детский праздник Книжкина неделя, г. Санкт-Петербург Системы автоматического регулирования
Системы автоматического регулирования С днем рождения
С днем рождения Kazakhstani cultural patterns
Kazakhstani cultural patterns Содержание воспитания и социализации учащихся начальной школы
Содержание воспитания и социализации учащихся начальной школы Кохлеарная имплантация
Кохлеарная имплантация Мой любимый писатель: Жюль Верн (8 класс)
Мой любимый писатель: Жюль Верн (8 класс) Разделители отраслевые
Разделители отраслевые Биостатистика. Обзор данных
Биостатистика. Обзор данных Михаил Юрьевич Лермонтов
Михаил Юрьевич Лермонтов Мы помним, мы гордимся
Мы помним, мы гордимся Региональные особенности и инновационная практика зарубежных нефтедобывающих компаний
Региональные особенности и инновационная практика зарубежных нефтедобывающих компаний ЖК Кристалл
ЖК Кристалл Правонарушения – дорога в пропасть?
Правонарушения – дорога в пропасть? Гуманизм и реннесанский идеал человека. История гуманизма
Гуманизм и реннесанский идеал человека. История гуманизма Что значит быть моральным куроку по ОРКСЭ, модуль Светская этика
Что значит быть моральным куроку по ОРКСЭ, модуль Светская этика Презентация для 7 класса Саванны Южной Америки
Презентация для 7 класса Саванны Южной Америки Опыт реализации проектов строительства солнечных электростанций и результаты их эксплуатации в Республике Башкортостан
Опыт реализации проектов строительства солнечных электростанций и результаты их эксплуатации в Республике Башкортостан Опыт реализации основных и дополнительных общеобразовательных программ в Центрах Точка роста
Опыт реализации основных и дополнительных общеобразовательных программ в Центрах Точка роста 20230921_prezentatsiya_microsoft_office_powerpoint
20230921_prezentatsiya_microsoft_office_powerpoint Электронное портфолио учителя осетинского языка и литературы Тедеевой Анджелы Викторовны
Электронное портфолио учителя осетинского языка и литературы Тедеевой Анджелы Викторовны Страны Восточной Европы
Страны Восточной Европы Презентация НОД Путешествие по русским народным сказкам
Презентация НОД Путешествие по русским народным сказкам Дробные выражения. 6 класс
Дробные выражения. 6 класс