Содержание
- 2. Кислотность и основность - важные свойства соединений, определяющие их фундаментальные физико-химические и биологические свойства. Ферментативные реакции
- 3. Кислотно-основные взаимодействия А-Н + :В ↔ А- + В-Н кислота основание сопряженное сопряженная основание кислота По
- 4. [НСОО-]×[Н3О+] К= [НСООН]×[Н2О] Ка = К×[Н2О] [НСОО-]×[Н3О+] Ка= [НСООН]
- 5. Чем ниже кислотность, тем выше рКа Ка = 1,75×10-5 рКа = -lg Ка = 4,75
- 6. Классификация кислот Выделяют : О-Н –кислоты (вода, спирты, фенолы, карбоновые кислоты) S-H – кислоты (тиолы) N-H
- 7. КИСЛОТНОСТЬ И ОСНОВНОСТЬ СВЯЗАНЫ СО ВЗАИМНЫМ ВЛИЯНИЕМ АТОМОВ В МОЛЕКУЛАХ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ, с понятием ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (Лайнус
- 8. Сила кислоты определяется стабильностью образующихся ионов, которая определяется: 1.Электроотрицательнью элементов
- 9. ПОЛЯРИЗУЕМОСТЬ 2. Влияние электронных эффектов δ- δ+ рКа=18 рКа=10 рКа=12
- 10. Поляризуемость Для S-H кислот преобладающим фактором является поляризуемость. Атомы серы больше по размеру и имеют вакантные
- 11. Кислотность тиолов выше, чем кислотность спиртов R-S-H + NaOH → R-S-Na + H2O R-O-H + NaOH
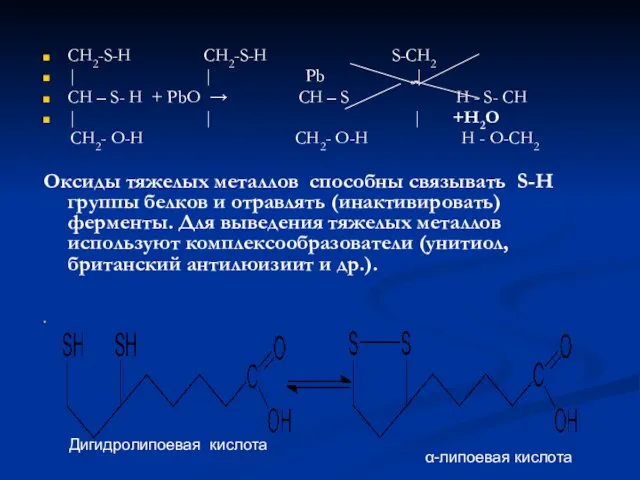
- 12. CH2-S-H CH2-S-H S-CH2 | | Pb | CH – S- H + PbO → CH –
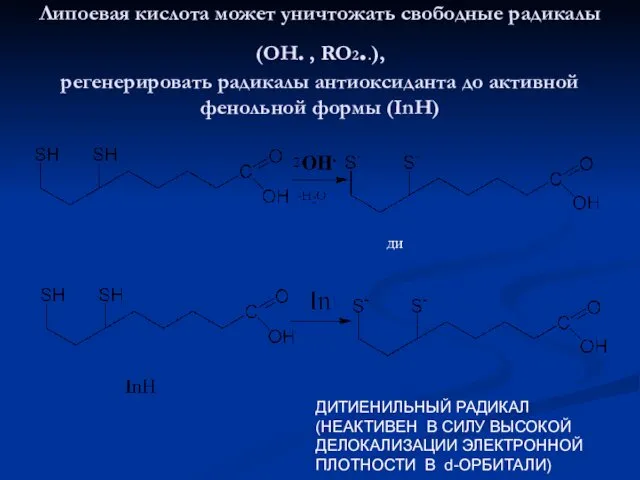
- 13. Липоевая кислота может уничтожать свободные радикалы (ОН. , RO2..), регенерировать радикалы антиоксиданта до активной фенольной формы
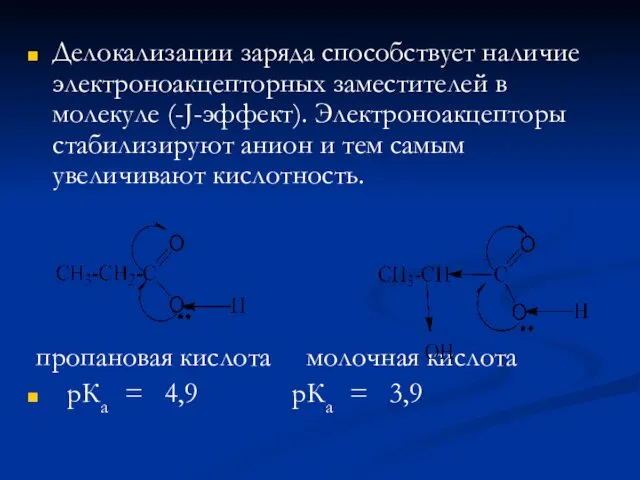
- 14. Делокализации заряда способствует наличие электроноакцепторных заместителей в молекуле (-J-эффект). Электроноакцепторы стабилизируют анион и тем самым увеличивают
- 15. Атомы хлора выполняют роль электроноакцепторов ( - J ) СCl3←СООН > Cl←СH2 ←СООН >СH3→СООН pKa =
- 16. Основность –способность принимать и удерживать протоны Для образования ковалентной связи с протоном Н+ органические основания должны
- 17. Сравнительная оценка основных свойств Величина основности определяется теми же факторами, что и кислотность, но действие этих
- 18. Основания образуют соли с кислотами CH3→ NH2 + HCl → [CH3→ N+H3 ] Cl- хлорид метиламмония
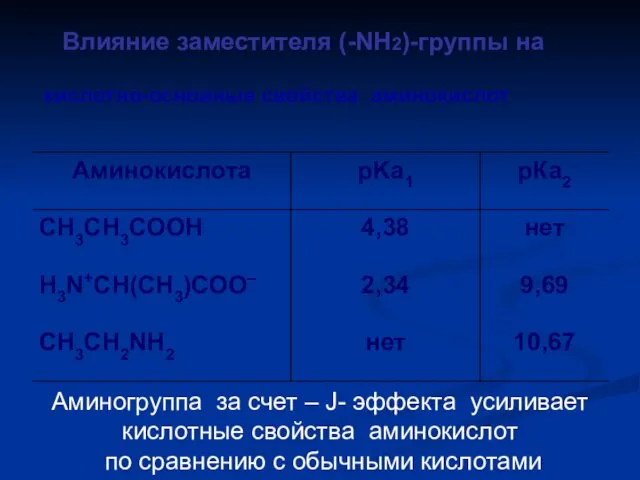
- 19. кислотно-основные свойства аминокислот Влияние заместителя (-NH2)-группы на Аминогруппа за счет – J- эффекта усиливает кислотные свойства
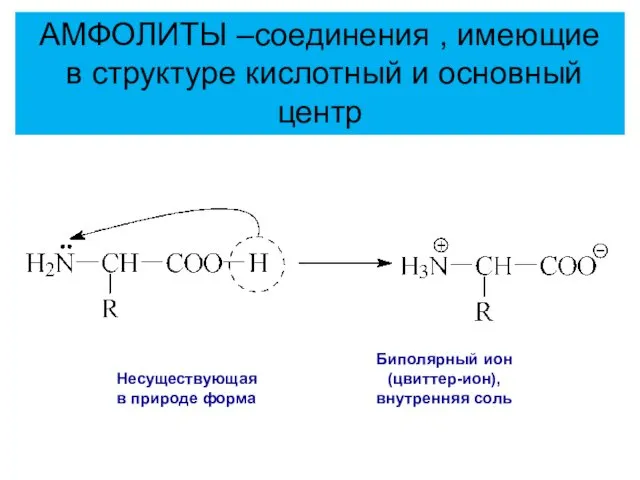
- 20. Несуществующая в природе форма Биполярный ион (цвиттер-ион), внутренняя соль АМФОЛИТЫ –соединения , имеющие в структуре кислотный
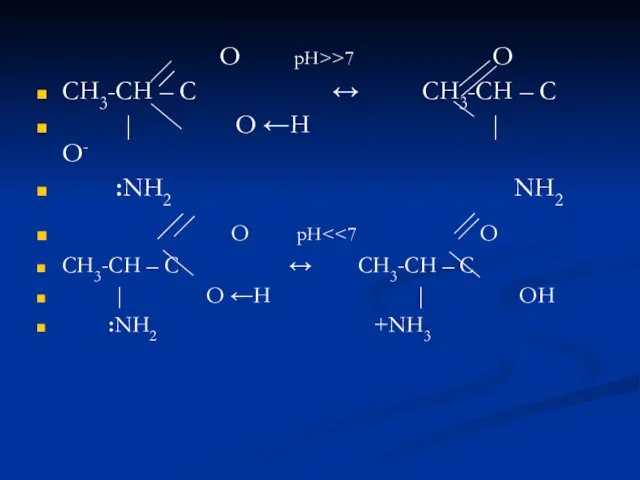
- 21. О рН>>7 O СН3-СН – С ↔ СН3-СН – С | O ←H | O- :NH2
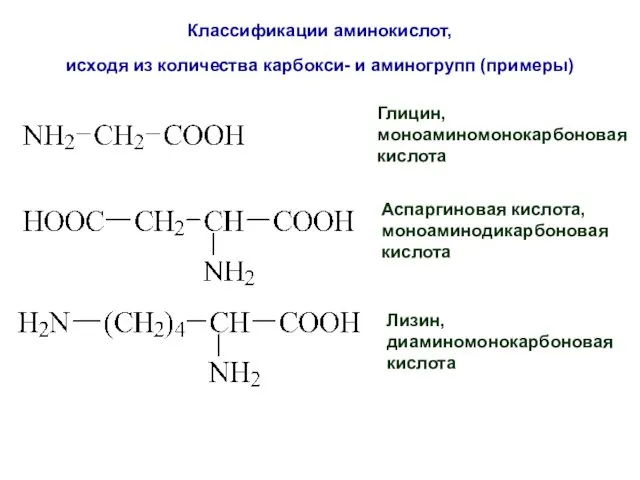
- 22. Классификации аминокислот, исходя из количества карбокси- и аминогрупп (примеры) Глицин, моноаминомонокарбоновая кислота Аспаргиновая кислота, моноаминодикарбоновая кислота
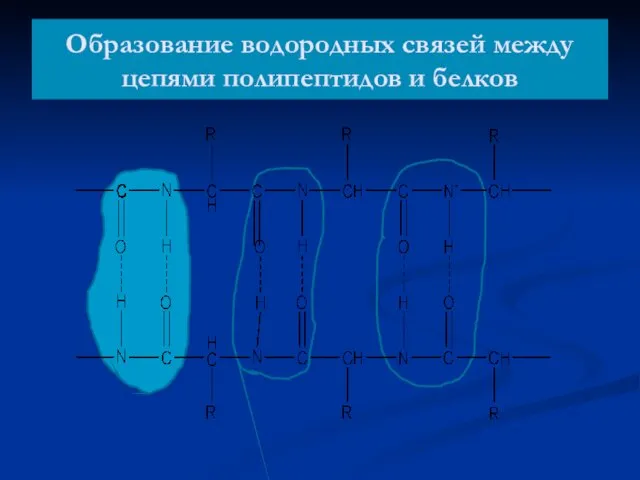
- 23. Образование водородных связей между цепями полипептидов и белков
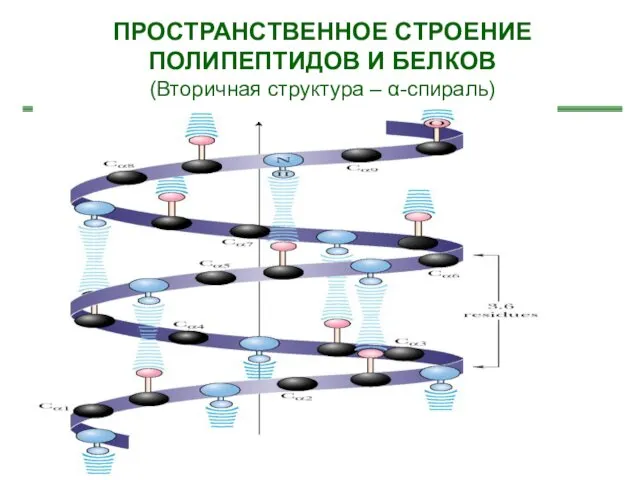
- 24. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Вторичная структура – α-спираль)
- 26. Скачать презентацию


![[НСОО-]×[Н3О+] К= [НСООН]×[Н2О] Ка = К×[Н2О] [НСОО-]×[Н3О+] Ка= [НСООН]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/35624/slide-3.jpg)











 Система снабжения печей жидким и газообразным топливом. Тепловая изоляция и огнеупорная обмуровка печей. Опрессовка печей
Система снабжения печей жидким и газообразным топливом. Тепловая изоляция и огнеупорная обмуровка печей. Опрессовка печей Ваш ребенок идёт в школу
Ваш ребенок идёт в школу Картатека хороводных игр
Картатека хороводных игр Обработка заготовок на сверлильных станках
Обработка заготовок на сверлильных станках Тепловые двигатели и нагнетатели. Паротурбинные установки (часть 2)
Тепловые двигатели и нагнетатели. Паротурбинные установки (часть 2) Автоматизация
Автоматизация Российская империя в XVIII веке. Эпоха дворцовых переворотов 1725-1762
Российская империя в XVIII веке. Эпоха дворцовых переворотов 1725-1762 Презентация Сталинградская битва
Презентация Сталинградская битва Зерновые в культуре стран: от Древности до наших дней
Зерновые в культуре стран: от Древности до наших дней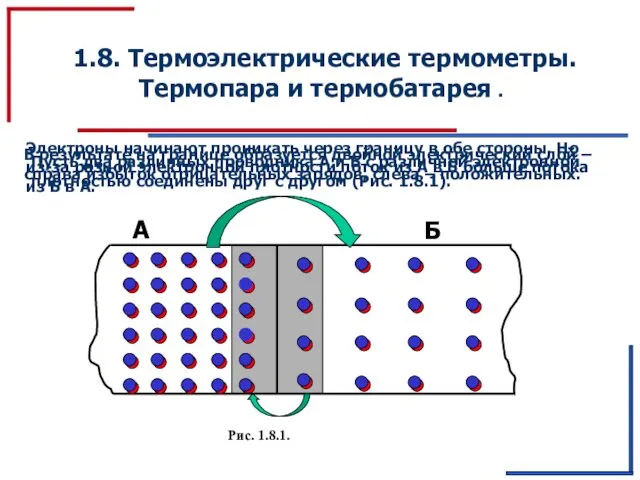 Термоэлектрические термометры. Термопара и термобатарея
Термоэлектрические термометры. Термопара и термобатарея Akihoto Facades 3
Akihoto Facades 3 Презентация Самообразование педагога
Презентация Самообразование педагога Состояние науки в современной России
Состояние науки в современной России Основы молекулярной физики и термодинамики
Основы молекулярной физики и термодинамики Работа с программно-аппаратным комплексом УКЭБ производства компании Электронный вокзал
Работа с программно-аппаратным комплексом УКЭБ производства компании Электронный вокзал Документация для творческого проекта
Документация для творческого проекта Презинтация
Презинтация Модный образ на основе современного направления моды и модных трендов от WELLA
Модный образ на основе современного направления моды и модных трендов от WELLA Презентация к уроку Классификация химических реакций
Презентация к уроку Классификация химических реакций технология
технология Активные формы взаимодействия педагога-психолога с семьей по проблеме детско-родительского общения
Активные формы взаимодействия педагога-психолога с семьей по проблеме детско-родительского общения Презентация по творчеству Ширяевец А.В.
Презентация по творчеству Ширяевец А.В. Национальный парк Редвуд
Национальный парк Редвуд Организация, содержание, приницпы подготовки школьников к олимпиадам по географии от школьных до международных
Организация, содержание, приницпы подготовки школьников к олимпиадам по географии от школьных до международных презентация по теме Гидролиз
презентация по теме Гидролиз Функция КОДСИМВ(), Символ() в Excel
Функция КОДСИМВ(), Символ() в Excel К уроку технологии 1 класс
К уроку технологии 1 класс Афганистан болит в моей душе
Афганистан болит в моей душе