Содержание
- 2. Цель урока: Цели урока: Обучающие: Сформировать представление о понятии «классификация химических реакций». Сформировать представление о понятиях
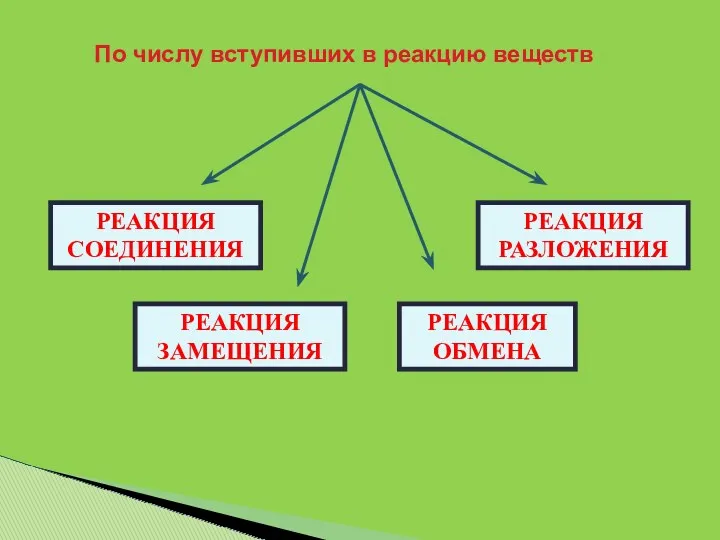
- 3. По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению степени окисления По
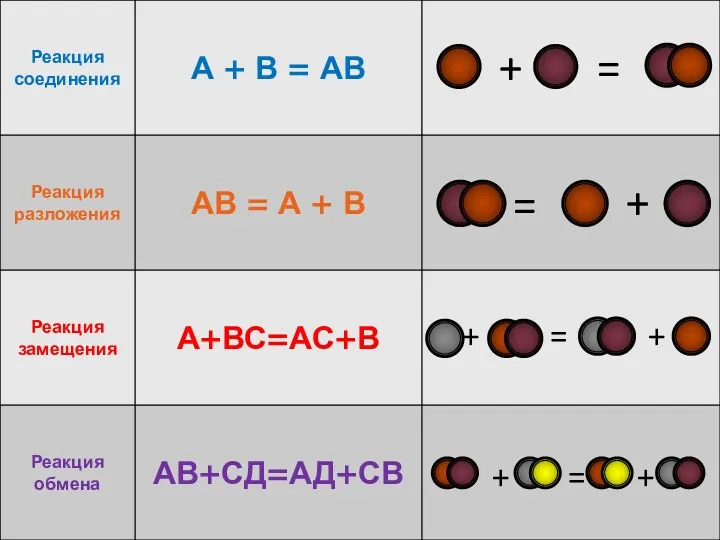
- 4. РЕАКЦИЯ СОЕДИНЕНИЯ РЕАКЦИЯ РАЗЛОЖЕНИЯ РЕАКЦИЯ ЗАМЕЩЕНИЯ РЕАКЦИЯ ОБМЕНА По числу вступивших в реакцию веществ
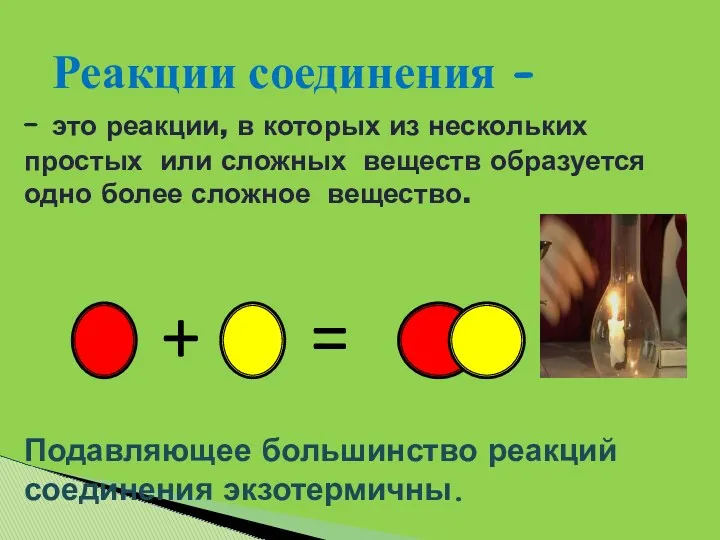
- 5. – это реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество.
- 6. 1. Fe + S = FeS 2. 2Zn + O2 =2ZnO 3. 4Fe + O2 =
- 7. 1) 2HgO = 2Hg + O2 2) CaCO3 = CaO + CO2 3) CuSO4 + Fe
- 8. – это реакции, в результате которых сложное вещество разлагается на несколько других, более простых веществ. Реакции
- 9. Подавляющее большинство реакций разложения эндотермичны и требуют для своего проведения повышенной температуры. Например: 2HgO = 2Hg
- 10. 1) CaO + CO2 = CaCO3 2) CO2 + 2NaOH = Na2CO3 + H2O 3) Fe
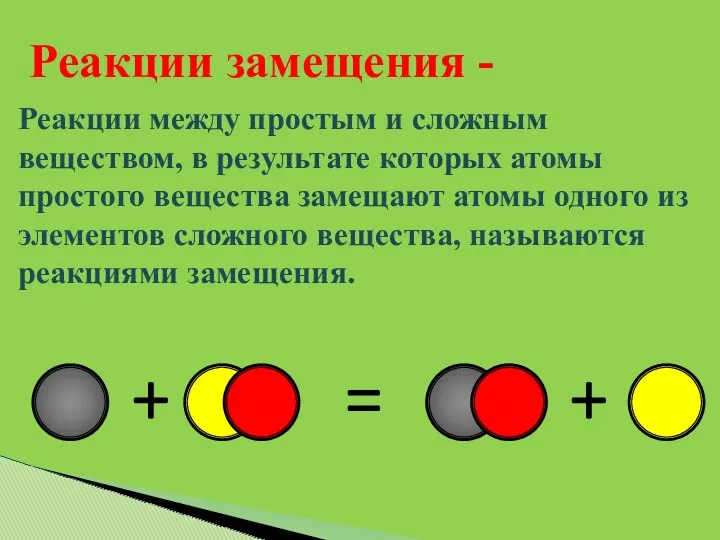
- 11. Реакции между простым и сложным веществом, в результате которых атомы простого вещества замещают атомы одного из
- 12. Zn + 2HCl = ZnCl2 + H2 Fe + CuCl2 = FeCl2 + Cu Cu +
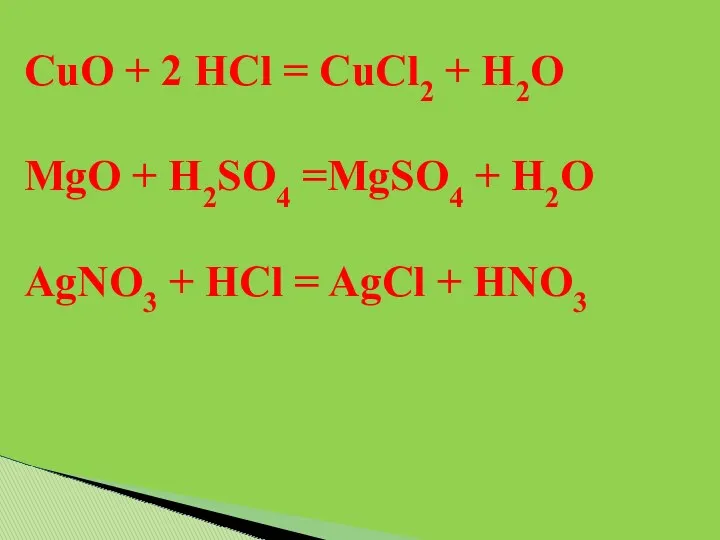
- 13. Реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями называются реакциями обмена.
- 14. CuO + 2 HCl = CuCl2 + H2O MgO + H2SO4 =MgSO4 + H2O AgNO3 +
- 16. Экзотермические Идут с выделение теплоты S + O2 = SO2 + Q По тепловому эффекту Эндотермические
- 17. По обратимости Необратимые Идут только в одном направлении Условия: образование осадка или слабого электролита (Н2О), выделение
- 18. По изменению степени окисления 1.Идут без изменения степени окисления элементов CaCO3 = CaO + CO2 2.Окислительно
- 19. По механизму 1.Ионные NaOH + HCl = NaCl + H2O Na+ + OH- + H+ +Cl-
- 20. По агрегатному состоянию веществ 1.Гомогенные Между веществами нет поверхности раздела фаз H2 + Cl2 = 2HCl
- 22. Скачать презентацию














 Откуда же ты, ёлочка. Новогодние вопросы
Откуда же ты, ёлочка. Новогодние вопросы Лесные пожары
Лесные пожары Быть примерным пешеходом разрешается
Быть примерным пешеходом разрешается Преобразование графика тригонометрической функции у = sin x путем сжатия и расширения
Преобразование графика тригонометрической функции у = sin x путем сжатия и расширения Система мероприятий по повышению уровня компетентности педагогов в области инклюзивного образования
Система мероприятий по повышению уровня компетентности педагогов в области инклюзивного образования Насекомые (один - много, большой - маленький)
Насекомые (один - много, большой - маленький) Инструктаж неэлектротехнического персонала ( 1 группа)
Инструктаж неэлектротехнического персонала ( 1 группа) безопасный интернет
безопасный интернет Добування квадратного і кубічного кореня у стародавньому світі
Добування квадратного і кубічного кореня у стародавньому світі Административное деление Подмосковья.
Административное деление Подмосковья. Новогодняя открытка в технике декупаж
Новогодняя открытка в технике декупаж Гласные звуки.
Гласные звуки. Понятие и принципы экологического кризиса
Понятие и принципы экологического кризиса Готовность к школе
Готовность к школе Мастер-класс Подарок маме на 8 Марта
Мастер-класс Подарок маме на 8 Марта проект по географии Демографическая ситуация села как зеркало демографии страны
проект по географии Демографическая ситуация села как зеркало демографии страны Музыка и религия: обретение вечного
Музыка и религия: обретение вечного Древние греки
Древние греки Метаболизм лекарственных препаратов
Метаболизм лекарственных препаратов Международный день детей. Викторина
Международный день детей. Викторина Постановка научной проблемы
Постановка научной проблемы Продукция прокатного производства
Продукция прокатного производства Основы конструирования электронных устройств
Основы конструирования электронных устройств Elementary interactions: hydrophobic & electrostatic; SS and coordinate bonds
Elementary interactions: hydrophobic & electrostatic; SS and coordinate bonds Холодная война между США и СССР (1945–1991)
Холодная война между США и СССР (1945–1991) конспект группового логопедического занятия в 3 классе
конспект группового логопедического занятия в 3 классе Презентация к классному часу Поговорим о дружбе
Презентация к классному часу Поговорим о дружбе герои - земляки
герои - земляки