Содержание
- 2. Существует физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого
- 3. Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, которые содержатся в веществе. Под структурными
- 4. Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная масса численно равна молекулярной массе) ,
- 5. о Закон объемных отношений Измеряя объемы, и объемы газов, в результате реакции Ж.Л. Гей-Люссак открыл закон
- 6. Например
- 7. Закон объёмных отношений позволил итальянскому учёному А. Авогадро предположить, что молекулы простых газов состоят из двух
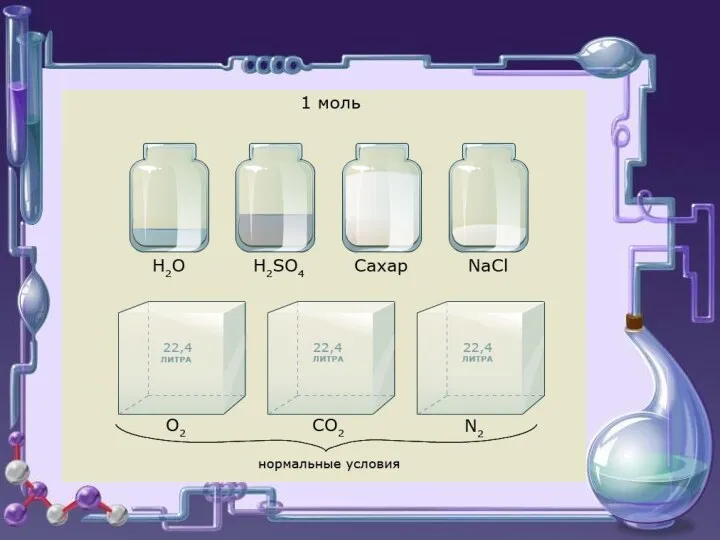
- 8. о о А. Авогадро 1811 Итальянский ученый Амадео Авогадро сформулировал закон (для газов) : в равных
- 9. Следствия (для газов) Отношение массы определённого объёма одного газа к массе такого же объёма другого газа,
- 11. Уравнение связи Где n- количество вещества (моль)
- 13. Скачать презентацию


![Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/522991/slide-3.jpg)






 Занимательные задания для автоматизации звука Ж.
Занимательные задания для автоматизации звука Ж. Здоровое поколение и научно-технический прогресс
Здоровое поколение и научно-технический прогресс Подключения на сетях ДОМ.RU и InterZet
Подключения на сетях ДОМ.RU и InterZet Методы научного исследования.Тема 5
Методы научного исследования.Тема 5 Презентация Мои питомцы
Презентация Мои питомцы Чудо-книжки – чудо-детям. Книжки Холли Вебб
Чудо-книжки – чудо-детям. Книжки Холли Вебб Руководство для родителей по использованию электронного классного журнала
Руководство для родителей по использованию электронного классного журнала Анализ производства продукции животноводства
Анализ производства продукции животноводства формулы корней квадратного уравнения
формулы корней квадратного уравнения Основы специальной теории относительности
Основы специальной теории относительности Презентация Тематическая картина
Презентация Тематическая картина Организация градостроительно планировочных работ и развитие градостроительных идей в России
Организация градостроительно планировочных работ и развитие градостроительных идей в России Обязанности водителя
Обязанности водителя Вирусы и бактериофаги. Неклеточные формы жизни
Вирусы и бактериофаги. Неклеточные формы жизни чудесная роспись русских мастеров
чудесная роспись русских мастеров Болезнь Шарко-Мари-Тута Наследственная моторно-сенсорная нейропатия невральная амиотрофия
Болезнь Шарко-Мари-Тута Наследственная моторно-сенсорная нейропатия невральная амиотрофия Методика для выявления уровня развития коммуникативной деятельности ребенка
Методика для выявления уровня развития коммуникативной деятельности ребенка Модуль центрального процессора TMS320F28x
Модуль центрального процессора TMS320F28x Изучаем буквы. Буква Ж
Изучаем буквы. Буква Ж Умножение десятичных дробей. Правила умножения
Умножение десятичных дробей. Правила умножения Рождественская презентация поэтического клуба Мы пробуем перо.
Рождественская презентация поэтического клуба Мы пробуем перо. Ниточные соединения деталей швейных изделий. Стежки
Ниточные соединения деталей швейных изделий. Стежки Разнообразие методов при обучении детей младшего и среднего дошкольного возраста правилам дорожного движения
Разнообразие методов при обучении детей младшего и среднего дошкольного возраста правилам дорожного движения Системы электропривода. Принципы управления электроприводом. Разомкнутые системы электропривода. Лекция 1
Системы электропривода. Принципы управления электроприводом. Разомкнутые системы электропривода. Лекция 1 Светящиеся грибы
Светящиеся грибы Презентация рабочей программы
Презентация рабочей программы Презентация Автоматизация в словах, предложениях звука Ц
Презентация Автоматизация в словах, предложениях звука Ц С годом российского депутата
С годом российского депутата