Содержание
- 2. План лекции
- 3. Общие замечания Введение Лекция 14 посвящена основам конденсированного состояния вещества – твёрдому телу, жидкости. Тематика первых
- 4. Раздел 1. Кристаллы Конденсированное состояние
- 5. 1.1 Определения и понятия 1. Кристаллы Кристалл – это твёрдое тело, имеющее правильную геометрическую форму. Правильная
- 6. 1.2 Монокристаллы, поликристаллы. 1. Кристаллы Кристалл, в основе которого лежит одна и та же кристаллическая решётка
- 7. 1.3.1 Типы структур кристаллов 1. Кристаллы Наука о кристаллах – кристаллография. В основе кристаллографии лежит классификация
- 8. 1.3.2. Типы структур кристаллов. Переносная симметрия. Элементарная ячейка. 1. Кристаллы Наиболее практически значимой является переносная симметрия
- 9. 1.3.3. Типы структур кристаллов. Переносная симметрия. Характеристики кристаллической решётки. 1. Кристаллы Период кристаллической решётки (величины а,
- 10. 1.3.4.Типы структур кристаллов. Переносная симметрия. Сингония. 1. Кристаллы Число переносных симметрий кристаллической решётки относительно немного и
- 11. Раздел 2. Теплоёмкость твёрдых тел Конденсированное состояние
- 12. 2.1 Тепловое движение частиц в твёрдом теле 2. Теплоёмкость твёрдых тел Как известно (см., напр., сл.5),
- 13. 2.2 Число степеней свободы и внутренняя энергия 2. Теплоёмкость твёрдых тел Число степеней свободы частицы в
- 14. 2.3 Теплоёмкость. Закон Дюлонга-Пти. 2. Теплоёмкость твёрдых тел Молярная теплоёмкость твёрдого тела: Экспериментальная зависимость от температуры
- 15. Раздел 3. Газ, жидкость, твёрдое тело: сравнительные характеристики Конденсированное состояние «The last but not the least»
- 16. 3.1 Силы межмолекулярного взаимодействия 3. Газ, жидкость, твёрдое тело: сравнительные характеристики Общим свойством для газов, жидкостей
- 17. 3.2 Потенциальная энергия межмолекулярного взаимодействия 3. Газ, жидкость, твёрдое тело: сравнительные характеристики Общим свойством для газов,
- 18. 3.3 Порядок расположения частиц 3. Газ, жидкость, твёрдое тело: сравнительные характеристики
- 19. Курс лекций по физике для студентов 1-ого курса в весеннем семестре завершён. Желаю успешного завершения учебного
- 21. Скачать презентацию


















 Лиття в оболонкові форми та за виплавлювальними моделями
Лиття в оболонкові форми та за виплавлювальними моделями Планирование и подготовка презентаций
Планирование и подготовка презентаций Урядченко ДП
Урядченко ДП Русский язык_4.02
Русский язык_4.02 Эпоха великого перелома: цели, методы и последствия сталинской модернизации СССР (1929-1941 гг.)
Эпоха великого перелома: цели, методы и последствия сталинской модернизации СССР (1929-1941 гг.) Классификация и свойства оксидов
Классификация и свойства оксидов Учебная практика. Общественные отношения, подпадающие под воздействие норм публичного и частного права
Учебная практика. Общественные отношения, подпадающие под воздействие норм публичного и частного права Презентация Природные зоны Евразии
Презентация Природные зоны Евразии Кредитование. Банковский кредит
Кредитование. Банковский кредит Крещение Господне
Крещение Господне Знакомство с Интернетом. Браузеры. Безопасная работа в Интернете. 7 класс
Знакомство с Интернетом. Браузеры. Безопасная работа в Интернете. 7 класс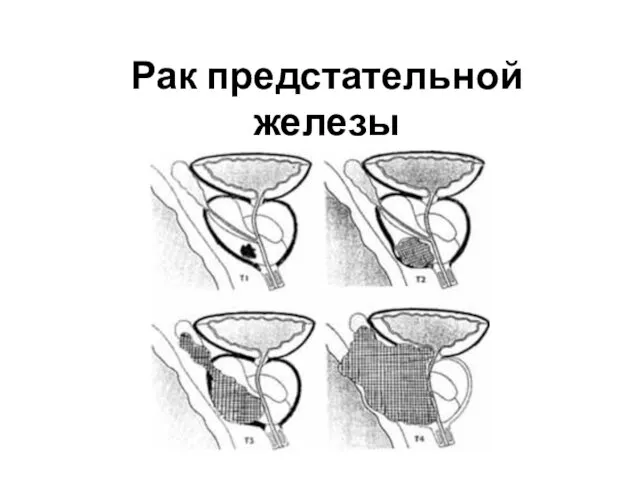 Рак предстательной железы
Рак предстательной железы Межпоселенческая централизованная библиотечная система
Межпоселенческая централизованная библиотечная система Рождение новой России
Рождение новой России Баланс как основная форма финансовой отчетности
Баланс как основная форма финансовой отчетности Изготовление новогодних ёлок из подручных материалов
Изготовление новогодних ёлок из подручных материалов Дольменная археологическая культура
Дольменная археологическая культура Презентация Роль русской православной церкви во время Великой Отечественной войны
Презентация Роль русской православной церкви во время Великой Отечественной войны Гидросфера. Воды суши. Подземные воды
Гидросфера. Воды суши. Подземные воды Snow Day Format
Snow Day Format Определение угла. Развёрнутый угол
Определение угла. Развёрнутый угол Структура газообразных, жидких и твердых тел. 5 класс
Структура газообразных, жидких и твердых тел. 5 класс Прославление Христа
Прославление Христа Внедрение технологии ТРИЗ
Внедрение технологии ТРИЗ презентация для младших дошкольников Изучаем цвета
презентация для младших дошкольников Изучаем цвета Финансирование развития городской инфраструктуры
Финансирование развития городской инфраструктуры Продающий текст: как заставить слова продавать что угодно
Продающий текст: как заставить слова продавать что угодно Petroleum
Petroleum