Содержание
- 2. Физические свойства кремния Кристаллический кремний – вещество темно-серого цвета; обладает стальным блеском; полупроводник (его электропроводность возрастает
- 3. Важнейшие соединения кремния
- 4. Родоначальник гомологического ряда кремневодородов SinH2n+2. Представляет собой очень ядовитый бесцветный газ с запахом, напоминающим AsH3 и
- 5. Встречается главным образом в виде минерала кварца. Загрязненный примесями кварц - обычный песок - является одним
- 6. Кремниевая кислота H2SiO3. Почти нерастворима в воде (в форме истинного раствора). Легко образует коллоидные растворы и
- 7. Стекло Na2CaSi6O14 или Na2O.CaO.6SiO2. Довольно близко к этому составу подходит обычное оконное стекло. Практически нерастворимо, однако
- 8. Карбид кремния (карборунд) SiC. Твердое, тугоплавкое вещество. Его кристаллическая решетка аналогична решетке алмаза. Является полупроводником. Интенсивно
- 9. Нахождение кремния в природе
- 10. Кремний – один из самых распространенных в земной коре элементов (более 25% массы). Если углерод –
- 11. Природные силикаты – это довольно сложные вещества. Их состав обычно изображается как соединение нескольких оксидов. Соединения,
- 12. Многие природные силикаты в чистом виде являются драгоценными камнями, например, аквамарин, изумруд, топаз и др. Значительная
- 13. Оксид кремния (IV), окрашенный различными примесями, образует драгоценные и полудрагоценные камни – агат, аметист, яшма. В
- 14. Химические свойства кремния
- 15. По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, так как
- 16. Кремний при обычных условиях довольно инертен, что следует объяснить прочностью его кристаллической решетки. Непосредственно при комнатной
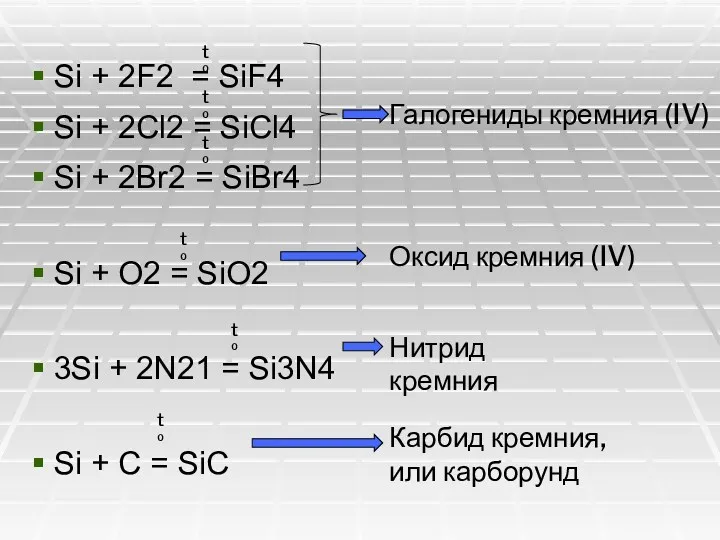
- 17. Si + 2F2 = SiF4 Si + 2Cl2 = SiCl4 Si + 2Br2 = SiBr4 Si
- 18. В технике карборунд получают в электрических печах из смеси песка и кокса: SiO2 + 3C =
- 19. Кремний как восстановитель взаимодействует и с некоторыми сложными веществами, например с фтороводородом: Si + 4HF =
- 20. Кремний не растворяется даже в азотной кислоте, так как на его поверхности образуется плотная оксидная пленка
- 21. Водные растворы щелочей растворяют кремний с образованием растворимых солей кремниевой кислоты – силикатов, при этом происходит
- 22. Виртуальный эксперимент
- 23. При взаимодействии с металлами кремний играет роль окислителя. Соединения кремния с металлами называют силицидами : Si
- 24. Получение кремния
- 25. В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в
- 26. 1. Очистка в лабораторных условиях может быть проведена путём предварительного получения силицида магния Mg2Si. Далее из
- 27. 2. Очистка кремния в промышленных масштабах осуществляется путём непосредственного хлорирования кремния. При этом образуются соединения состава
- 28. 3. Разрабатываются более дешёвые, чистые и эффективные промышленные технологии очистки кремния. На 2010 г. к таковым
- 29. Получение кремния термитным способом
- 30. Применение кремния
- 31. Кремний используют в качестве полупроводника. Из него изготавливают так называемые солнечные батареи, превращающие световую энергию в
- 32. Соединения кремния служат основой для производства стекла и цемента. Также существует силикатная керамика — кирпич, фарфор,
- 34. Скачать презентацию






























 Проблемы юридической техники в уголовном праве
Проблемы юридической техники в уголовном праве Автоматизация звука Р
Автоматизация звука Р Теоретические основы товароведения продовольственных товаров
Теоретические основы товароведения продовольственных товаров Технология изготовления и монтаж деревянных лестниц. Устройство деревянного перекрытия
Технология изготовления и монтаж деревянных лестниц. Устройство деревянного перекрытия Способы организации пространства в ландшафтной архитектуре
Способы организации пространства в ландшафтной архитектуре Основы общественного производства
Основы общественного производства Процедура выбора страховой компании для строительной организации ООО Паркинг-М
Процедура выбора страховой компании для строительной организации ООО Паркинг-М Разработка технологии внесения растворов жидких комплексных удобрений (жку) в посевы сельскохозяйственных культур
Разработка технологии внесения растворов жидких комплексных удобрений (жку) в посевы сельскохозяйственных культур Традиционные общества востока
Традиционные общества востока Кошки
Кошки Христианин в труде
Христианин в труде День космонавтики.
День космонавтики. Порядок проверки и замены компрессора Dvm plus III
Порядок проверки и замены компрессора Dvm plus III 20231021_lyubit_svoego_podrostka_2012
20231021_lyubit_svoego_podrostka_2012 Ислам мәдениеті
Ислам мәдениеті Виды химической связи
Виды химической связи Деловая игра Знатоки ФГОС ДО
Деловая игра Знатоки ФГОС ДО Рейди мэйд в искусстве XX века
Рейди мэйд в искусстве XX века Роль воспитателя в процессе музык. воспитания
Роль воспитателя в процессе музык. воспитания образование в жизни человека
образование в жизни человека Моделирование и конструирование
Моделирование и конструирование Ознакомление детей дошкольного возраста с изобразительным искусством
Ознакомление детей дошкольного возраста с изобразительным искусством Проецирование. Проекция
Проецирование. Проекция Döwletleriň syýasy kartada şekillendirilşi
Döwletleriň syýasy kartada şekillendirilşi Современные способы обеззараживания воды
Современные способы обеззараживания воды Экономическая сущность предпринимательской деятельности
Экономическая сущность предпринимательской деятельности Эксплуатация системы кондиционирования воздуха пассажирских вагонов в пути следования
Эксплуатация системы кондиционирования воздуха пассажирских вагонов в пути следования Театр Моды Силуэт, коллекция Цвета жизни
Театр Моды Силуэт, коллекция Цвета жизни