Содержание
- 2. Физические свойства газ, без цвета, без запаха, без вкуса, практически нерастворим в воде; t0пл. -259,10 С;
- 3. Осторожно: ВОДОРОД! Смесь водорода с одним объемом кислорода – гремучий газ Смесь водорода и воздуха –
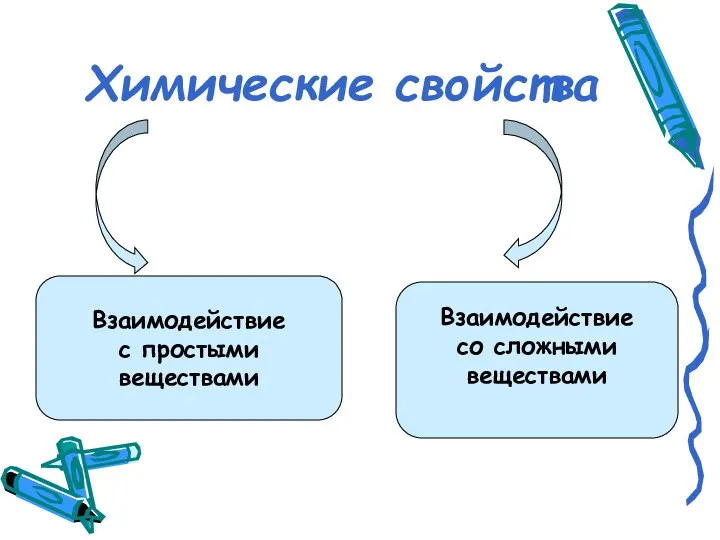
- 4. Химические свойства Взаимодействие с простыми веществами Взаимодействие со сложными веществами
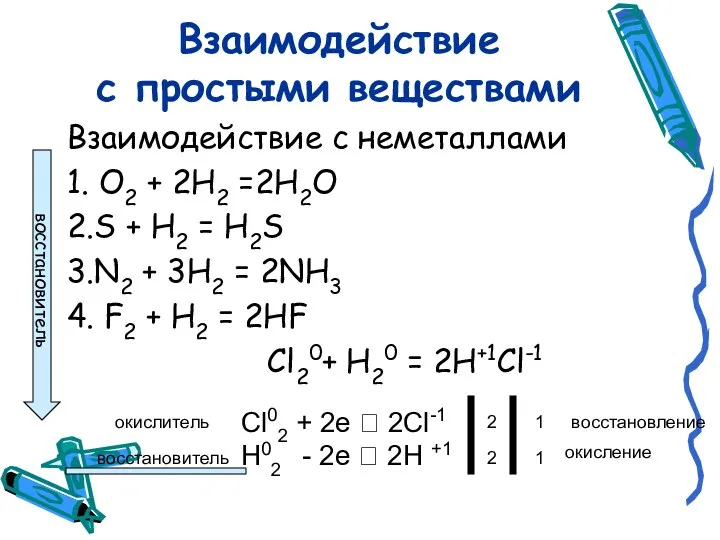
- 5. Взаимодействие с простыми веществами Взаимодействие с неметаллами 1. O2 + 2H2 =2Н2О 2.S + H2 =
- 6. Взаимодействие с простыми веществами Взаимодействие со щелочными и щёлочноземельными металлами Водород взаимодействует с активными металлами, образуя
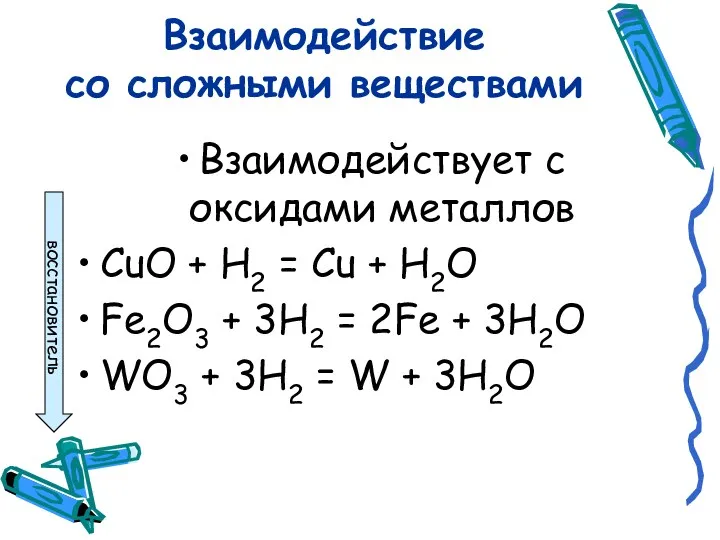
- 7. Взаимодействие со сложными веществами Взаимодействует с оксидами металлов CuO + H2 = Cu + H2O Fe2O3
- 8. Применение водорода Синтез аммиака NH3; Синтез хлороводорода; Синтез метилового и других спиртов; Получение маргарина; Получение молибдена,
- 9. ПРОВЕРЬ СЕБЯ 1. Водород проявляет степень окисления в соединениях: А) +1 и -1; Б) +2 и
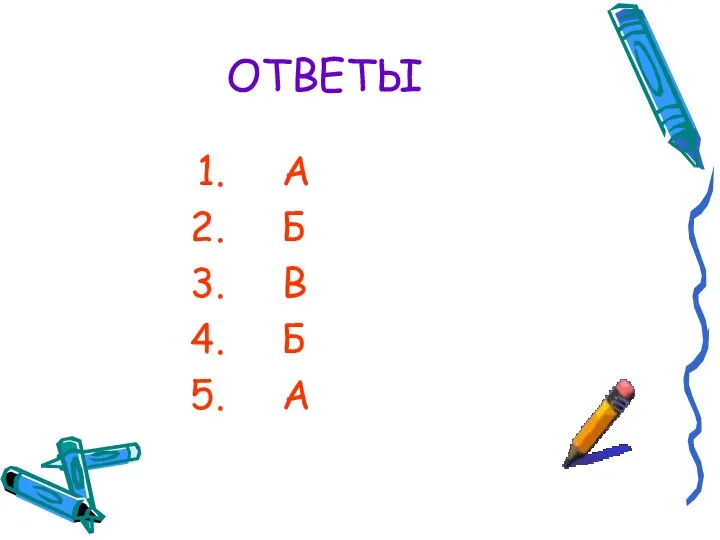
- 10. ОТВЕТЫ А Б В Б А
- 11. ИТОГИ Если ты ответил правильно на все вопросы – получи отметку «5» Если все же ты
- 13. Скачать презентацию






 Страны Северной Европы
Страны Северной Европы Ұлпа қабынуы туралы түсінік ұлпа қабынуын емдеу әдістері, тіс ұлпасының девитализациясы
Ұлпа қабынуы туралы түсінік ұлпа қабынуын емдеу әдістері, тіс ұлпасының девитализациясы Родительское собрание на тему Воспитание самостоятельности
Родительское собрание на тему Воспитание самостоятельности Лекция №4. Профилактика туберкулеза. Организация медицинской помощи больным туберкулезом
Лекция №4. Профилактика туберкулеза. Организация медицинской помощи больным туберкулезом Предмет химии
Предмет химии Дигибридное скрещивание
Дигибридное скрещивание Моделирование систем. Управление рисками, системный анализ и моделирование. Лекции 11-12
Моделирование систем. Управление рисками, системный анализ и моделирование. Лекции 11-12 Презентация Нравственные качества, ОРКСЭ, урок №7, учебник Шемшуриной (Дрофа), 4 класс
Презентация Нравственные качества, ОРКСЭ, урок №7, учебник Шемшуриной (Дрофа), 4 класс Туркменистан - государство в Центральной Азии
Туркменистан - государство в Центральной Азии Россия при первых Романовых: перемены в государственном устройстве
Россия при первых Романовых: перемены в государственном устройстве Тайна имени Екатерина
Тайна имени Екатерина Будущая профессия – тренер по боксу
Будущая профессия – тренер по боксу Моя любимая и лучшая подруга
Моя любимая и лучшая подруга Обработка деталей на станках с программным управлением
Обработка деталей на станках с программным управлением Дидактическая игра-тренажёр Щенок и чудак
Дидактическая игра-тренажёр Щенок и чудак Выступление на педсовете Подготовка учащихся 9, 10, 11 классов к ГИА и ЕГЭ
Выступление на педсовете Подготовка учащихся 9, 10, 11 классов к ГИА и ЕГЭ Общие сведения о релейной защите
Общие сведения о релейной защите Вода.
Вода. ОСНОВНЫЕ ВИДЫ МУЗЫКАЛЬНЫХ ИГРУШЕК В РАЗНЫХ ВОЗРАСТНЫХ ГРУППАХ
ОСНОВНЫЕ ВИДЫ МУЗЫКАЛЬНЫХ ИГРУШЕК В РАЗНЫХ ВОЗРАСТНЫХ ГРУППАХ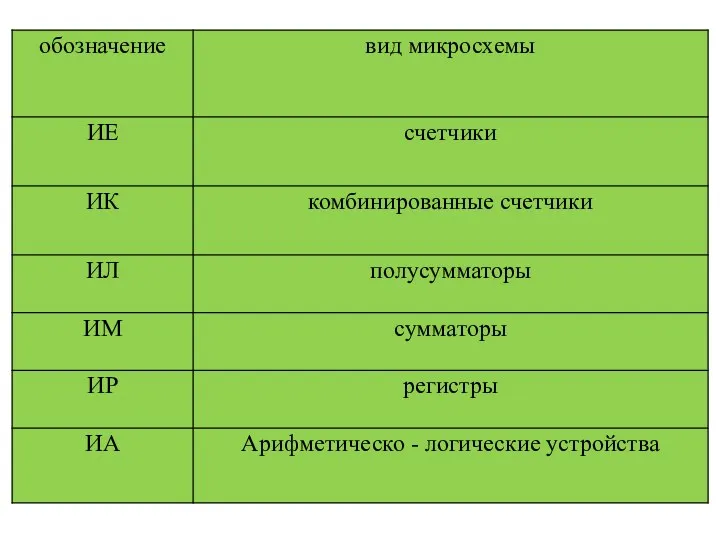 Характеристики интегральных схем (ИС)
Характеристики интегральных схем (ИС) Қан топтары. Қан құю әдісі
Қан топтары. Қан құю әдісі ГО ВПО Донецкий национальный университет экономики и торговли имени Михаила Туганбарановского. Кафедра международной экономики
ГО ВПО Донецкий национальный университет экономики и торговли имени Михаила Туганбарановского. Кафедра международной экономики Антропометрическое соответствие одежды
Антропометрическое соответствие одежды Истеъмолчиларга ичимлик суви ва оқова сув хизматларини кўрсатиш қоидалари
Истеъмолчиларга ичимлик суви ва оқова сув хизматларини кўрсатиш қоидалари Обновления в CSS3
Обновления в CSS3 презентация Листопад
презентация Листопад Организация оказания медицинской помощи детям Заягорбского района
Организация оказания медицинской помощи детям Заягорбского района Гигиена. Понятие. Этапы. Задачи
Гигиена. Понятие. Этапы. Задачи